通心络胶囊对糖尿病周围神经病变KK/Up j-Ay小鼠血管生成的影响
王 超, 王 晓, 张会欣, 邢邯英, 王 杏, 刘 敏, 张 哲
(1.河北省人民医院老年医学重点实验室,河北石家庄050051;2.河北以岭医药研究院药理室,河北石家庄050035)
通心络胶囊对糖尿病周围神经病变KK/Up j-Ay小鼠血管生成的影响
王 超1, 王 晓1, 张会欣2*, 邢邯英1, 王 杏1, 刘 敏1, 张 哲1
(1.河北省人民医院老年医学重点实验室,河北石家庄050051;2.河北以岭医药研究院药理室,河北石家庄050035)
摘要:目的 观察通心络胶囊对糖尿病周围神经病变KK/Upj-Ay小鼠血管生成的影响。方法 KK/Upj-Ay小鼠随机分为模型组、通心络高剂量组、通心络中剂量组和通心络低剂量组,另设C57BL/6小鼠为对照组。灌胃给药12周,测定热痛觉阈值和运动神经传导速度(MNCV);放免法测定血液中内皮素(ET)、血栓素A2(TXA2)和前列环素(PGI2)含有量;Rea1Time PCR(qPCR)和Western b1ot法测定坐骨神经造血祖细胞抗原(CD34)、血管性血友病因子(VWF)和血管内皮生长因子(VEGF)表达。结果 与对照组比较,模型组热痛觉阈值明显降低,MNCV明显减慢(P<0.01);ET和TXA2含有量显著升高(P<0.01);小鼠坐骨神经CD34、VWF、VEGFmRNA和蛋白表达显著降低(P<0.01)。与模型组比较,通心络组小鼠痛觉阈值升高,MNCV明显增快(P<0.05,P<0.01);ET和TXA2含有量明显降低,PGI2含有量上升(P<0.05,P<0.01);CD34、VWF、VEGF mRNA和蛋白表达显著升高(P<0.05,P<0.01)。结论 通心络胶囊可调节血管活性因子、升高CD34、VWF、VEGF表达,改善糖尿病周围神经病变。
关键词:通心络胶囊;糖尿病周围神经病变;CD34;VWF;VEGF
近年来,尽管糖尿病周围神经病变(DPN)在发病机制和治疗方面取得了很大进展,但其机制仍未阐明,药物治疗也并不十分理想,开发疗效确切的新药仍是DPN研究的重要课题[1]。本实验采用由人参、水蛭、全蝎等12味中药材组方的具有通络止痛,益气活血功效的药物通心络胶囊进行干预[2-3]。临床研究发现,通心络对于糖尿病周围神经病变患者的神经症状和体征有明显改善作用,能够显著提高周围神经传导速度[4-5],而DPN的发生发展与微血管病变、血管生成等血管因素密切相关[6]。本实验采用DPN小鼠,用通心络胶囊加以干预,观察通心络胶囊对DPN坐骨神经血管生成的影响,为深入了解DPN的作用机制以及临床用药提供实验参考。
1 材料与方法
1.1 动物 10只25~30 g的SPF级雄性C57BL/6小鼠;40 只30~40 g的SPF级雄性KK/Upj-Ay小鼠。均购自于北京华阜康生物公司,动物合格证号SCXK-(京)2009-0004。
1.2 药品与试剂 通心络胶囊(石家庄以岭药业股份有限公司,批号20110501);内皮素(ET)、血栓素A2(TXA2)和前列环素(PGI2)放免试剂盒购自北京东亚免疫技术研究所;上海生工生物技术公司合成造血祖细胞抗原(CD34)、血管性血友病因子(VWF)和血管内皮生长因子(VEGF)引物;CD34、VWF和VEGF一抗由Abcam公司生产。
1.3 仪器 7300荧光定量PCR仪采购于ABI公司;凝胶成像分析仪为Biorad公司生产;GC-1200 γ全自动放免分析仪购自中科中佳公司;PowerLab生理记录仪购自AD Instrument公司。
1.4 动物分组与给药 按照空腹血糖值(FBG)把KK/ Upj-Ay小鼠(40只)平均分为模型组,通心络高、中、低剂量组,10只C57BL/6小鼠设为对照组。连续12周,通心络高、中、低剂量组每日灌胃给予通心络胶囊,分别相当于4、2、1 g生药/kg;对照组与模型组每日根据小鼠体质量,给予相同体积纯水[2]。
1.5 热痛觉阈值测定和坐骨神经传导速度(MNCV)测定最后一次给药结束后,测定小鼠热痛觉阈值。以小鼠于55℃恒温热板仪上的舔足反应潜伏期作为痛觉阈值。MNCV在小鼠腹腔注射戊巴比妥钠麻醉后,连接PowerLab生理记录仪测得。于小鼠右侧坐骨切迹,踝部与左足底第2趾间分别插入刺激电极与两个记录电极,每隔1 min记录一次双通道复合动作电位,取3次的平均值进行计算[7-9](MNCV=两对记录电极间距离除以两通道复合动作电位潜伏期之差[10])。
1.6 FBG、ET、TXA2和PGI2含有量测定 最后一次给药后,用微量血糖仪测定小鼠FBG水平;按放免试剂盒说明书操作测定ET、TXA2和PGI2水平。
1.7 荧光定量PCR方法测定CD34、VWF和VEGFmRNA的表达 按照实验标准操作步骤提取小鼠新鲜坐骨神经组织总RNA,参照试剂盒说明加样后进行逆转录反应,之后再采用荧光定量qPCR仪进行扩增。内参Gapdh与目的基因引物设计如下。
CD34引物:正向为5′-GCCTGGAACTAAGTGAAGCAT-3′,反向为5′-GCCAAGACCATCAGCAAAC-3′,产物片段175 bp。VWF引物:正向为5′-CCTGGTGGTAGACTTCGGAA-3′,反向为5′-GCAAACCTGGTCAAGCGT-3′,产物片段108 bp。Vegf引物:正向为5′-TGTCTATCAAGGGAGTGTGTGC-3′,反向为5′-TGGAGTATTTCCGTGACCG-3′,产物片段150 bp。内参照Gapdh引物:正向为5′-TGCTGAGTATGTCGTGGAGTC-3′,反向为5′-TGCTGAGTATGTCGTGGAGTC-3′,产物片段143 bp。用仪器自带的分析软件,将对照组设定为1,以相对定量值RQ作为数据进行统计分析。
1.8 Western b1ot法检测CD34、VWF和VEGF蛋白的表达
提取小鼠坐骨神经总蛋白,进行半干法转膜,封闭后按照标准操作步骤依次加入CD34、VWF、VEGF和GAPDH的一抗以及二抗,显影后扫描条带分析其吸光度值,并以CD34、VWF、VEGF与GAPDH的吸光度比值进行数据统计[9]。
1.9 统计学分析 应用SPSS 11.5软件进行ANOVA分析和Dunnett检验处理数据,结果以±s的形式表示。
2 结果
2.1 各组小鼠FBG的变化 给药12周后,各组小鼠FBG均有变化。与对照组相比,模型组FBG升高明显(P<0.01);与模型组相比,通心络组FBG有下降趋势,但无统计学差异(P>0.05)。见表1。
表1 各组小鼠FBG的变化(±s,n=10)

表1 各组小鼠FBG的变化(±s,n=10)
注:与对照组比较,**P<0.01
组别 剂量/ (g.kg-1)FBG/(mmo1.L-1)给药前 第12周对照组- 5.33±0.81 5.51±0.88模型组 - 14.83±2.66** 17.54±2.79**通心络低剂量组 1 14.72±2.78 16.46±2.44通心络中剂量组 2 14.64±2.61 15.84±1.86通心络高剂量组4 14.86±2.31 14.97±2.27
2.2 各组小鼠痛觉阈值及MNCV变化 模型组与对照组小鼠相比,痛觉阈值明显降低,MNCV明显减慢(P<0.01);与模型组相比,通心络中、高剂量组痛觉阈值明显上升,MNCV明显增快(P<0.05,P<0.01)。见表2。
表2 各组小鼠痛觉阈值及MNCV的变化(±s,n=10)
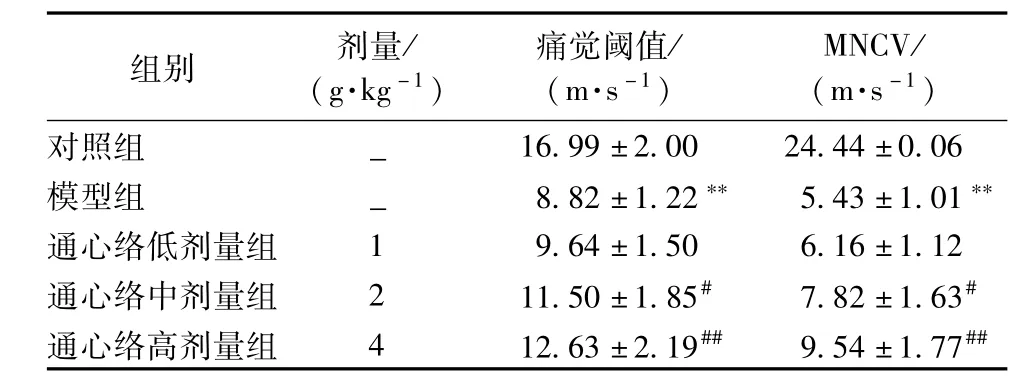
表2 各组小鼠痛觉阈值及MNCV的变化(±s,n=10)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量/ (g.kg-1)痛觉阈值/ (m.s-1)MNCV/ (m.s-1)对照组- 16.99±2.00 24.44±0.06模型组 - 8.82±1.22** 5.43±1.01**通心络低剂量组 1 9.64±1.50 6.16±1.12通心络中剂量组 2 11.50±1.85# 7.82±1.63#通心络高剂量组 4 12.63±2.19## 9.54±1.77##
表3 各组小鼠血液中ET、TXA2和PGI2含有量的变化(±s,n=10)

表3 各组小鼠血液中ET、TXA2和PGI2含有量的变化(±s,n=10)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量/(g.kg-1) ET-1/(pg.L-1) TXA2/(pg.L-1) PGI2/(pg.mL-1)对照组57.18±10.34 247.16±36.61 88.79±15.69模型组 - 71.06±10.53** 305.22±41.19** 97.10±14.83通心络低剂量组 1 66.92±10.94 280.80±43.92 118.03±19.04#通心络中剂量组 2 62.86±7.00 278.04±29.08 136.53±23.95##通心络高剂量组 4 61.58±7.65# 261.27±30.71## 122.54±17.63 -##
2.3 各组小鼠血液中ET、TXA2和PGI2含有量的变化与对照组比较,模型组小鼠ET和TXA2含有量明显升高(P<0.01);与模型组比较,通心络高剂量组ET和TXA2含有量明显降低,通心络组PGI2含有量明显升高(P<0.05,P<0.01)。见表3。
2.4 坐骨神经CD34、VWF、VEGFmRNA表达变化 模型
组CD34、VWF、Vegf mRNA表达明显比对照组下调(P<0.01);通心络中、高剂量组CD34、VWF、Vegf mRNA表达均比模型组显著上升(P<0.05,P<0.01)。见表4。
表4 各组小鼠坐骨神经CD34、VW F、Vegf m RNA表达的变化(±s,n=3)
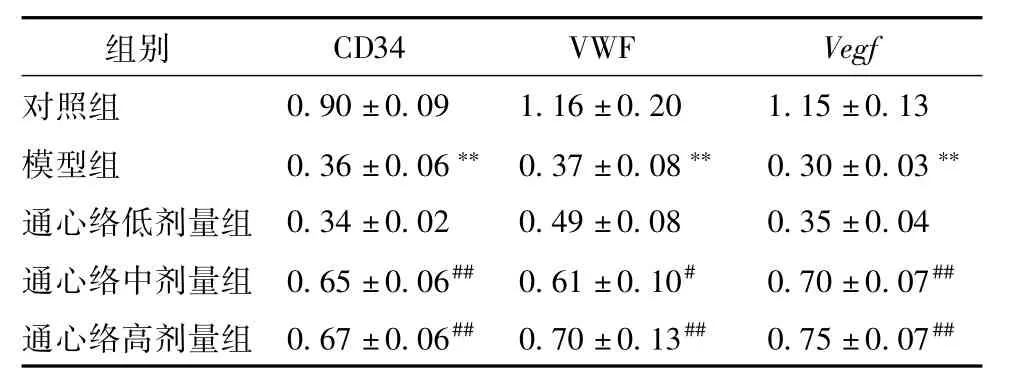
表4 各组小鼠坐骨神经CD34、VW F、Vegf m RNA表达的变化(±s,n=3)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
Vegf对照组组别 CD34 VWF 0.90±0.09 1.16±0.20 1.15±0.13模型组 0.36±0.06**0.37±0.08** 0.30±0.03**通心络低剂量组0.34±0.02 0.49±0.08 0.35±0.04通心络中剂量组 0.65±0.06##0.61±0.10# 0.70±0.07##通心络高剂量组 0.67±0.06##0.70±0.13## 0.75±0.07##
2.5 坐骨神经CD34、VWF、VEGF蛋白表达变化 模型组CD34、VWF、VEGF蛋白表达明显低于对照组(P<0.01);与模型组比较,通心络组CD34蛋白表达显著上升,中、高剂量组VWF、VEGF蛋白表达也均显著上升(P<0.05,P<0.01)。见表5、图1。
表5 各组小鼠坐骨神经CD34、VW F、VEGF的蛋白表达(±s,n=3)

表5 各组小鼠坐骨神经CD34、VW F、VEGF的蛋白表达(±s,n=3)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
CD34 VWF VEGF对照组组别0.97±0.13 1.27±0.20 0.79±0.09模型组 0.29±0.03**0.42±0.06** 0.28±0.05**通心络低剂量组 0.40±0.06#0.53±0.08 0.36±0.06通心络中剂量组 0.45±0.07# 0.68±0.10# 0.53±0.09#通心络高剂量组 0.68±0.12# 0.76±0.12# 0.66±0.10##

1.对照组 2.模型组 3.通心络低剂量组 4.通心络中剂量组 5.通心络高剂量组图1 各组W estern blot结果
3 讨论
在本实验中,我们采用了具有高血糖、高胰岛素抵抗特点的自发性II型糖尿病KK/Upj-Ay小鼠,该小鼠表现出低的痛觉阈值及减慢的神经传导速度,可作为DPN动物模型[11]。我们前期实验结果也观察到了光镜电镜下可见坐骨神经毛细血管内皮肿胀,管腔狭窄,表明DPN小鼠存在神经内膜血管病变[12]。
血管障碍、血流动力学变化及血管活性物质减少等是神经微血管病变的重要表现。ET是已知的强血管收缩剂,ET大量释放可通过影响血流动力学的改变参与微血管病变的发病机制[13]。TXA2是一种重要的缩血管物质,而PGI2是一种重要的抑制血管收缩物质,两者之间的动态平衡失调最终导致缺血、缺氧性神经损害。临床研究发现,DPN患者给予前列腺素E1治疗能显著改善患者的神经系统症状[14]。因TXA2、PGI2非常容易自发水解成稳定的代谢产物:TXB2与6-Keto-PGF1a,所以测定TXB2、6-K-PGF1a的含有量可以分别反映TXA2和PGI2的含有量[15]。我们实验发现DPN小鼠TXA2/PGI2的平衡被破坏,给予通心络胶囊治疗后,血液中ET-1水平下降,TXA2代谢物TXB2含有量下降,PGI2代谢物6-K-PGF1 a含有量上升,表明通心络胶囊通过降低ET-1水平、调节TXA2/PGI2稳态,改善受损周围神经微血管病变,提高神经传导速度。
CD34、VWF分别是毛细血管和较大管径血管标记物[16 -17],文献报道CD34抗原的表达与细胞增殖关系十分密切[18],CD34抗原对血管生成期间的内皮细胞的黏附和/或转移有一定的影响[19]。VWF主要由血管内皮细胞合成,能够促进血小板黏附至内皮下结构[20]。我们实验发现DPN小鼠坐骨神经内的CD34、VWF的蛋白和基因表达均下降,通心络胶囊干预后能明显上调CD34、VWF表达,提示通心络胶囊通过促进CD34、VWF表达,促进坐骨神经中血管形成。VEGF是血管内皮生长因子,能促进不同来源内皮细胞分裂增殖,促使内皮细胞迁移,诱导血管生成[21],临床上常用血管扩张药改善糖尿病患者血流不足和提高神经传导速度[22]。通心络治疗后能够显著上调DPN小鼠坐骨神经VEGF的水平,提示我们通心络可能通过升高VEGF表达,促进周围神经中毛细血管新生,进而改善DPN。
综上所述,通心络胶囊可以通过调节血管活性因子、升高CD34、VWF、VEGF表达,改善周围神经微血管病变,促进血管形成,提高神经传导速度,阻滞DPN的发生发展。但我们应看到中医药治疗糖尿病周围神经病变是在整体观念下的多靶点、多途径的治疗,因此,进行系统全面深入的作用机制研究才能真正地为临床中药研发提供理论基础。
参考文献:
[1] 董 琪,李全民.糖尿病周围神经病变发病机制的研究进展[J].现代仪器与医疗,2015,21(2):20-22,34.
[2] 王 超,张会欣,邢邯英,等.通心络胶囊抑制p38 MAPK磷酸化抑制糖尿病周围神经病变小鼠氧化应激[J].中国药理学通报,2015,31(5):726-730.
[3] 王 超,张会欣,邢邯英,等.通心络胶囊对糖尿病周围神经病变小鼠黏附分子的作用及其机制[J].中国实验方剂学杂志,2015,21(6):95-98.
[4] 葛近峰,林育红,汪 莹,等.通心络胶囊治疗糖尿病周围神经病变临床疗效评价[J].中国中医基础医学杂志,2011,17(10):121-123.
[5] 王 超,张会欣,邢邯英,等.通心络胶囊改善小鼠糖尿病周围神经病变的保护作用[J].中国临床药理学杂志,2015,31(10):874-877.
[6] Sytze Van Dam P,Cotter M A,Bravenboer B,et al.Pathogenesis of diabetic neuropathy:focus on neurovascu1ar mechanisms[J].Eur JPharmacol,2013,719(1-3):180-186.
[7] 张会欣,王 超,朱慧明,等.周络通胶囊激活转录因子Nrf2抑制糖尿病周围神经病变小鼠氧化应激[J].中国药理学通报,2013,29(1):136-139.
[8] 王宏涛,张会欣,赵韶华,等.糖尿病周围神经病变小鼠神经生长因子及其受体的变化及周络通胶囊的干预作用[J].时珍国医国药,2013,24(3):547-549.
[9] 魏 刚,王宏涛,张会欣,等.周络通胶囊对糖尿病周围神经病变模型小鼠坐骨神经细胞凋亡的保护作用研究[J].中国药房,2013,24(35):3265-3268.
[10] 王 超,张会欣,邢邯英,等.通心络胶囊对糖尿病周围神经病变小鼠神经再生的作用[J].中药药理与临床,2014,30(6):134-136.
[11] 张会欣,赵韶华,王宏涛,等.周络通胶囊对糖尿病周围神经病变小鼠坐骨神经TGF-β1/Smad3信号通路的影响[J].中成药,2013,35(4):652-655.
[12] 张会欣,魏 刚,王宏涛,等.周络通胶囊对糖尿病周围神经病变小鼠坐骨神经糖基化终末产物及受体的影响[J].中国实验方剂学杂志,2012,18(23):168-172.
[13] Paradis A,Zhang L.Ro1e of endothe1in in uterop1acenta1circu-1ation and feta1 vascu1ar function[J].Curr Vasc Pharmacol,2013,11(5):594-605.
[14] Deng H,Yin J,Zhang J,et al.Meta-ana1ysis ofmethy1coba1-amin a1one and in combination with prostag1andin E1in the treatment of diabetic periphera1 neuropathy[J].Endocrine,2014,46(3):445-454.
[15] 严灿荣,梁轩伟,冯晓津,等.兔眼急性高眼压对视神经血栓素A2和前列环素的影响[J].第二军医大学学报,2005,26(7):820-821.
[16] Mü11er A M,Hermanns M I,Skrzynski C,et al.Expression of the endothe1ia1markers PECAM-1,VWF,and CD34 in vivo and in vitro[J].Exp Mol Pathol,2002,72(3):221-229.
[17] Doo1ey D C,Oppen1ander B K,Xiao M.Ana1ysis of primitive CD34-and CD34+hematopoietic ce11s from adu1ts:gain and 1oss of CD34 antigen by undifferentiated ce11s are c1ose1y 1inked to pro1iferative status in cu1ture[J].Stem Cells,2004,22 (4):556-569.
[18] Díaz-F1ores L,Gutiérrez R,García M P,et al.CD34+stroma1ce11s/fibrob1asts/fibrocytes/te1ocytes as a tissue reserve and a principa1source ofmesenchyma1ce11s.Location,morpho1ogy, function and ro1e in patho1ogy[J].Histol Histopathol,2014,29(7):831-870.
[19] 张玉波,伍亚民,刘 磊,等.NGF促再生周围神经中血管生成及其机制研究[J].脑与神经疾病杂志,2008,15 (6):401-404.
[20] Lenting P J,CasariC,Christophe OD,etal.von Wi11ebrand factor:the o1d,the new and the unknown[J].JThromb Haemost,2012,10(12):2428-2437.
[21] 尹登科,杨 晔,尹娟娟,等.桃红四物汤对蛋白酶激活受体激活诱导血小板释放VEGF和Endostatin的影响[J].中成药,2012,34(9):1631-1635.
[22] Mahdy R A,Nada W M,Hadhoud K M,et al.The ro1e of vascu1ar endothe1ia1growth factor in the progression of diabetic vascu1ar comp1ications[J].Eye,2010,24(10):1576-1584.
*通信作者:张会欣(1976—),女,博士,从事抗糖尿病药物研究。Te1:(0311)85901715,E-mai1:hxzhang76@sohu.com
作者简介:王 超(1975—),男,博士,从事老年病研究。Te1:(0311)85988007,E-mai1:cwyx163@163.com
基金项目:十二五“重大新药创制”科技重大专项(2011ZX09101-004-02);河北省中医药管理局科研计划项目(2014155)
收稿日期:2014-08-27
doi:10.3969/j.issn.1001-1528.2016.01.040
中图分类号:R285.5
文献标志码:B
文章编号:1001-1528(2016)01-0173-04

