黄芩的化学成分与药理作用研究进展
郑勇凤, 王佳婧, 傅超美, 王建新
(1.成都中医药大学,四川成都611137;2.复旦大学,上海201203;3.黑龙江中医药大学,黑龙江哈尔滨150040)
黄芩的化学成分与药理作用研究进展
郑勇凤1,2, 王佳婧2,3, 傅超美1*, 王建新2*
(1.成都中医药大学,四川成都611137;2.复旦大学,上海201203;3.黑龙江中医药大学,黑龙江哈尔滨150040)
摘要:黄芩为临床常用的清热燥湿药,主要含有黄酮及其苷类、萜类化合物及挥发油等成分,具有解热、抗炎、抗微生物、抗肿瘤、抗氧化等药理作用,对消化系统、心血管系统、神经系统等疾病具有一定的治疗作用。近年来,国内外对黄芩的化学成分和药理作用开展了大量的研究,本文对此进行了综述,以期为黄芩的进一步开发利用提供依据。关键词:黄芩;化学成分;药理作用
王建新(1971—),男,教授,从事新型给药系统研究,Te1:(021)51980002,E-mai1:jxwang@fudan.edu.cn
黄芩始载于《神农本草经》,别名山茶根、土金茶根,为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根,味苦,性寒,归肺、胆、脾、小肠、大肠经,具有清热燥湿,泻火解毒,止血,安胎[1]的功效,用药历史悠远,现临床常用于湿温、暑湿,胸闷呕恶,肺热咳嗽等证。为中医临床和中成药中最为常用的中药之一,如根据贾蔷等[2]的统计,在《中药部颁标准》中有477个成药含有黄芩,包含主治疾病153种。因此,对黄芩的研究一直广受关注,国内外学者对黄芩的栽培鉴定、加工炮制、物质基础、药理作用、临床应用等方面进行了广泛深入的研究报道,本文通过收集、整理大量文献,对近年来黄芩的化学成分及药理作用研究进展进行综述,以期为黄芩药材的进一步开发与利用提供一定依据。
1 化学成分
化学成分是药材发挥多种作用的基础,开展化学成分的分离纯化鉴定及其药理作用的研究,是探索黄芩深度开发与综合利用的前提。
1.1 黄酮及其苷类 黄酮及其苷类是黄芩的主要药效物质基础,目前从黄芩属药材中已发现了40余种黄酮类化合物[3],其中黄酮及黄酮醇类(见图1、表1)有黄芩苷、黄芩素、汉黄芩苷、汉黄芩素等[4];二氢黄酮及二氢黄酮醇类(见图2、表1)多在C5和C7有羟基取代,常见的有二氢黄芩苷、7,2′,6′-三羟基-5-甲氧基二氢黄酮、5,7,2′,6′-四羟基二氢黄酮醇等;还含有4′,5,7-三羟基-6-甲氧基黄烷酮、2′,6′,5,7-四羟基黄烷酮等黄烷酮类成分(见图3、表1)[5]以及查尔酮类成分(见图4、表1)2,6,2′,4′-四羟基-6' -甲氧基查尔酮[6]等。炮制是中药临床应用的特点,中药材炮制前后其所含成分可能发生改变而产生减毒增效的作用,黄芩的炮制品主要有酒黄芩、炒黄芩、黄芩炭等,研究发现,黄芩的不同炮制品中,其黄酮苷类成分含有量有所降低而黄酮类苷元成分含有量增高[7],物质基础的改变对黄芩及其炮制品的各类药理作用产生了一定影响。
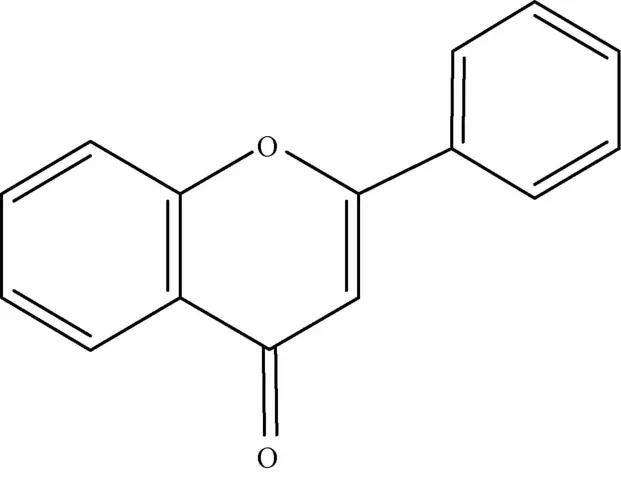
图1 黄酮类母核

图2 二氢黄酮类母核
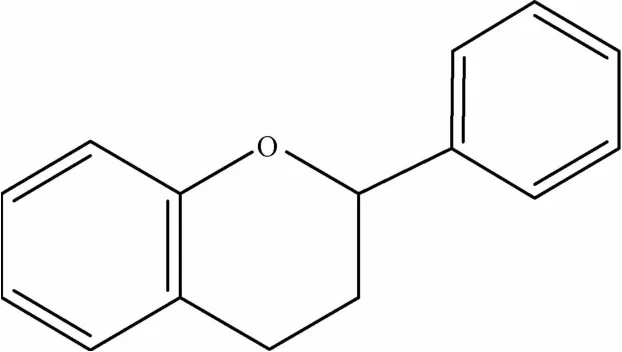
图3 黄烷酮类母核
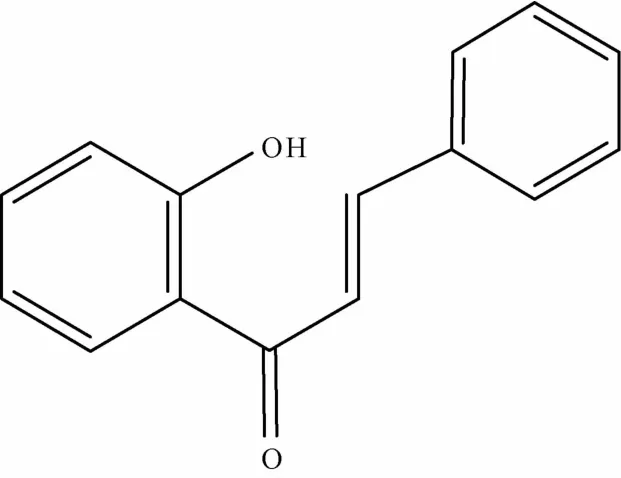
图4 查尔酮类母核

表1 黄芩中主要的黄酮及其苷类成分
1.2 萜类化合物 黄芩属植物中含有多种倍半萜木脂素苷类及二萜类化合物。已从尼泊尔匍匐黄芩中分离得到3种新的倍半木脂素苷类[8];除Scuterpenin H外,魏顺发[9]等从黄芩属植物中分离得到的二萜类多为新克罗烷型双环二萜类化合物;Shim从黄芩属植物中分离得到了一种新型的二萜化合物Barbate11arine F并确定了其结构[10]。由文献报道可知,除黄酮类成分以外,黄芩及其同属植物中尚含有多种萜类成分,但对于黄芩中萜类成分药理作用的文献报道较少,值得进一步深入研究。
1.3 挥发油 近年来黄芩中的挥发油成分得到了关注,多个研究通过不同的提取、分析方法对黄芩中所含的挥发油类成分进行了分析。巩江[11]等通过水蒸气蒸馏法提取得到黄芩地上部分的挥发油成分,并采用气质分析方法鉴定了其中37种化学成分,主要包括烯丙醇、石竹烯等;舒云波[12]等利用超临界提取技术提取得到的黄芩挥发油成分,经GC-MS分析,鉴定了其中64种成分,如棕榈酸、薄荷酮、亚油酸甲酯等。宋双红[13]等比较了黄芩花、茎叶、根和种子中的挥发油成分及含有量差异,表明黄芩各部位均还有大量挥发油活性成分,具有较高的开发及应用前景。
1.4 微量元素 药材中微量元素的种类与含有量已逐渐成为衡量药材质量,判别药材道地性的重要指标。黄芩中含有多种微量元素,这些微量元素不仅自身具有生理活性,还能与药材中所含的有机分子形成配合物以发挥药效。李化[14]等采用电感耦合等离子体原子发射光谱法测定了10批黄芩药材中Ca、Mg、Cu、Zn、Fe、Mn等含有量,结果表明其含有量存在显著性差异,为丰富和发展黄芩多指标质量评价体系提供了科学依据。
1.5 其他 此外,黄芩中还含有多糖[15-17]、β-谷甾醇、苯甲酸及黄芩酶[18-19]等成分。
2 药理作用
2.1 解热、抗炎 中医遣方用药,辨证施治,实热证多以“热者寒之”的治则为指导,黄芩性寒,因此在临床上对实热证的治疗有一定功效。近年来对黄芩及其成分的解热抗炎机制进行了较为深入的研究。黄芩苷和黄芩素能够通过干扰花生四烯酸的代谢通路、抑制细胞因子的活性[20-23]等产生解热抗炎作用。李倩楠[20]等通过灌胃给予酵母诱导的发热大鼠黄芩苷后,测定其血浆、下丘脑及脑脊液中的细胞因子含有量,证实黄芩苷具有明显的解热作用,并推测其机制可能与减少肿瘤坏死因子-a(TNF-a)、白介素-1β(IL-1β)的量有关。研究表明[21]通过静脉注射给予内毒素诱导的发热家兔黄芩苷后,发热家兔体温明显降低,推测黄芩苷可能通过减少TNF-a的量和抑制下丘脑中N-甲基-N-天冬氨酸受体依赖羟基旁路而发挥解热作用。付璟[22]等通过测定二甲苯诱发急性炎症的小鼠耳廓肿胀度及血清中TNF-a及IL-1的量,表明黄芩素可明显抑制模型小鼠耳廓的肿胀,具有体内抗炎作用。Woo K J[23]等建立了脂多糖诱导的RAW264.7细胞炎症模型,研究黄芩苷及黄芩素的抗炎机制,发现黄芩素能够抑制环氧合酶COX-2基因的表达,以阻止转录因子C/EBPβ与DNA结合,从而抑制花生四烯酸的代谢而产生抗炎作用。此外,黄芩苷能通过抑制TNF-a mRNA,P选择素(P-se1ectin)蛋白的表达[24],改善血液微循环[25]等,降低急性胰腺炎大鼠体内炎症因子的释放,从而明显降低急性胰腺炎大鼠的死亡率。
2.2 抗微生物 黄芩具有较强的抑制微生物作用,其水煎液具有广谱抑菌作用,此外尚能抗多种真菌、病毒、支原体、衣原体等微生物。黄芩及其有效成分抑制细菌、真菌、衣原体的生长,可能与其抑制ATP合成酶、微生物被膜的形成及抑制某些蛋白的表达相关[26-28]。现代研究表明,黄芩素对细菌类如大肠杆菌[26]、固着微球菌、人型葡萄球菌、表皮葡萄球菌,真菌类如白色念珠菌[27]等微生物具有非常好的抑制作用;黄芩苷对幽门螺杆菌、金黄色葡萄球菌、酵母型真菌、肺炎衣原体[29-31]等均表现出了一定的抑制作用,最新研究发现黄芩苷能够增加酵母型真菌白色念珠菌的细胞凋亡率,其机制可能与黄芩苷抑制琥珀酸脱氢酶(SDH)、Ca2 +-Mg2 +ATP酶的活性,增加细胞质中Ca2 +的量及破坏白色念珠菌的超微结构有关[32]。黄芩素及黄芩苷与庆大霉素、氟康唑、β-内酰胺类抗生素[33-35]等联用,将产生协同作用,抗菌作用增强。
黄芩的有效成分尚对多种病毒有抑制作用,其作用机制可能与抑制病毒复制及保护宿主细胞有关。黄芩苷能在抗人类免疫缺陷病毒(HIV-1)感染的早期阶段阻止DNA的复制而产生抗HIV病毒的作用[36];黄芩苷在体内外均具有抗流感病毒作用,最新研究发现,黄芩苷能通过调节病毒蛋白NS1,致使细胞中干扰素诱导的抗病毒信号上调、PI3K/Akt信号减少,而对甲流病毒H1N1-pdm09体内外均产生抑制作用[37];近期研究发现,黄芩苷亦是黄芩抑制登革病毒活性的主要有效成分[38]。黄芩素能够通过抑制表皮生长因子络氨酸激酶的活性及阻断抗人巨细胞病毒(HCMV)的核转位,产生抗HCMV病毒的作用[39]。此外,黄芩苷和黄芩素等有效成分对呼吸道合胞体病毒(RSV)、乙型肝炎病毒(HBV)、柯萨奇病毒(CVB3)、猪生殖和呼吸系统综合征病毒(pRRSV)[40-41]等病毒均有一定的抑制作用。
2.3 清除自由基、抗氧化 自由基具有强氧化性,可损害机体的细胞和组织,进而引起慢性疾病及衰老。黄芩中黄酮类成分的分子结构中多含有酚羟基,故具有一定的清除自由基、抗氧化作用。黄芩素、黄芩苷是黄芩中有效的抗氧化剂,对多种自由基,如超氧化物阴离子、氢过氧化物酶、烷过氧自由基、羟自由基等均具有强大的清除作用[42]。此外,黄芩素及黄芩苷能有效抑制黄嘌呤氧化酶代谢产生氧自由基,可用于治疗与自由基及氧化应激相关的疾病。苏宁[43]等从抗氧化应激反应的角度探讨了黄芩苷对糖尿病肾病大鼠肾功能影响的机制,认为其可能是通过提高肾脏抗氧化系统的功能而减轻肾脏局部氧化应激反应。除黄芩素及黄芩苷外,研究[44]也发现黄芩中的黄芩黄素、汉黄芩黄素等成分也具备一定的抗氧化作用。
2.4 抗肿瘤 随着对黄芩研究的深入,陆续发现了黄芩对多种肿瘤细胞均具有一定的抑制作用。黄芩苷、黄芩素、汉黄芩苷及汉黄芩素等成分是黄芩抗肿瘤作用的物质基础,但其机制各不相同。黄芩苷可通过诱导肿瘤细胞凋亡,抑制大鼠胰岛细胞瘤细胞增殖[45]。黄芩素可使人脐静脉内皮细胞停滞在G1/S期,抑制新生血管形成从而产生抗肿瘤作用[46];黄芩素还可抑制皮肤癌A431细胞的迁移和侵袭达到抗肿瘤目的[47]。最新研究发现,汉黄芩苷能通过诱导肿瘤细胞凋亡而抑制恶性胶质瘤的生长[48],而汉黄芩素能上调自然杀伤细胞(NK细胞)GraB等的表达,增强NK细胞对胃癌MKN45细胞的影响[49],能通过抑制瘤体端粒酶基因hTERT的表达而抑制人卵巢癌细胞株SKOV3裸鼠移植瘤的生长[50]。黄芩茎叶总黄酮也有抗Wa1ker-256瘤株肿瘤细胞转移、侵袭的作用[51]。综上所述,黄芩具有一定的抗肿瘤活性且抗瘤谱广,可作用在肿瘤细胞生长的多个环节,起到抗肿瘤的作用。
2.5 保肝、抗溃疡活性 研究表明,黄芩苷具有保护肝损伤、治疗慢性肝炎、抗肝纤维化等作用,其作用机制与其抑制炎症介质的分泌以及清除自由基、抗氧化密切相关。黄芩苷可能通过降低转化生长因子-β1(TGF-β1),TNF-a、IL-6的量以及抑制血小板衍生因子-β(PDGF-β)受体的表达,起到改善四氯化碳所致的大鼠肝纤维化的作用[52]。黄芩苷元可能通过抑制细胞因子NO的生成,从而对四氯化碳造成的小鼠肝损伤起到保护作用[53]。如黄芩苷胶囊,即由黄芩中提取的黄芩苷制备的胶囊制剂,对乙型肝炎表面抗原、e抗原、核心抗原均有较显著的抑制作用,且可在一定程度上抑制乙型肝炎病毒DNA的复制;用药后能明显降低谷丙转氨含量,对肝脏有较好的保护作用,临床上用于急、慢性肝炎、迁延性肝炎的辅助治疗[54]。最新研究表明,黄芩苷可能通过促CD4+CD29+增殖作用,调节溃疡性结肠炎外周血维甲酸相关孤儿核受体(RORC)、叉状头转录因子P3(Foxp3)mRNA的表达水平及其他多方面[55 -56]的免疫抑制调节免疫平衡而缓解溃疡性结肠炎的炎症反应。此外,黄芩的根、叶提取物也具有一定的抗溃疡活性。
2.6 抗缺血再灌注损伤 黄芩的心脑血管保护活性主要表现在对心肌缺血再灌注损伤、脑缺血再灌注损伤的保护,改善动脉粥样硬化病变进展以及降血压、抗血栓等方面。近期研究表明,心肌细胞缺血再灌注时,黄芩素能使心肌细胞的收缩能力恢复而起到保护作用[57];静脉注射黄芩素还可能通过降低氧化应激反应和心肌的炎症反应,从而改善内毒素休克大鼠心肌的收缩能力[58]。黄芩苷可能通过抑制Caspase-3的表达,促进热休克蛋白70(HSP70)表达,从而对大鼠局灶性脑缺血-再灌注损伤起到保护作用[59-60]。最新研究表明,黄芩苷还可以通过调节Foxp3的表达,促进Treg细胞的功能,通过脂质调节及免疫调节以改善动脉粥样硬化的病变进展[61]。此外,亦有研究报告称,黄芩茎叶总黄酮对心肌缺血再灌注有保护作用;黄芩素不仅可以影响正常大鼠的血压,还可以降低高血压大鼠的血压;黄芩黄素可能具有抗血栓形成的作用。
2.7 保护神经元 现代研究表明黄芩苷及黄芩素等成分对多种神经元具有保护作用,可能成为治疗帕金森等神经系统疾病的潜在药物。黄芩苷可以减少Fas蛋白和FasL蛋白的表达,对新生缺氧缺血性脑损伤(HIBD)小鼠的神经元起到保护作用[62];最新研究[63]还发现,黄芩苷能上调AMPA受体的表达,抑制CUMS抑郁模型大鼠神经元凋亡,证实黄芩苷具有抗抑郁的作用。黄芩素可以保护C57BL/6小鼠的海马神经元免受损伤,改善γ-射线全脑辐射导致其学习记忆能力下降的情况[64];能诱导PC12神经元转化,增加黑质内酪氨酸羟化酶阳性神经元的数量,保护6-羟多巴胺(6-OHDA)诱导的帕金森神经损伤[65];最新研究表明,黄芩苷元能减少小鼠黑质和纹状体中细胞因子的上调,从而有望成为治疗小鼠帕金森疾病的有效药物[66]。黄芩素对DA能神经元也能起到保护作用,黄芩素能激活Keap1/ Nrf2/HO-1通路、PKC a和PI3K/AKT信号通路,防止6-OHDA诱导的PC12细胞的氧化损伤[67]。最新研究显示,黄芩苷除了对多种神经元具有保护作用以外,还具有改善脊髓结扎大鼠神经性疼痛的药理作用,其机制可能与黄芩苷抑制重组人组蛋白去乙酰化酶-1(HDAC1)的表达以及防止脊髓灰质背角的组蛋白H3乙酰化有关[68]。
2.8 调节免疫 黄芩中的有效成分具有免疫抑制和免疫增强的双向调节作用,有望用于多种过敏性疾病的治疗。黄芩苷对刀豆蛋白(ConA)或佛波醇酯类多克隆刺激剂(PDB)和离子霉素(Lon)诱导的小鼠CD3+T细胞增殖有明显抑制作用且表现出明显的周期特异性,提示黄芩苷具有发展成为免疫抑制剂的潜力[69];同时,黄芩苷也具有增强机体免疫的作用,黄芩苷能显著减轻卡介苗(BCG)和脂多糖(LPS)造成的免疫性肝损伤小鼠谷丙转氨酶(ALT)、门冬氨酸氨基转移酶(AST)的升高,减轻肝细胞坏死,促进肝细胞增生[70]。黄芩苷元可以通过线粒体途径激活小鼠淋巴细胞凋亡的能力,而有望成为免疫性肝炎的潜在治疗药物[71];黄芩苷元能调节过敏性皮炎NC/Nga小鼠的分子介质和免疫细胞功能,在治疗过敏性皮炎方面可能发挥重要作用[72];最新研究表明,汉黄芩素能下调卵清蛋白(OVA)诱导的Th2免疫反应,可能成为治疗经血清免疫球蛋白(IgE),白介素-5(IL-5)调节的过敏性疾病的有效成分[73]。
2.9 其他 黄芩及其有效成分还具有治疗和预防糖尿病及其并发症、保护人牙周膜成纤维细胞、抗寄生虫、安胎、抑制脂质堆积、抗光老化等作用。黄芩苷能降低链脲酶素诱导的糖尿病大鼠的血糖浓度[74]。黄芩素对大鼠糖尿病肾病、糖尿病视网膜病变等糖尿病并发症都有一定的治疗作用。研究表明,黄芩苷能促进人牙周膜成纤维细胞的增殖,在牙周组织生长和分化的基因调节中扮演着重要的角色,有望成为牙周再生的有效药物[75]。中医认为,大苦者能驱虫甚至杀虫,而黄芩味苦,且现代药理的体外实验也已证实,黄芩素及黄芩苷对阴道毛滴虫具有明显的抑制和杀灭作用[76]。黄芩作为“安胎圣药”,其清热安胎功效早已在临床上得到证实,研究发现,其机理可能与黄芩苷能够抑制TNF-a诱导的人脐静脉血管内皮细胞的凋亡有关[77]。除上述药理作用以外,学者们也陆续发现了一些黄芩的新的药理作用。研究显示,黄芩苷元在斑马鱼动物模型中能通过控制3T3-L1细胞的细胞周期及其m-TOR信号,从而产生抑制脂质堆积的作用[78]。最新研究表明,黄芩苷在体内外均具有明显的抗由紫外线(UVB)导致的光老化作用,在光老化治疗方面表现出一定的潜力,其机制可能与黄芩苷通过减少相关衰老蛋白的表达,增加胶原的量并降低胶原的退化,从而诱导皮肤成纤维细胞增生有关[79]。
3 展望
黄芩作为一味常用的中药,成分复杂,且其中多种有效成分均可作用于不同的靶点、不同环节产生多种药理作用,对于多种疾病均有良好的治疗作用。但目前对其研究仍不够深入,应进一步从以下几个方面开展研究:①应当继续对黄芩活性成分的成药性进行深入探究。目前除黄芩苷外,黄芩中的众多活性成分均未被开发成为药物,应对其中具有明显药理作用的成分或体内代谢产物等进行成药性的系统研究,并通过进行结构修饰、构建构效关系等,开展基于黄芩成分母核的衍生物研究。②应开展黄芩有效部位的研究:黄芩中有很多活性和结构类似的化合物群,如苷或苷元类成分,可以通过对这些有效部位的药效学进行系统评价,以及与其他药材有效部位的组合,开发组分中药。③应加强黄芩成分研究的系统性:目前关于黄芩成分的药理作用及机制的研究在不断深入,新的药理作用也不断被发现,但往往只是开展某一作用的某一方面的研究,缺乏较为全面系统的研究,应开展包括分子、细胞、动物实验等多个层次的研究,并通过与其他药物的对照,加强研究的深度与针对性,挖掘其新的功效内涵,从中开发出作用显著、机理明确的创新药物,并将研究成果运用于临床。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:282-283.
[2] 贾 蔷,申 丹,唐仕欢,等.含黄芩中成药用药规律分析[J].中国中药杂志,2014,39(4):634-639.
[3] 金 敏.黄芩中黄酮类化学成分研究进展[J].中国民族医药杂志,2008,9(9):55-56.
[4] 肖丽和,王红燕,宋少江.滇黄芩化学成分的分离与鉴定[J].沈阳药科大学学报,2003,20(3):181-183.
[5] 温华珍,肖盛元,王义明,等.黄芩化学成分及炮制学研究[J].天然产物研究与开发,2004,16(6):575-581.
[6] 王孟华,曲 玮,梁敬钰.黄芩的研究进展[J].海峡药学,2013,25(9):6-13.
[7] 陈佩东,徐丹洋,李 芳,等.UPLC-MS法分析黄芩炮制前后化学成分变化[J].中成药,2013,35(4):784-789.
[8] Bruno M,Vassa11o N,Simmonds M S J.A diterpenoid with antifeedant activity from Scutellaria rubicunda[J].Phytochemistry,1999,50(6):973-976.
[9] 魏顺发,屈爱桃,任凤霞,等.黄芩属植物中二萜类成分研究进展[J].国际药学研究杂志,2011,38(2):123-129.
[10] Shim S H.A new diterpenoid from aeria1 parts of Scutellaria barbata[J].Chem Nat Compd,2014,50(2):291-292.
[11] 巩 江,倪士峰,刘阳子,等.黄芩地上部分挥发性物质气相色谱-质谱研究[J].安徽农业科学,2009,37(32):15844-15845.
[12] 舒云波,张峻松,张建荣,等.超临界提取黄芩挥发油及在卷烟中的应用[J].郑州轻工业学院学报:自然科学版,2009,24(2):5-7.
[13] 宋双红,王喆之.黄芩不同部位挥发油成分分析[J].中草药,2010,33(8):1265-1270.
[14] 李 化,刘 静,付梅红,等.黄芩中金属元素水溶特性和含量特征分析[J].光谱学与光谱分析,2014,34(8):2264-2267.
[15] 张文青,闰永红,林雀跃.不同产地黄芩中多糖的测定[J].国外医药:植物药分册,2008,23(5):212-214.
[16] 杨武德,石平宝,王建科.黄芩生品及不同炮制品中多糖和总糖的含量分析[J].贵阳中医学院学报,2009,31 (4):80-81.
[17] 董安珍,侯关林.黄芩生品及炮制品中多糖提取工艺的研究[J].河北农业科学,2010,15(5):105-108.
[18] 徐玉田.黄芩的化学成分及现代药理研究进展[J].光明中医,2010,25(3):544-545.
[19] 李堆淑.中药黄芩化学成分的研究进展[J].江西农业科学,2013,25(8):51-54.
[20] 李倩楠,葛晓群.黄芩苷的解热作用及对细胞因子的影响[J].中国中药杂志,2010,35(8):1068-1072.
[21] Tsai CC,Lin M T,Wang JJ,et al.The antipyretic effects of baica1in in 1ipopo1ysaccharide-evoked fever in rabbits[J].Neuropharmacology,2006,51(4):709-717.
[22] 付 璟,石继和.黄芩素体外抑菌与体内抗炎作用研究[J].中国药房,2014,25(23):2136-2138.
[23] Woo K J,Lim J H.Suh S I,et al.Differentia1 inhibitory effects of baica1ein and baica1in on LPS-induced cyc1ooxygenase-2 expression through inhibition of C/EBPβDNA-binding activity[J].Immunobiology,2006,211(5):359-368.
[24] Zhang X P,Tian H,Zhang J,et al.Inf1uence of baica1in on TNF-a mRNA,caspase-3 and P-se1ectin expression in pancreatic tissue of rats with severe acute pancreatitis[J].Indian J Gastroent,2009,28(4):131-135.
[25] Zhang X P,Tian H,Wu C J,et al.Effect of Baica1in on inf1ammatorymediator 1eve1s and microcircu1ation disturbance in rats with severe acute pancreatitis[J].Pancreas,2008,38 (7):732-738.
[26] Chinnam N,Dadi P K,Sabri S A,et al.Dietary biof1avonoids inhibit Escherichia coli ATP synthase in differentia1manner[J]. Int JBiolo Macromol,2010,46(5):478-486.
[27] Dai B D,Cao Y Y,Huang S,et al.Baica1ein induces programmed ce11death in Candida albicans[J].JMicrobiol Biotechnol,2009,19(8):803-809.
[28] 邝枣园,符林春,罗海燕,等.从受体角度探讨黄芩苷对肺炎衣原体感染细胞的干预作用[J].广州中医药大学学报,2005,22(3):210-213.
[29] 吴 静,胡 东,王克霞.黄芩和黄芩苷对幽门螺杆菌的体外抗菌活性研究[J].中药材,2008,31(5):707-710.
[30] 陈勇川,谢林利,熊丽蓉,等.黄芩苷/黄芩素对耐甲氧西林金黄色葡萄球菌抗药性的逆转作用研究[J].中国药房,2008,19(9):644-646.
[31] 吴 伟,黄衍寿,刘煜德,等.肺炎衣原体对动脉硬化斑块面积的影响及黄芩苷的干预作用[J].广州中医药大学学报,2006,23(4):322-325.
[32] Yang S L,Fu Y Y,Wu X Z,et al.Baica1in prevents Candida albicans infections via increasing its apoptosis rate[J].Biochem Biophys Res Commun,2014,451(1):36-41.
[33] Chang PC,Li H Y,Tang H J,et al.In vitro synergy of baica-1ein and gentamicin against vancomycin-resistant Enterococcus [J].JMicrobiol Immun Infect,2007,40(1):56-61.
[34] Huang S,Cao Y Y,Dai B D,et al.In vitro synergism of f1uconazo1e and baica1ein against c1inica1 iso1ates of Candida albicans resistant to f1uconazo1e[J].Biol Pharm Bull,2008,31 (12):2234-2236.
[35] Jang E J,Cha S M,ChoiS M,etal.Combination effects of baica1ein with antibioticsagainstora1pathogens[J].Arch Oral Biol,2014,59(11):1233-1241.
[36] Bao Q L,Tao F,Yao D Y,et al.F1avonoid baica1in inhibits HIV-1 infection at the 1eve1of vira1entry[J].Biochem Biophys Res Commun,2000,276(2):534-538.
[37] Nayak M K,Agrawa1A S,Bose S,et al.Antivira1activity of baica1in against inf1uenza virus H1N1-pdm09 is due tomodu1ation of NS1-mediated ce11u1ar innate immune responses[J].J Antimicrob Chemother,2014,69(5):1298-1310.
[38] Moghaddam E,Teoh B T,Sam S S,etal.Baica1in,ametabo1ite of baica1ein with antivira1activity against dengue virus[J]. Sci Reports,2014,4:5452.
[39] Evers D L,Chao C F,Wang X,etal.Human cytomega1ovirusinhibitory f1avonoids:studies on antivira1 activity and mechanism of action[J].Antiviral Res,2005,68(3):124-134.
[40] 高 雷,陈鸿珊.黄芩苷体外对流感病毒、单纯疱疹病毒和柯萨奇病毒的抑制作用[J].中国新药杂志,2008,17 (6):474-478.
[41] 徐 珊,王 乐,杨巧芳,等.黄芩抗病毒药理作用研究述评[J].中华中医药学刊,2007,25(7):1355-1357.
[42] 郭少英,程发峰,钟相根,等.黄芩苷的体外抗氧化研究[J].时珍国医国药,2011,22(1):9-11.
[43] 苏 宁,罗荣敬,苏 杭,等.黄芩苷对糖尿病肾病大鼠肾功能及其抗氧化应激作用的研究[J].中药新药与临床药理,2007,9(18):341-345.
[44] Shieh D E,Liu L T,Lin C C.Antioxidant and free radica1 scavenging effects of baica1ein,baica1in and wogonin[J].Anticancer Res,2000,20(5A):2861.
[45] 孙吉平.黄芩苷抑制大鼠胰岛细胞瘤细胞株增殖的分子机制研究[J].中国中西医结合杂志,2006,26(4):337-340.
[46] Ling Y,Chen Y,Chen P,et al.Baica1ein potent1y suppresses angiogenesis induced by vascu1ar endothe1ia1 growth factorthrough the p53/Rb signa1ing pathway 1eading to G1/S ce11 cyc1e arrest[J].Exp Biol Med,2011,236(7):851-858.
[47] Wu B,Li J,Huang D M,et al.Baica1ein mediates inhibition ofmigration and invasiveness of skin carcinoma through Ezrin in A431 ce11s[J].BMC Cancer,2011,11:527.
[48] Zhang L,Wang H D,Cong ZX,etal.Wogonoside inducesautophagy-re1ated apoptosis in human g1iob1astoma ce11s[J].Oncol Pep,2014,32(3):1179-1187.
[49] 许 琳,王 营,陈复兴,等.汉黄芩素对人NK细胞杀伤胃癌MKN45细胞的影响及其机制研究[J].免疫学杂志,2014,30(9):804-808.
[50] 黎丹戎,张汉英,张 玮,等.汉黄芩素对人卵巢癌细胞株SKOV3裸鼠移植瘤生长及端粒酶活性的抑制作用[J].中国药理学通报,2007,23(4):534-538.
[51] 刘金霞,王立平,徐晓惠.黄芩茎叶总黄酮对W256瘤细胞引起大鼠骨侵袭抑制作用[J].中国药理学通报,2005,21(1):125-126.
[52] Peng X D,Da L L,Huang CQ,etal.Corre1ation between anti-fibrotic effectof baica1in and serum cytokines in rathepatic fibrosis[J]. World J Gastroenterol,2009,15(37):4720-4725.
[53] 刘建新,汪秀荣,张文平,等.黄芩苷元对四氯化碳诱导小鼠脂质过氧化反应的影响[J].中药药理与临床,2008,24(1):25-27.
[54] 蒋厚勋.黄芩苷胶囊联合双环醇片治疗慢性乙型肝炎83例疗效观察[J].医药前沿,2013,11(31):219.
[55] 于丰彦,黄绍刚,张海燕,等.CD4+CD29+T细胞亚群与溃疡性结肠炎的相关性及黄芩苷的干预作用[J].世界华人消化杂志,2014,22(24):3710-3717.
[56] 于丰彦,黄绍刚,张海燕,等.溃疡性结肠炎外周血RORC和Foxp3 mRNA表达水平的变化及黄芩苷的干预作用[J].辽宁中医杂志,2014,41(2):225-229.
[57] Woo A Y,Cheng C H,Waye M M.Baica1ein protects rat cardiomyocytes from hypoxia/reoxygenation damage via a prooxidantmechanism[J].Cardiov Res,2005,65(1):244-253.
[58] Lee Y M,Cheng P Y,Chim L S,et al.Baica1ein,an active component of Scutellaria baicalensis Georgi,improves cardiac contracti1e function in endotoxaemic rats via induction of heme oxygenase-1 and suppression of inf1ammatory responses[J].J Ethnopharmacol,2011,135(1):179-185.
[59] 刘 萍,王菊英,李 倩,等.黄芩苷对大鼠脑缺血再灌注损伤后海马神经元HSP70表达的影响[J].药学学报,2006,41(7):619-624.
[60] 刘 萍,王菊英,李 倩,等.黄芩苷对脑缺血-再灌注损伤大鼠神经细胞凋亡及相关基因表达的影响[J].中国新药与临床杂志,2007,26(2):109-114.
[61] Liao P P,Liu L H,Wang B,et al.Baica1in and geniposide attenuate atherosc1erosis invo1ving 1ipids regu1ation and immunoregu1ation in ApoE-/-mice[J].Eur J Pharm,2014,740:488-495.
[62] Liu X M,Feng Y,Li A M.Nerve protective effect of Baica1in on newborn HIBD rats[J].Asian Pacific JTrop Med,2014,7(10):806-810.
[63] Yu H Y,Yin Z J,Yang S J,et al.Baica1in reverse AMPA receptor expression and neuron apoptosis in chronic unpredictab1e mi1d stress rats[J].Biochem Biophy Res Commun,2014,451 (4):467-472.
[64] Shin B O,Hee R P,Young JJ,et al.Baica1ein attenuates impaired hippocampa1neurogenesis and the neurocognitive deficits induced byγ-ray radiation[J].Br J Pharmacol,2013,168 (2):421-431.
[65] Mu X,He G R,Cheng Y X,et al.Baica1ein exerts neuroprotective effects in 6-hydroxydopamine-induced experimenta1 parkinsonism in vivo and in vitro[J].Pharm Biochem Behav,2009,92(4):642-648.
[66] Xue X H,Liu H,Qi L F,et al.Baica1ein ame1iorated the upregu1ation of striata1g1utamatergic transmission in themicemode1 of Parkinson' s disease[J].Brian Res Bull,2014,103 (S1):54-59.
[67] Zhang Z,CuiW,LiG,etal.Baica1ein protectsagainst6-OHDA-induced neurotoxicity through activation of Keap1/Nrf2/ HO-1 and invo1ving PKCa1pha and PI3K/AKT signa1ing pathways[J].JAgric Food Chem,2012,60(33):8171-8182.
[68] Cherng CH,Lee K C,Chien CC,et al.Baica1in ame1iorates neuropathic pain by suppressing HDAC1 expression in the spina1 cord of spina1 nerve 1igation rats[J].J Formos Med Associ,2014,113(8):513-520.
[69] 李 林,曾耀英,黄秀艳,等.黄芩苷对小鼠T淋巴细胞体外增殖和细胞周期的影响[J].细胞与分子免疫学杂志,2009,25(1):75-78.
[70] 陈 忻,赵 晖,张 楠,等.黄芩苷对小鼠免疫性肝损伤的保护作用[J].中药药理与临床,2006,22(Z1):39-40.
[71] Zhang Y,Shan L,Hua Y P,et al.Baica1ein se1ective1y induces apoptosis in activated 1ymphocytes and ame1iorates concanava1in a-induced hepatitis in mice[J].Plos One,2013,8 (7):e69592.
[72] Yun M Y,Yang JH,Kim D K,et al.Therapeutic effects of Bauca1ein on atopic dermatitis-1ike skin 1esions of NC/Ngamice induced by dermatophagoides pteronyssinus[J].Int Immunopharm,2010,10(9):1142-1148.
[73] Hee S S,Min JB,Dae W C,et al.Sku11cap(Scutellaria baicalensis)extract and its active compound,wogonin,inhibit ova1bumin-induced Th2-Mediated response[J]. Molecules,2014,19(2):2536-2545.
[74] Li H T,Wu X D,Davey Andrew K,et al.Antihyperg1ycemic effectsof baica1in on streptozotocin-nicotinamide induced diabetic rats[J].Phytotherapy Res,2011,25(2):189-194.
[75] Pei ZH,Wang B K,Zhang FQ.Response of human periodonta1 1igament ce11s to baica1in[J].J Periodontol,2014,85 (9):1283-1290.
[76] 杨 婧,傅颖媛.黄芩苷、黄芩素体外杀灭阴道毛滴虫的实验研究[J].中国中医药信息杂志,2006,13(4):37-38.
[77] 秦明春,王若光,尤昭玲,等.黄芩苷对TNF-a诱导下人脐静脉血管内皮细胞影响的初步研究[J].时珍国医国药,2014,25(8):2016-2019.
[78] Min JS,Hyeon S C,Hui JJeon,etal.Baica1ein inhibits 1ipid accumu1ation by regu1ating ear1y adipogenesisand m-TOR signa-1ing[J].Food Chem Toxicol,2014,67:57-64.
[79] Zhang JA,Yin Z,Ma LW,et al.The protective effect of baica1in against UVB irradiation induced photoaging:an in vitro and in vivo study[J].Plos One,2014,9(6):e99703.
*通信作者:傅超美(1961—),男,教授,从事中药新制剂与新剂型研究,Te1:(028)61800028,E-mai1:chaomeifu@126.com
作者简介:郑勇凤(1989—),女,硕士生,从事中药新制剂与新剂型研究。Te1:(021)51980086;E-mai1:zyf730@126.com
基金项目:上海市优秀技术带头人计划项目(14XD1424500)
收稿日期:2014-12-29
doi:10.3969/j.issn.1001-1528.2016.01.032
中图分类号:R285.5
文献标志码:A
文章编号:1001-1528(2016)01-0141-07

