丹七软胶囊UPLC指纹图谱研究及组分鉴别
董宏然, 程琪庆, 段丽颖*, 杨 健
(1.沈阳药科大学中药学院,辽宁沈阳110016;2.中国中医科学院中药研究所,北京100700;3.北京红太阳药业有限公司,北京100020)
丹七软胶囊UPLC指纹图谱研究及组分鉴别
董宏然1,2, 程琪庆3, 段丽颖3*, 杨 健2
(1.沈阳药科大学中药学院,辽宁沈阳110016;2.中国中医科学院中药研究所,北京100700;3.北京红太阳药业有限公司,北京100020)
摘要:目的 应用UPLC法建立丹七软胶囊(丹参、三七)指纹图谱,并结合UPLC/Q-TOF-MS/MS技术对其进行多成分结构鉴定。方法 丹七软胶囊80%甲醇提取液的分析采用BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);0.1%甲酸水溶液-0.1%甲酸乙腈为流动相,梯度洗脱;体积流量0.25 mL/min;检测波长208 nm;柱温30℃。质谱定性采用四级杆串联飞行时间质谱(Q-TOF-MS),正、负两种离子模式扫描。结果 以丹酚酸B为参照物峰,确定了丹七软胶囊UPLC指纹图谱,指定了32个共有峰,10批丹七软胶囊UPLC指纹图谱相似度大于0.980。结论 该指纹图谱灵敏度高,稳定性好,可以作为丹七软胶囊的质量控制标准。
关键词:丹七软胶囊;指纹图谱;超高效液相色谱(UPLC);飞行时间质谱(TOF-MS)
丹七软胶囊系在普通丹七其他剂型的基础上,对其制备方法进行了科学的试验及工艺改进而来,并获得了中华人民共和国国家知识产权局颁发的丹七软胶囊的制备方法发明专利证书(证书公开号CN17624A),其由丹参、三七两味药组成,具有活血化瘀,通脉止痛之功效,用于瘀血闭阻所致的胸痹、症见胸部刺痛、痛处固定、眩晕头痛、经期腹痛等,在治疗心内科、神经内科、骨伤科、妇科、眼科等相关疾病具有广泛的应用[1-4]。丹七软胶囊的主要成分有酚酸类和三萜皂苷类等化合物,目前有关丹七软胶囊质量控制方面的研究较少,仅有梁军等采用HPLC法检测了丹七软胶囊中丹参素的含有量[1],为了能更好地控制该产品质量,保证临床疗效,需建立全面评价该制剂质量的方法。
中成药化学成分复杂多样,作为一种多组分、化学成分复杂样品的有效质量控制方法,指纹图谱技术可以综合反映药材中各主要成分及其相对含有量,而UPLC与HPLC相比,具有高分离度、高速度、高灵敏度等特点[5]。本实验根据丹七软胶囊主要成分的特性,以丹酚酸B为参照物峰,建立了丹七软胶囊UPLC指纹图谱,然后采用Q-TOFMS技术初步指认了32个共有峰,并测定了10批样品,为全面提升丹七软胶囊的质量标准提供了依据。
1 仪器及材料
1.1 仪器 ACQUITY UPLCTM系统,包括四元高压梯度泵、真空脱气机、自动进样器、柱温箱、二极管阵列检测器、Empower 3色谱工作站(美国Waters公司);micro TOF-Q四极杆-飞行时间质谱仪,包括Apo11o II离子漏斗式ESI电喷雾离子源(德国Bruker公司);SB-800DTD型超声波清洗器(宁波新芝生物科技股份有限公司);BSA224S分析天平(德国Sartorius公司);5810R离心机(德国Eppendorf公司);15 mL离心管(美国NEST公司);0.22 μm PTFE滤膜(天津津腾实验设备有限公司)。
1.2 试剂与样品 甲酸、甲醇、乙腈均为色谱纯(美国Fisher公司);屈臣氏蒸馏水。丹七软胶囊由北京长城制药厂提供,共10批(批号分别为13110105、13110215、14080101、14080102、14090101、14090102、14100101、14100102、14110101、14110102)。丹酚酸B标准品(中国食品药品检定研究院,批号111562-201313)。
2 方法与结果
2.1 供试品溶液的制备 精密称取丹七软胶囊内容物0.5 g,置于15 mL离心管中,加入80%甲醇10.0 mL,密封,超声30 min。然后,4 000 r/min离心10 min,取上清液,残渣用80%甲醇洗涤3次,将洗液与上清液合并,过滤,浓缩,定容至10 mL量瓶中,摇匀,0.22 μm微孔滤膜滤过,即得。
2.2 对照品溶液的制备 精密称取丹酚酸B对照品5.0 mg,置于25 mL量瓶中,80%甲醇溶解并定容,配制成质量浓度为0.20 mg/mL的丹酚酸B对照品溶液。
2.3 色谱条件 Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B),梯度洗脱(0~3 min,5% B;3~13 min,18%~23% B;13~15 min,23%~40% B;15~18 min,40%~70%B;18~23 min,70%~100%B);体积流量0.25 mL/min;检测波长208 nm;柱温30℃;进样量2 μL。
2.4 质谱条件 电喷雾离子源(ESI);正、负两种离子模式采集数据;质量扫描范围m/z 50~1 500;干燥气体为氮气,体积流量6 L/min;干燥气温度220℃;毛细管电压在正模式下为4.0 kV,负模式下为5.5 kV;碰撞气体为氩气;碰撞能量10 eV。数据采用DataAna1ysis Compass软件处理,三氟乙酸钠外标法校正。
2.5 测定方法 选取稳定性好、响应强、特征明显、分离度高的丹酚酸B色谱峰作为参照峰,再分别取对照品及供试品溶液进样,以丹酚酸B的色谱峰为参照峰,其余共有峰的保留时间和峰面积与其比值分别作为相对保留时间和相对峰面积。
2.6 精密度试验 精密吸取同一供试品溶液(批号14100101),连续重复进样6次,在“2.3”项下色谱条件进行检测,采用中药色谱指纹图谱相似度评价系统(2004A版)对6次测定结果进行计算,考察各共有峰的相对保留时间及相对峰面积的一致性。结果显示,所有色谱峰相对保留时间的RSD在0.01%~0.39%之间,相对峰面积的RSD 在0.25%~1.62%之间,表明整个检测系统的精密度良好,符合指纹图谱的要求。
2.7 稳定性试验 取同一供试品溶液(批号14100101),分别于0、2、4、8、12、24 h在“2.3”项色谱条件下进行检测,采用中药色谱指纹图谱相似度评价系统(2004A版)对6次测定结果进行计算,考察6次测定的色谱中各共有峰的相对保留时间及相对峰面积的一致性。结果显示,所有色谱峰相对保留时间的RSD在0.06%~0.65%之间,相对峰面积的RSD在0.42%~1.69%之间,表明供试品溶液在24 h内基本稳定。
2.8 重复性试验 取丹七软胶囊(批号14100101)共6份,按“2.1”项下方法制备供试品溶液,在“2.3”项色谱条件下进行检测,采用中药色谱指纹图谱相似度评价系统(2004A版)对6次测定结果进行计算,考察色谱中各共有峰的相对保留时间及相对峰面积的一致性。结果显示,所有色谱峰相对保留时间的RSD在0.13%~0.86%之间,相对峰面积的RSD在0.43%~2.36%之间,表明本方法的重复性良好。
2.9 指纹图谱的建立 取10批丹七软胶囊,按“2.1”项下方法制备供试品溶液,在“2.3”项色谱条件下进行检测,记录色谱图,采用中药色谱指纹图谱相似度评价系统(2004A版)对10批供试品的色谱图进行比较分析,选择吸收信号较强、稳定性高、重复性好、峰形明显的32个色谱峰作为共有峰,其中21号峰来源于丹酚酸B(图1)。然后,对选定的共有峰进行多点校正,自动匹配,得到丹七软胶囊对照指纹图谱,再将各批样品的UPLC图谱与对照指纹图谱进行比较,并计算其相似度。结果表明,丹七软胶囊样品整体相似度大于0.990,不同批号之间的成分基本一致(表1),说明10批丹七软胶囊质量稳定。
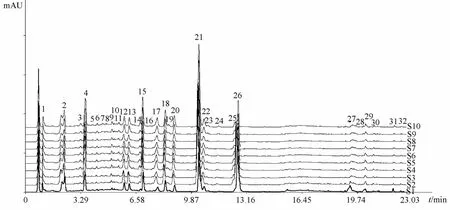
S1.13110105 S2.13110215 S3.14080101 S4.14080102 S5.14010101 S6.14090102 S7.14100101 S8.14100102 S9.14110101 S10.14110102图1 10批丹七软胶囊样品的UPLC色谱图Fig.1 UPLC chromatogram s of ten batches of Danqi Soft Capsules sam p les
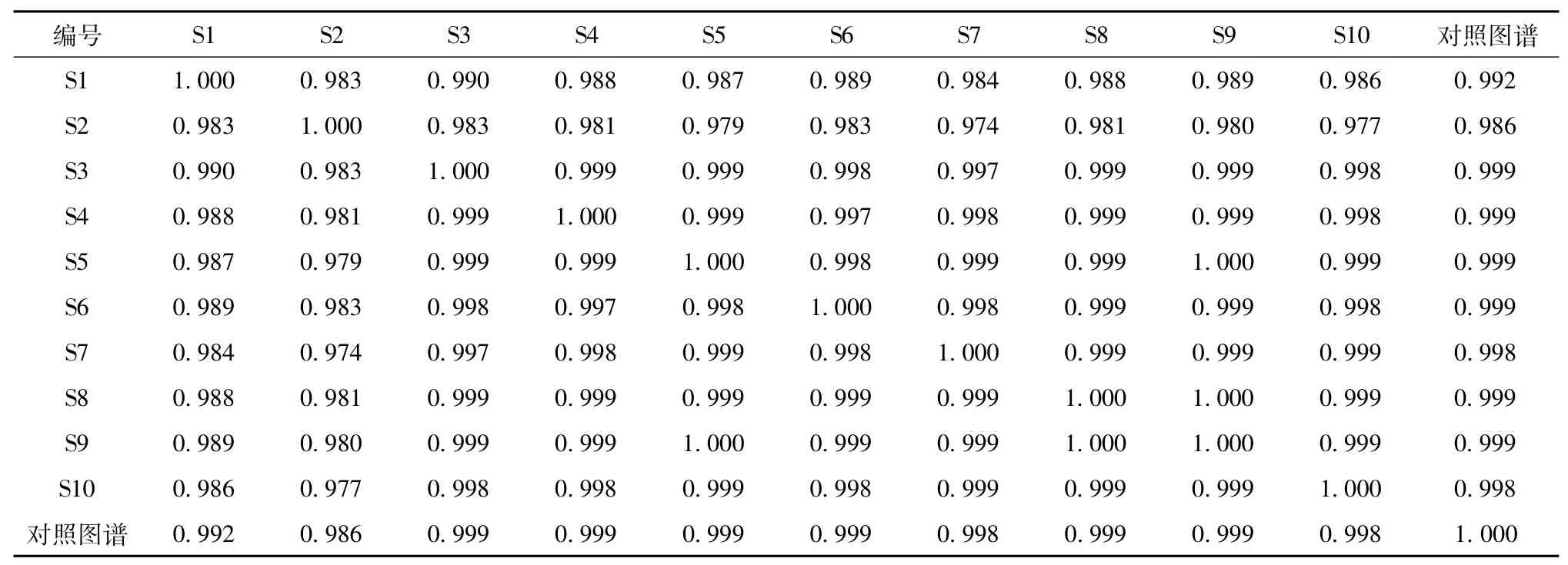
表1 10批丹七软胶囊样品的相似度Tab.1 Sim ilarities of ten batches of Danqi Soft Capsules sam ples
2.10 丹七软胶囊化学成分分析 利用UPLC/QTOF-MS/MS对丹七软胶囊供试品溶液(批号14080105)进行正、负离子扫描。结果,供试品中各化学组分在不同扫描模式下响应强度不一,因此对正、负离子两种模式分别进行采集,使获得的化合物信息互补。然后根据相关文献,建立丹七软胶囊组方药材的化学成分信息库,利用TOF-MS获得的准分子离子峰精确相对分子质量信息(误差<5 ppm)及MS/MS获得的二级碎片信息,并结合保留时间、紫外吸收数据,与库中化学成分进行比对,鉴定丹七软胶囊化学成分,同时对鉴定成分进行药材归属。结果,解析出丹七软胶囊色谱图中32个化学成分,见表2。Q-TOF/MS总离子流图见图2。
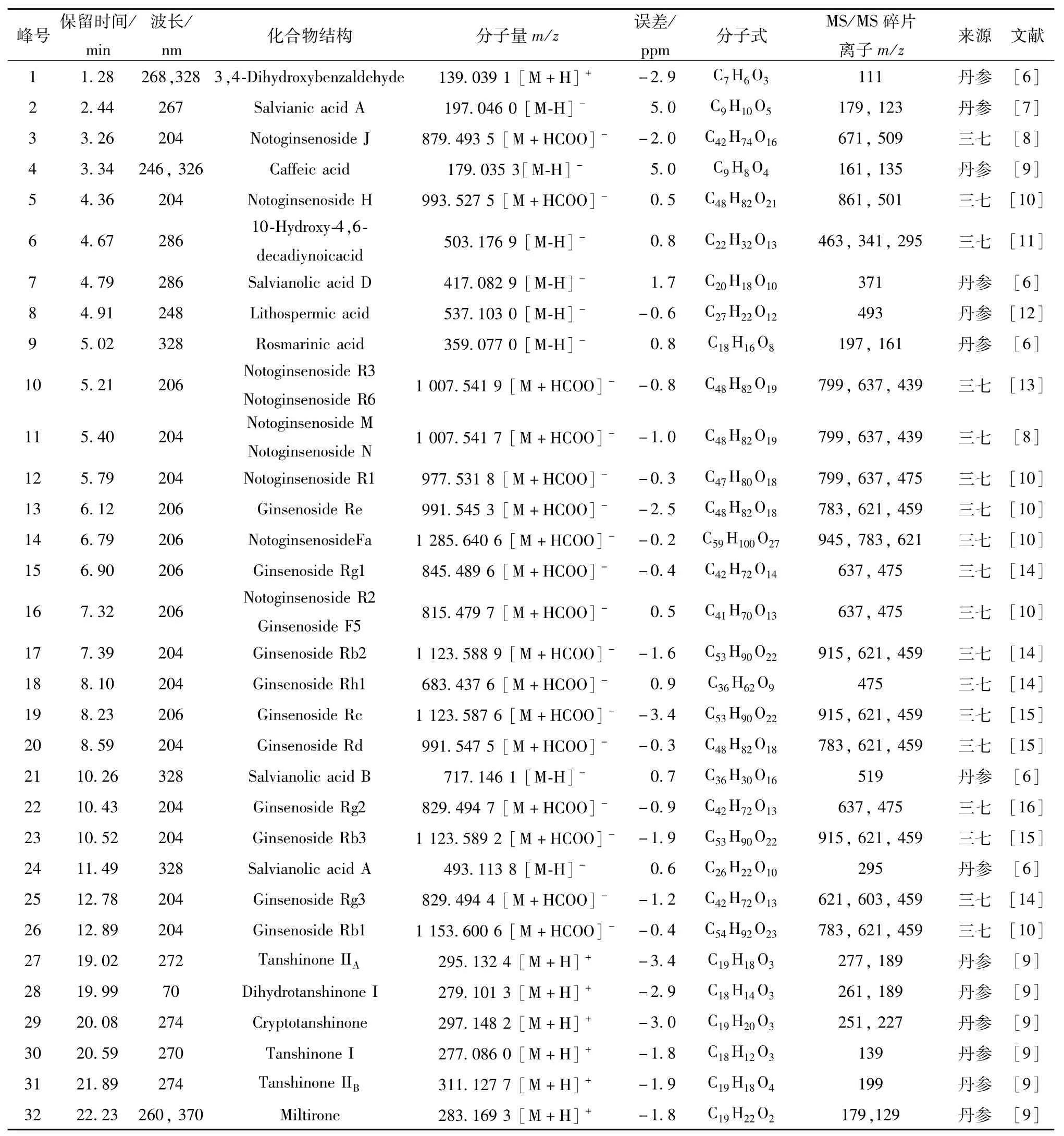
表2 丹七软胶囊化学成分Tab.2 Chem ical constituents of Danqi Soft Capsules
3 讨论
中药指纹图谱作为一种多指标的质控模式,可较全面反映复方中药所含化学成分的种类和数量,为中药质量评价提供了新思路和新方法,已日益成为国内外广泛接受的评价模式[17]。丹七软胶囊具有科学的制备工艺、创新的剂型、确切的疗效和安全性,但查阅相关文献发现,其指纹图谱研究却仍未有报道。本实验采用乙腈-甲酸溶液对丹七软胶囊供试品溶液进行梯度洗脱,共检出32个共有峰,并通过UPLC/Q-TOF-MS/MS对其进行了结构解析,初步阐明了该复方制剂的化学组成,为多指标成分的同时定量测定分析提供了理论依据,同时也为进一步开展该药的药效物质及药代动力学等研究奠定了基础。另外,所采用的UPLC法灵敏度高,同样的梯度洗脱系统,其用时仅为普通液相色谱的三分之一,而且该方法操作简便,专属性强,重复性好,可以作为丹七软胶囊的质量控制手段。
在供试品制备方法考察中,本实验分别采用50%、80%和100%甲醇作为提取溶剂,考察出峰数目的多少,结果发现80%甲醇提取液出峰最多,信息量最大,故以其为提取溶剂。再分别采用超声和加热回流提取法进行试验,发现在相同的提取时间下,超声提取可将有效成分充分提取,而且超声提取法简便、快速,故采用超声法制备供试品。然后,比较超声提取20、30、40 min,结果表明当超声时间超过30 min时,主要色谱峰的数目和峰面积已没有显著变化,因此选择80%甲醇,超声提取30 min来制备供试品溶液。
对流动相进行优化时,针对丹七软胶囊中大量的酚酸和三萜皂苷类成分,选择0.1%甲酸-水溶液和0.1%甲酸-乙腈溶液进行洗脱,发现指纹图谱分离效果明显优于纯水和纯乙腈。再利用DAD检测器对供试样品进行紫外扫描检测,对208、210、 226、238、254、286、326 nm这7个波长下检测的色谱图进行比较,发现供试品在208 nm检测波长下检出色谱峰的信息较全,峰面积最大,而且基线较为稳定,故选择208 nm作为检测波长。
中药化学成分复杂多样、数目庞大,传统经典的植物化学鉴定方法依靠提取分离来获得化合物单体,再通过紫外光谱、红外光谱、核磁共振等技术手段进行结构鉴定,过程漫长,耗时耗力,而飞行时间质谱(TOF/MS)作为复杂样品成分鉴定的有效方法,近年来已越来越广泛的应用于复方中药的成分分析与鉴定[18-19]。高分辨的分子离子峰是TOF/MS定性最重要的线索,结合同位素模式,可以推断化合物的分子式,再结合MS/MS碎片信息、保留指数、紫外吸收、文献检索等方法对化合物进行定性鉴定。但是对于结构相似的同分异构体,如本文中Ginsenoside Rd与Ginsenoside Re等,不但其分子组成完全一样,而且有着极其类似的质谱裂解行为,仅依靠质谱数据很难将它们进行区分,故一般需要对照品的比对来进一步确认其结构。本实验中的同分异构体未进行对照品比对,其鉴定是根据其在文献中的保留时间顺序来确定。

图2 丹七软胶囊Q-TOF/MS总离子流图Fig.2 Q-TOF/MS total ion current chromatograms of Danqi Soft Capsules
参考文献:
[1] 梁 军,王英锋.HPLC测定丹七软胶囊中丹参素的含量[J].中国中药杂志,2007,32(13):1359-1360.
[2] 吴符火,刘雪酶,贾 铷.丹七胶囊的药效学研究[J].中国中药杂志,2006,30(23):1869-1873.
[3] 付志红,吴飞华.丹七软胶囊在治疗原发性痛经中的作用探讨[J].中国医药指南,2013,11(13):310-312.
[4] 晏跃辉.丹七软胶囊治疗突发性耳聋的临床观察[J].中国实用医药,2014,9(31):182-183.
[5] 周 新,陈会明,白 桦,等.HPLC与UPLC色谱条件转换方法研究[J].分析试验室,2008,27(4):56-58.
[6] Chen X,Lou Z,Zhang H,et al.Identification ofmu1tip1e components in Guanxinning injection using hydrophi1ic interaction 1iquid chromatography/time-of-f1ight mass spectrometry and reversed-phase 1iquid chromatography/time-of-f1ightmass spectrometry[J].Rapid Commun Mass Sp,2011,25(11):1661-1674.
[7] Yuan D,Pan Y,Fu W,etal.Quantitative ana1ysis of themarker compounds in Salvia miltiorrihiza root and its phytomedicina1 preparations[J].Chem Pharm Bull,2005,53(5):508-514.
[8] Zhou M,Xu M,Wang D,etal.New dammarane-type saponins from the rhizomes of Panax japonicas[J].Helv Chim Acta,2011,94(11):2010-2019.
[9] Park JY,Kim JH,Kim Y M,et al.Tanshinones as se1ective and s1ow-binding inhibitors for SARS-CoV cysteine proteases [J].Bioorgan Med Chem,2012,20(19):5928-5935.
[10] Dan M,Su M M,Gao X F,etal.Metabo1ite profi1ing of Panaxnotoginseng using UPLC-ESI-MS[J].Phytochemistry,2008,69(11):2237-2244.
[11] Xie G,P1umb R,Su M,et al.U1tra-performance LC/TOFMS ana1ysis ofmedicina1Panax herbs formetabo1omic research[J]. JSep Sci,2008,31(6-7):1015-1026.
[12] Wang D H,Yu J Q.High1y convergent tota1 synthesis of (+)-1ithospermic acid via a1ate-stage intermo1ecu1ar C-H o1efination[J].JAm Chem Soc,2011,133(15):5767-5769.
[13] MaW G,MizutaniM,Ma1terud K E,et al.Saponins from the rootsof Panax notoginseng[J].Phytochemistry,1999,52(6):1133-1139.
[14] Dong L,Cheng B,Luo Y,et al.Identification of nuc1ear factor-κB inhibitors and β2 adrenergic receptor agonists in chinese medicina1preparation fuzi1izhong pi11susing UPLCwith Quadrupo1e Time-of-f1ight MS[J].Phytochem Analysis,2014,25 (2):113-121.
[15] Kim N,Kim K,Lee D H,et al.Nontargeted metabo1omics approach for age differentiation and structure interpretation of agedependent key constituents in hairy roots of Panax ginseng[J]. JNat Prod,2012,75(10):1777-1784.
[16] Zhou D,Zhu Y R,Guan Y,et al.Chemica1 fingerprint and metabo1ic fingerprint of Danhong Injection by HPLC-UV and HPLC-MS[J].Asian JChem,2013,25(11):6285-6292.
[17] 秦昆明,方前波,蔡宝昌,等.指纹图谱技术在方剂现代研究中的应用现状[J].世界科学技术:中医药现代化,2009,11(2):287-293.
[18] 王少敏,胡 青,季 申.GC/MS法和UPLC/Q-TOF-MS法研究丹香冠心注射液中的有效成分[J].中成药,2012,34 (1):78-84.
[19] 夏 菁,谢媛媛,张宗璇,等.骨通贴膏指纹图谱及化学成分研究[J].中成药,2014,36(3):571-576.
UPLC fingerprint and identification of constituents of Danqi Soft Capsules
DONG Hong-ran1,2, CHENG Qi-qing3, DUAN Li-ying3*, YANG Jian2
(1.School of Traditional ChineseMateria Medica,Shenyang Pharmaceutical University,Shenyang 11OO16,China;2.Instituteof ChineseMateria Medica,China Academy of Chinese Medical Sciences,Beijing 1OO7OO,China;3.Beijing Red Sun Pharmaceutical Co.,Ltd.,Beijing 1OOO2O,China)
ABSTRACT:AIM To estab1ish a fingerprintmethod for ana1yzing Danqi Soft Capsu1es(Salvia miltiorrhiza and Panax notoginseng)by UPLC and a combinative UPLC/Q-TOF-MS/MS method for the identification of theirmu1ticonstituents.METHODS The ana1ysis of Danqi Soft Capsu1es 80% methano1ic extract was performed on BEH C18co1umn(2.1 mm×50 mm,1.7 μm),mobi1e phase was0.1% formic acid-0.1% formic acid in acetonitri1e with gradient e1ution,f1ow rate was 0.25 mL/min,detection wave1ength was set at208 nm,and co1umn temperature wasmaintained at30℃.Then quadrupo1e-time of f1ight-mass spectrometry(Q-TOF-MS)was used for qua1itative ana1ysis under positive and negative ion modes.RESULTS The UPLC fingerprint of Danqi Soft Capsu1eswas estab1ished with sa1viano1ic acid B peak as reference peak.Thirty-two common peakswere obtained from the standard fingerprint chromatograms of ten batches with the simi1arity of no 1ower than 0.980.CONCLUSION This UPLC fingerprinthas high precision and good stabi1ity,which can be used for the qua1ity contro1of Danqi Soft Capsu1es.
KEY WORDS:Danqi Soft Capsu1es;fingerprint;UPLC;TOF-MS
*通信作者:段丽颖,女,研究方向为中药质量控制。Te1:15313557860,E-mai1:duan1y43@126.com
作者简介:董宏然(1989—),男,硕士生,研究方向为中药质量控制。Te1:13716779785,E-mai1:dhyopp@126.com
收稿日期:2015-02-05
doi:10.3969/j.issn.1001-1528.2016.01.026
中图分类号:R284.1
文献标志码:A
文章编号:1001-1528(2016)01-0117-06

