方程式书写试题分析及答题技巧
黑龙江 刘成宝
方程式书写试题分析及答题技巧
黑龙江 刘成宝
化学方程式是重要的化学用语,是物质性质的直观体现,也是物质间反应定量计算的重要依据。快速准确地完成方程式的书写能够体现学生较好的学科素养,因此书写方程式的问题也就成为高考的热点也是必考的试题。尤其是在近几年的高考中,有关方程式的书写问题以科技生活、化工生产等素材为背景信息,试题具有情景新颖,信息容量大,涉及知识面广的特点,导致学生难以把握试题的本质,不能形成完整清晰有序的解题思路,因而不能准确的书写方程式。
一、典例选析
【例1】(2013新课标Ⅰ,27)锂离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
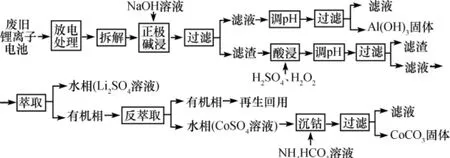
回答下列问题:
(2)写出“正极碱浸”中发生反应的离子方程式:______ _________________。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:________________________。
(4)写出“沉钴”过程中发生反应的化学方程式:______ _________________。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式:_______________________。
解析:正极材料为LiCoO2和铝箔,加入NaOH溶液后,根据物质的性质可知发生的离子反应为2Al+2OH-+2H2O2AlO+3H2↑,由工艺流程可知过滤后的滤渣中含有LiCoO2;酸浸时是将Co由+3价还原为+2价的氧化还原反应,加入的H2O2作还原剂,主要反应物与生成物为LiCoO2+H2O2→CoSO4+O2↑,由电子转移守恒关系可知计量数为2LiCoO2+H2O2→2CoSO4+O2↑,再由原子守恒关系可知反应方程式为2LiCoO2+H2O2+3H2SO42CoSO4+O2↑+Li2SO4+4H2O;“沉钴”过程是CoSO4溶液中加入NH4HCO3后生成CoCO3沉淀,反应的实质是Co2+与HCO电离生成CO结合生成CoCO3,从而促进HCO的电离,导致H+浓度增大,H+与HCO反应生成CO2,反应方程式为CoSO4+2NH4HCO3CoCO3↓+(NH4)2SO4+H2O+CO2↑;由充电时的负极反应可知,放电时的负极反应为LixC6-xe-6C+xLi+,放电时的电池反应式为Li1-xCoO2+LixC6LiCoO2+6C。
【例2】(2014新课标Ⅱ,27)回答下列问题:
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________________________________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为______________,阴极上观察到的现象是_________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为__________________,这样做的主要缺点是_________________。
解析:由MnO2与浓盐酸加热时生成Cl2进行类比推理可知,PbO2与浓盐酸共热生成PbCl2和Cl2;由Pb的价态变化、电子转移守恒、原子守恒关系可知PbO与次氯酸钠溶液反应生成PbO2和Cl-;根据电解时Pb的价态变化确定阳极电极反应式为Pb2++2H2O-2e-PbO2+4H+,阴极电极反应式为Cu2++2e―Cu,若不加入Cu(NO3)2,则阴极的反应式为Pb2++2e―Pb,将导致Pb2+利用率低。
【例3】(2015新课标Ⅱ,28)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
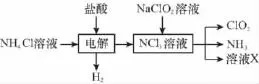
①电解时发生反应的化学方程式为________________。
②溶液X中大量存在的阴离子有__________________。
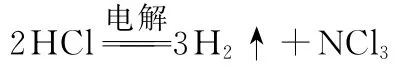
【例4】(2015新课标Ⅰ,27)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
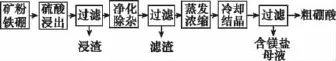
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式:_________________。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:_______________________________________________ ____________________________________________________。
解析:根据转化关系图中最终生成的粗硼酸和含镁盐母液可知反应方程式为Mg2B2O5·H2O+2H2SO42MgSO4+2H3BO3;由B与Al为同族元素推测H3BO3与Al(OH)3的性质相似,H3BO3受热后分解生成B2O3,而硼酸和镁为原料可制备单质硼是利用Mg的强还原性,参照铝热反应推测制备时所发生的反应方程式为
二、试题特点分析
通过上述例题分析发现,对有关方程式书写问题的试题特点概括如下:
1.考查方式
有关方程式书写问题的试题主要是从化学方程式、离子方程式、电极反应式的书写进行考查,化学方程式或离子方程式的书写又分为氧化反应类型方程式和非氧化还原类型方程式。
2.考查内容
(1)基础知识体系中较为熟悉的化学反应。如例1中Al与NaOH的反应、H2O2的分解反应。又如2015新课标Ⅱ第26题酸性锌锰干电池的离子方程式和正极电反应式的书写是源于教材中的内容。
(2)通过类比推理完成方程式的书写。如例1中CoSO4与NH4HCO3的反应、例2中PbO2与浓盐酸共热时的反应、例4中硼酸和金属镁为原料制备单质硼的反应。
(3)依据试题所给信息完成的化学反应。该类型方程式书写的重点是根据试题给出的反应物与生成物,完成方程式的配平。如2014新课标Ⅰ第27题中白磷(P4)与Ba(OH)2溶液、例3中NH4Cl与HCl电解时的反应。
(4)依据试题信息进行推理完成的化学反应。该类型方程式的书写关键是要根据所给信息进行推理后准确确定生成物,然后进行配平。如例1中LiCoO2与H2O2的反应、例3中NaClO2与NCl3的反应、例4中Mg2B2O5·H2O与H2SO4的反应。
三、解答方法总结
针对有关方程式书写问题的特点和考查形式与内容,在解答此类问题时,应强化基础知识的构建与完善,强化对物质性质的掌握与应用,促进知识与技能的有效类比和迁移;强化对氧化还原反应规律的认识与应用;强化原子守恒、电荷守恒、电子转移守恒关系的灵活运用。具体解答策略立足于以下四个方面:
1.依据试题所给信息准确确定主要反应物与生成物。
2.依据试题要求,对所需完成的化学方程式、离子方程式或电极反应式,运用原子守恒、电荷守恒或电子转移守恒确定主要反应物、生成物的计量数。
3.由原子守恒、电荷守恒关系并结合反应前后溶液酸、碱性的变化情况确定其他反应物与生成物并确定其计量数。
(作者单位:黑龙江省宾县第一中学)

