抗坏血酸与牛血清白蛋白相互作用的光谱和电化学研究
王婉君,马 伟,孙登明(淮北师范大学化学与材料科学学院,安徽淮北235000)
抗坏血酸与牛血清白蛋白相互作用的光谱和电化学研究
王婉君,马伟,孙登明
(淮北师范大学化学与材料科学学院,安徽淮北235000)
摘要:用自制修饰电极通过循环伏安法和荧光法,分别研究牛血清白蛋白与抗坏血酸的相互作用.用循环伏安法和荧光法测得抗坏血酸与牛血清白蛋白的结合常数K分别为1.761×104L/mol和1.884×104L/mol,结合位点数均接近1.0.实验测得抗坏血酸对牛血清白蛋白是静态猝灭.抗坏血酸浓度与牛血清白蛋白荧光强度的降低在2.50×10-7~3.50×10-4mol/L范围内呈线性关系,检出限为1.0×10-7mol/L.牛血清白蛋白浓度与抗坏血酸氧化峰电流的下降在2.50×10-8~5.00×10-5mol/L范围内呈线性关系,检出限为1.0×10-9mol/L.此法用于样品中抗坏血酸和牛血清白蛋白的测定,结果满意.
关键词:抗坏血酸;牛血清白蛋白;相互作用;荧光光谱;电化学
血清白蛋白在生命过程中承载着重要作用,它能结合和运输外源性与内源性物质,维持血液正常的渗透压[1-2],研究血清白蛋白与药物小分子的相互作用是药物分子设计和改造的前提基础,对于理解药物代谢动力学,研究药物药效发挥的作用机理等具有重要意义.当前药物小分子和牛血清白蛋白相互作用的研究已见报道[3-5],但电化学方法和荧光法同时研究小分子与蛋白质的作用机制和测定方法报道较少.抗坏血酸(AA),又称维生素C[6-7],是高等灵长类动物等的必需营养素.抗坏血酸是人体内的高效抗氧化剂,参与生命体内许多重要生物过程的合成,可以提高人体的免疫力和机体的应急能力,维生素缺乏会导致坏血病.本文用自制的化学修饰电极研究AA与BSA的相互作用,测定结合常数、结合位点数,并与荧光法进行比较,结果基本一致.
1 实验部分
1.1仪器与试剂
BAS100/W电化学分析系统(产自美国BAS公司);FP-6500荧光光谱仪(产自日本岛津公司);PHS-3C型酸度计(产自上海康仪仪器有限公司);三电极系统:工作电极为自制聚L-谷氨酸修饰电极(PLG/ GCE)[8],参比电极为Ag/AgCl,对电极为铂丝.
牛血清白蛋白(BSA)购自国药集团化学试剂有限公司,其储备液2.00×10-4mol/L,于4℃暗处冷存;抗坏血酸(AA)储备液1.00×10-2mol/L,阴凉干燥处避光冷存;L-谷氨酸溶液5.0×10-3mol/L;磷酸盐缓冲溶液(PBS);
实验试剂均为分析纯,试验用水为二次亚沸蒸馏水.实验温度:298 K.
1.2实验方法
1.2.1电化学法
在容量瓶(10 mL)中加入一定量的AA和BSA溶液,用PBS定容,混匀,倒入电解池,插入三电极系统,静置5 s,扫描电位设为-0.1~0.6 V,V为120 mV/s的条件下进行实验,记录AA溶液、AA和BSA混合溶液的LSV曲线上的峰电流(Ip)和峰电位(Ep).
1.2.2荧光光谱法
在比色管(10 mL)中加入一定量的AA和BSA溶液,用PBS定容,混匀,静置30 min,在298 K下测定并记录其荧光光谱图.
2 结果与讨论
2.1BSA与AA相互作用的LSV图和荧光猝灭光谱图
AA和AA-BSA体系的线性扫描伏安曲线(图1),AA在聚L-谷氨酸修饰电极上出现一个明显的氧化峰,而加入BSA后峰电流降低,峰电位略微左移,表明AA和BSA之间发生一定的相互作用.

图1 抗坏血酸与牛血清白蛋白相互作用的线性扫描伏安图
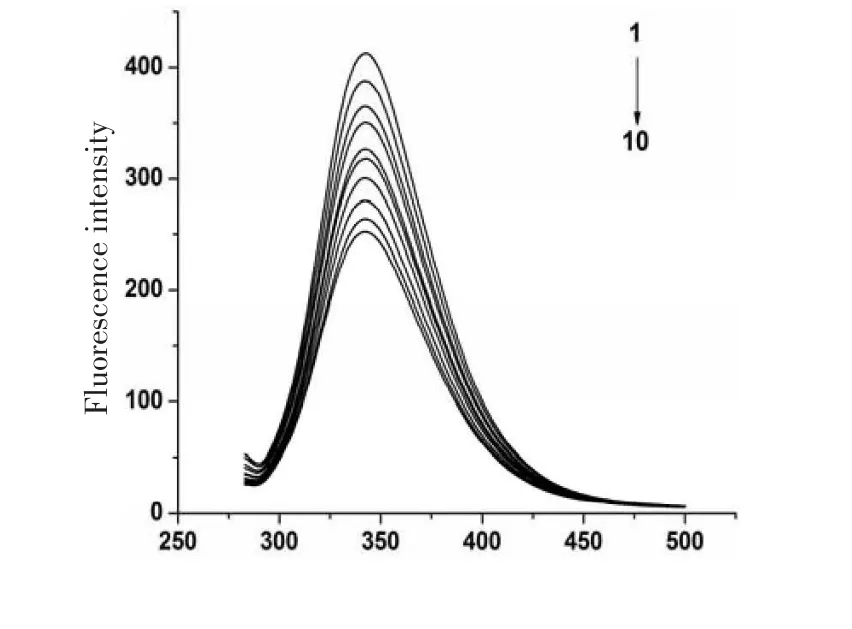
图2 抗坏血酸与牛血清白蛋白相互作用的荧光猝灭图
图2为BSA和AA混合后的荧光猝灭光谱图,从图2中可以看出,在BSA的浓度固定不变时,其荧光强度随着AA浓度的增加而有规律地降低且在342 nm外AA呈现最大发射波长,说明AA与BSA之间发生相互作用,猝灭BSA的内源荧光.
2.2AA与BSA相互作用的光电化学机理
2.2.1电化学机理
采用CV法,其他测定条件保持不变,改变底液的pH进行实验.结果为图3,表明在pH为2.0~10.0范围内,Epa随着pH的增大逐渐负移,且Epa与pH呈较好的线性关系,AA:Epa(V)=0.318 7-0.037 30 pH,R= 0.993 3,斜率为37.30 mV/pH,说明有质子参与AA在修饰电极上的氧化还原反应;AA-BSA:Epa(V)= 0.315 5-0.040 56 pH,R=0.996 2,斜率为40.56 mV/pH,比AA的斜率增大.

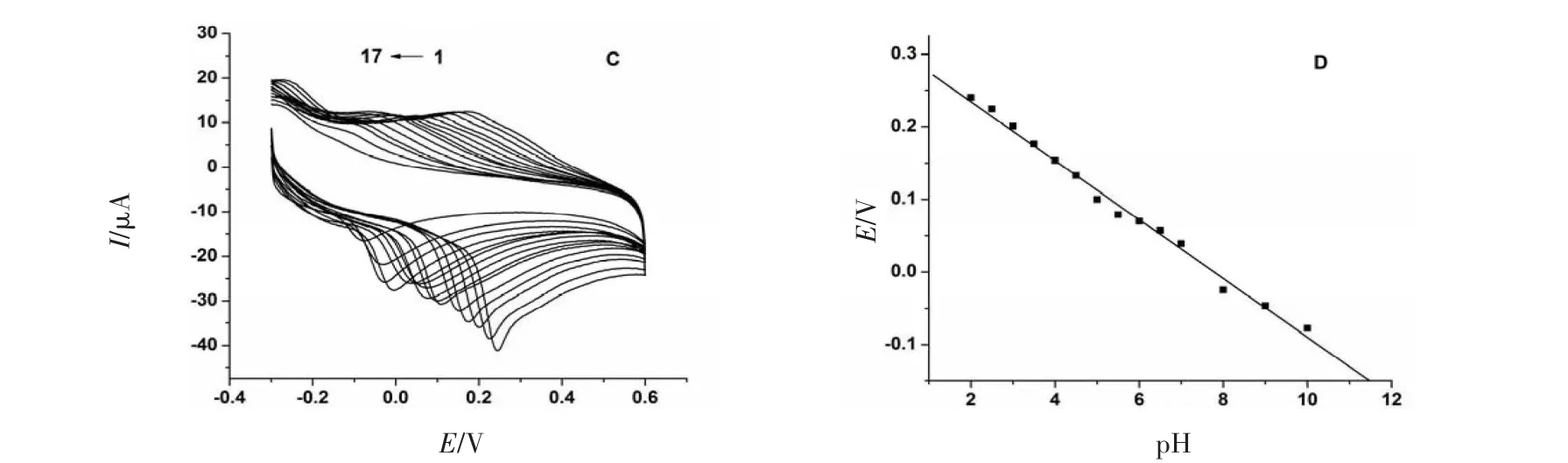
图3 AA在PLG/GCE上随pH变化的CV曲线叠加图(A)和Ep与pH的关系曲线(B);AA-BSA在PLG/GCE随pH变化的CV曲线叠加图(C)和Ep与pH的关系曲线(D)
固定其他最佳条件不变,改变扫速进行实验,结果表明,在20~600 mV/s范围内,AA随着v的增加而变大,Epa向正方向移动,且Ipa~lgv成线性关系,其线性回归方程为:lgIpa=2.170+0.604 6 lgv,R=0.995 2,表明AA在PLG/GCE电极表面发生以扩散控制为主的反应[9].在AA与BSA混合后,峰电流降低,但其lgIp′~lgv′也呈线性关系,其线性回归方程为:lgIpa′=2.133+0.595 5 lgv,R=0.995 3,但斜率稍微有所减小,但减小幅度不大,表明AA的电极反应表面过程随着BSA浓度的增加仍然以扩散控制为主.
假设AA与BSA之间只形成一种简单的化合物BSA-m AA,根据下式[10]可求得结合常数(β)和结合位点数(m):

如图4所示为lg[rI/(rImax-rI)]~lg[Q]的关系图,其线性回归方程为:

求得m=1.078,β=1.761×104L/mol.

图4 抗坏血酸对牛血清白蛋白荧光淬灭lg[rI/(rImax-rI)]和lg[Q]的线性关系

图6 AA与BSA lg[(F0-F)/F]~lg[Q]的线性关系
CBSA=2.00×10-5mol/L,CAA=5.00×10-5,1.00×10-4,1.50×10-4,2.00×10-4,2.50×10-4,3.00×10-4,3.50×10-4,4.00×10-4,4.50×10-4mol/L;pH=6.0;T=298 K
2.2.2荧光猝灭机理
根据荧光猝灭过程遵循Stern-Volmer方程:

由图5可以得出其线性回归方程为:F0/F=1+1.426×104[Q];R=0.994 4.
方程斜率为Stern-Volmer方程曲线的猝灭常数Ksv,即Ksv=1.426×104L/mol.由Ksv=Kqτo可求出猝灭过程速率常数,得到各类淬灭剂对生物大分子的最大扩散常数远远小于Kq值,因此可以判断抗坏血酸对牛血清白蛋白的作用以静态猝灭为主.
根据静态猝灭过程理论公式计算二者的结合常数K和结合位点数n[12-13]:

以lg[(F0-F)/F]对lg[Q]作图,结果见图6,其线性方程为:lg[(F0-F)/F]=4.275+1.035 lg[Q];R=0.996 8;则K=1.884×104L/mol,n=1.035,与电化学方法基本一致.
2.2.3热力学函数的变化及作用力类型的确定
通常情况下,小分子与蛋白质等生物大分子发生相互作用主要借助于氢键、范德华力、静电引力和疏水作用力[14-15].热力学函数值的计算结果如表1所示.根据实验结果298 K、308 K时ΔH<0,且ΔS<0.因此可以推测在该温度范围内,该体系中AA和BSA之间的作用力主要是氢键和范德华力.
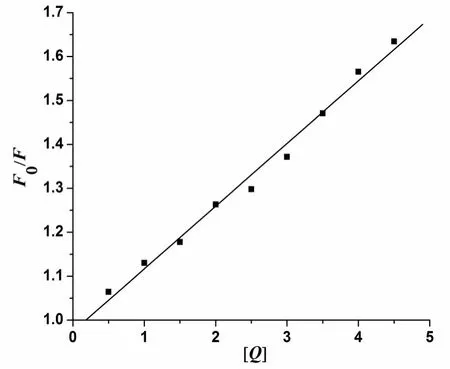
图5 抗坏血酸对牛血清白蛋白作用的Stern-Volmer曲线

表1 AA与BSA在各温度下相互作用的热力学参数
从以上实验数据结果可以得出:AA与BSA相互作用之间形成简单化合物.
2.3测定AA和BSA的最佳条件
实验结果表明,电化学快速循环伏安法测定AA-BSA的最佳条件为:PBS的酸度为pH 2.0,用量为2.0 mL.电位范围为-0.3~0.6 V,扫速为0.12 V/s.
荧光法测定AA-BSA的最佳条件为:PBS的酸度为pH 6.0,用量为2.0 mL;激发波长为278 nm;发射波长为342 nm.
固定最佳条件不变,分别用荧光法(固定BSA浓度不变)、CV法(固定AA浓度不变)对AA-BSA进行了测定,结果见表2.

表2 工作曲线(n=8)
2.4干扰离子
荧光法测定AA-BSA(AA浓度为5.00×10-4mol/L,BSA浓度为2.00×10-5mol/L),允许误差在±5%以内,共存物质允许量(mg):K+(3.0)、Na+(3.0)、Ba2+(1.0)、Pb2+(1.0)、Fe3+(0.5)、Cr2+(0.5)、Mg2+(0.3)、Mn2+(0.3)、Ca2+(0.2)、Zn2+(0.2)、Al3+(0.2)、Cu2+(0.1)、葡萄糖(0.1).采用循环伏安法测定AA-BSA(AA浓度为5.00×10-4mol/L,BSA浓度为2.00×10-5mol/L),共存物质允许量(mg):K+(3.0)、Na+(3.0)、Ca2+(2.0)、Mn2+(2.0)、Ba2+(1.0)、Co2+(0.5)、Mg2+(1.0)、Al3+(0.5)、葡萄糖(3.0);Ag+(0.5)、Pb2+(0.5)、Fe3+(0.3);半胱氨酸、Cu2+(0.1).
2.5样品分析
用一定量抗坏血酸注射型针剂溶解于100 mL容量瓶配置一定浓度的溶液,取5 mL的样品进行样品分析;对牛血清白蛋白配制了不同浓度溶液的合成样品并取2 mL进行分析,结果如表3.

表3 样品分析结果(n=5)
3 结论
采用电化学、荧光两种方法对AA与BSA的相互作用研究其结合常数、结合位点数和线性范围等参数,有助于人们从分子水平上理解药物小分子与血清白蛋白发挥药效的作用机制,为设计和改造分子提高药效提供参考依据.通过研究方法对比,突出了电化学法具有较高的灵敏度、良好的选择性和稳定性.
参考文献:
[1]蒋英之,贺连华,刘建军.蛋白质功能研究方法及技术[J].生物技术通报,2009(9):38-43.
[2]马静,葛熙,昌增益.蛋白质功能研究:历史、现状和将来[J].生命科学,2007,19(3):294-300.
[3]XIE M X,LONG M,LIU Y,et al.Characterization of the interaction between human serum albumin and morin[J].Bio⁃chim Biophys Acta,2006,1760(8):1184-1191.
[4]易平贵,商志才,俞庆森.荧光光谱法研究喹诺酮抗菌素与过氧化氢酶的相互作用[J].分析化学,2001(6):646-648.
[5]薛春霞,董社英.四种黄酮类化合物与牛血清白蛋白相互作用的光谱学研究[J].化学研究,2014,25(2):152-157.
[6]李春燕,张成魁,唐守渊,等.抗坏血酸测定的线性扫描溶出伏安法研究[J].分析实验室,2007,26:135.
[7]张振新,孙登明,荣振海.催化动力学光度法测定衡量抗坏血酸[J].光谱学与光谱分析,2004,24(7):873-875.
[8]孙登明,由文颖.聚L-谷氨酸修饰电极的制备及对多巴胺的测定[J].分析科学学报,2005,21(5):530-532.
[9]Laviron E.General expression of the linear potential sweep voltammogram in case of diffusionless electrochemical system [J].J Electroanal Chem,1979,101(1):19-28.
[10]裴明砚,郑学仿,曹洪玉,等.3-溴丙酮酸与人血清白蛋白相互作用的光谱学研究[J].分析化学,2010,38(7):948–952.
[11]杨曼曼,杨频,席小莉.荧光猝灭与荧光加强理论公式的等效论证[J].科学通报,2005,50(20):2199-2202.
[12]BI Shuyun,SONG Daqian,TIAN Yuan,et al.Molecular spectroscopic study on the interaction of tetracyclines with serum albumins[J].Spectrochim ActaA:Mol Biomol Spectrosc,2005,61(4):629-636.
[13]LAKOWICA J R.Principle of fluorescence spectroscopy[M].NewYork:Plenum Press,1983:341-381.
[14]FÖMRSTER T.Modern quantum chemistry[M].New York:Academic Press,1965.
[15]SEN P,FATIMA S,AHMAD B,et al.Interactions of thiooflavin T with serum albumins:spectroscopic analysis[J]. Spectrochim Acta Part A,2009,74(1):94-99.
Studies on the Interaction of Ascorbic Acid and Bovine Serum Albumin by Spectroscopic and Voltammetric Methods
WANG Wanjun,MA Wei,SUN Dengming
(School of Chemistry and Materials Science,Huaibei Normal University,235000,Huaibei,Anhui,China)
Abstract:The interaction between ascorbic acid(AA)and bovine serum albumin(BSA)was investigated us⁃ing the self-made modified electrode by cyclic voltammetry and fluorescence.The binding constants of 1.761×104L/mol and 1.884×104L/mol can be calculated from the data obtained from fluorescence quenching experiments and cyclic voltammetry,respectively.And the number of the binding sites is nearly 1.0.The in⁃teraction of bovine serum albumin with AA was a single static quenching procedure.Within the limits,the fluorescence intensity changes BSA linearly with the concentrations of AA,the linear range is 2.50×10-7~3.50×10-4mol/L,and the detection limit is 1.0×10-7mol/L.Within the limits,the redox peak current of AA was proportional to the the concentration of BSA,the linear range is 2.50×10-8~5.00×10-5mol/L,and the de⁃tection limit is 1.0×10-9mol/L.It has been applied to the determination BSA and AA in the samples with sat⁃isfactory results.
Key words:ascorbic acid;bovine serum albumin;interaction;fluorescence spectroscopy;electrochemical
作者简介:王婉君(1991-),女,安徽涡阳人,硕士生,研究方向:分析化学.通讯作者:马伟(1977-),男,安徽颍上人,副教授,研究方向:分析化学.
基金项目:安徽省高校省级自然科学研究重点基金资助项目(KJ2011A255)
收稿日期:2015-09-01
中图分类号:O 657.3
文献标识码:A
文章编号:2095-0691(2016)01-0036-05

