清开灵雾化吸入对大鼠口、鼻、气管及肺的刺激作用研究
杨 欣,董博宇
(北京中医药大学中药学院,北京 100102)
清开灵雾化吸入对大鼠口、鼻、气管及肺的刺激作用研究
杨 欣,董博宇
(北京中医药大学中药学院,北京 100102)
目的 研究清开灵雾化吸入对SD大鼠的口、鼻、气管及肺泡的刺激性。方法 将12只大鼠随机分为对照组(予生理盐水),清开灵低浓度组(1∶10)和清开灵高浓度组(1∶1),进行为期7 d的雾化吸入试验,每次给药后观察大鼠的行为活动变化。第8天取口腔黏膜、鼻中隔黏膜、气管、左肺,制备石蜡切片,观察形态学结构变化,并进行右肺泡灌洗,测定灌洗液蛋白分泌量和乳酸脱氢酶(LDH)活力。结果 切片显示高、低浓度给药组大鼠的口、鼻、气管及肺泡的切片均有明显损伤,且高浓度组损伤显著高于低浓度组;各组肺泡灌洗液中BCA蛋白测定值无显著差异;LDH活力测定结果则显示给药组与对照组有显著差异,且与浓度呈正相关。结论 清开灵雾化吸入对大鼠口、鼻、气管及肺泡有刺激性,且高浓度雾化时会造成较大的呼吸道黏膜组织损伤。
清开灵;雾化吸入;病理切片;肺泡灌洗;刺激性
雾化吸入作为临床常见的给药方式,是指药物以特殊装置给药,经呼吸道腔道、黏膜等发挥全身或局部作用的一种给药方式,具有药物能直接到达作用部位、可避免肝脏首过效应等优势[1]。目前,已有包括用于肺部和呼吸道局部治疗至少50多个西药配方雾化剂批准生产,尚没有获得批准的中药雾化吸入制剂。
清开灵方中金银花、栀子、板蓝根、黄芩和人工牛黄含抗菌、抗病毒作用的有效成分,并有较强的退热及免疫调节作用[2],因此临床常用于清热解毒、镇静安神,治疗外感风热时毒、火毒内盛所致的高热不退、烦躁不安、咽喉肿痛、急性咽炎、急性气管炎。许多基层医生认为,清开灵雾化吸入可使药液以微粒的形式直接作用于口腔及呼吸道黏膜,作用范围集中、浓度大、效果快[3],因此清开灵雾化给药成为许多基层医生常用的给药方式。然而清开灵的雾化吸入给药方式尚未得到有关部门批准,也不是通过审批的新药,缺乏安全性研究数据。笔者根据本实验室前期对黏膜刺激性的研究[4-5],以大鼠为模型评价清开灵雾化给药的刺激性,现报道如下。
1 动物、材料与方法
1.1 动物
SPF级SD大鼠,雄性,体重250~300 g,北京维通利华实验动物技术有限公司提供,许可证编号为SDXK<京>2012-0001。
1.2 试药
清开灵注射液(神威药业集团有限公司,国药准字Z13020880,批号为 130520C1,规格为每支 10 mL);0.9%氯化钠注射液(生理盐水,北京化工厂,批号为20130606);10%中性福尔马林固定液(北京博奥拓科技有限公司);HE染料(北京斯百汇生物科技有限责任公司);石蜡(上海鼎杰生物科技有限公司);其余试剂均为分析纯。
1.3 仪器
雾化装置(自制);LEICA 300型脱水机,LEICA EG1150H型包埋机,LEICA HI1210型展片机,LEICA RM2255型切片机,LEICA HI1220型烤片机;CX21型显微镜(日本OLYMPUS);易创显微图像处理软件-MIE V2.0(山东易创电子有限公司);403M型压缩空气式雾化器(上海鱼跃医疗设备有限公司);CT15RT型台式高速冷冻离心机(上海天美生化仪器设备有限公司);Multiskan Go型酶标仪(美国Thermo Fisher公司)、96孔板(美国Corning Incorporated公司)BCA蛋白定量试剂盒(中国Biomiga公司);乳酸脱氢酶(LDH)活力定量测定试剂盒E1020(普利莱基因技术有限公司);手术剪、眼科镊等。
1.4 方法
分组及给药:将12只大鼠随机分为3组,每组4只,分别为低浓度清开灵组、高浓度清开灵组和对照组,给药组采用清开灵注射液与生理盐水比为1∶1(高浓度,与临床报道浓度一致)和1∶10(低浓度)的清开灵雾化剂,对照组给予生理盐水,雾化吸入,每次20 min,每天2次,连续给药7 d。每次给药后观察并记录大鼠呼吸频率、幅度及活动状态。
动物解剖:给药第8天对3组大鼠进行解剖,观察鼻腔、气管等部位有无出血和水肿,两侧肺表面有无出血、感染、肺实变或肺气肿现象;观察并记录肺、心、肝、脾、肾、大肠及小肠等部位的体积大小、色泽、位置、硬度、积水、淤血等情况。
空间自相关分析基于相关指标来测度要素在空间分布上是否呈现聚集性从全域空间自相关、局部空间自相关两个方面进行分析。
切片及肺泡灌洗:将左侧一片肺叶结扎并取下,再取气管、鼻中隔、口腔黏膜,分别放入福尔马林溶液中浸泡,制作HE染色切片。将注射器针头插入气管,细线结扎,向右肺缓慢注入生理盐水2.5 mL,停留0.5 min后缓慢抽出,反复2次,收集灌洗液。计算回收率,将灌洗液加入离心管中,1 500 r/min,离心15 min,直接测定。灌洗液进行BCA法测定总蛋白浓度、LDH活力测定。
2 结果
2.1 观察结果
试验阶段前期3组大鼠的顺应性较差,有抵抗情绪,给药后精神兴奋;试验阶段后期各组大鼠抵抗减弱,顺应性良好。对照组少数大鼠有眼睛和鼻腔出血现象,低浓度清开灵组和高浓度清开灵组的部分大鼠有眼睛和鼻腔出血现象,高浓度清开灵组相对严重。
2.2 切片结果
分别做3组大鼠的4个部位组织切片。
图1显示,对照组鼻中隔黏膜上皮细胞排列整齐,柱状纤毛完好;给药组上皮细胞增生,柱状上皮转化成鳞状上皮,纤毛损伤、脱落,且伴有轻微出血现象,病变明显。
图2显示,对照组肺部肺泡壁薄而完整,无出血现象,肺泡大小适中、均匀;低浓度清开灵组肺泡壁明显增厚,某些部位肺泡结构不明显,间质炎症明显并有轻度肺炎;肺泡内有血细胞,有肺出血现象;高浓度清开灵照组肺泡壁聚集,且肺泡结构更加不明显,支气管中有分泌物存在,损伤程度大于低浓度清开灵组。
图4显示,对照组气管结构清晰,黑色部分为软骨,白色部分为脂肪,上皮细胞排列整齐,有柱状纤毛;低浓度清开灵组纤毛结构有损伤;高浓度清开灵组还观察到有出血、坏死情况,上皮组织脱落,损伤严重,证明有气管炎症。

图1 鼻中隔黏膜病理切片

图2 肺部病理切片
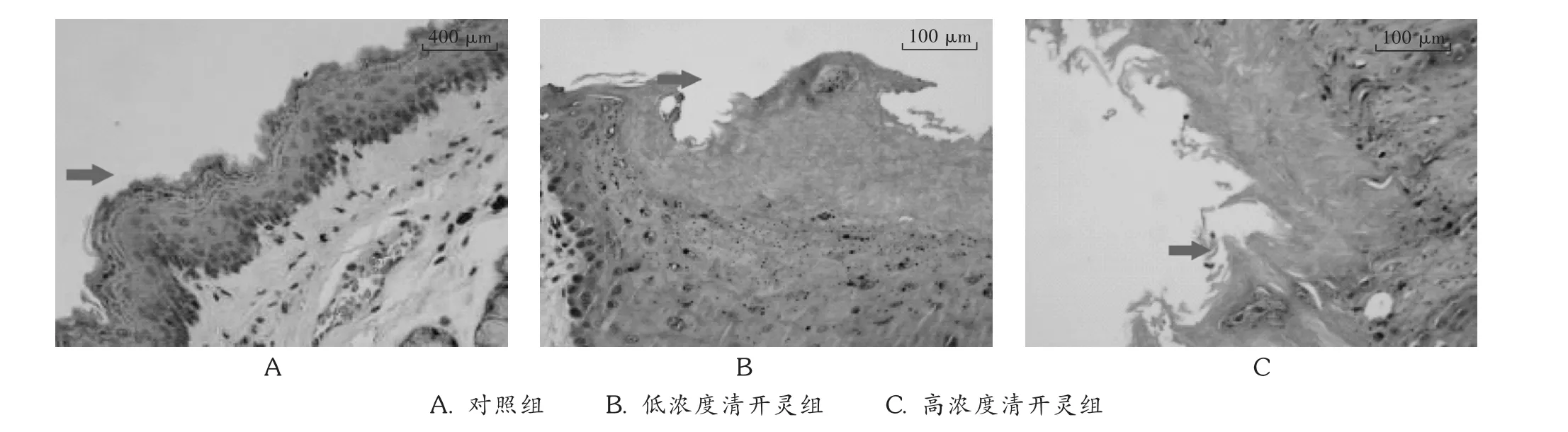
图3 口腔黏膜病理切片
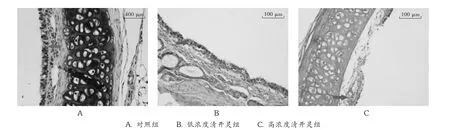
图4 气管病理切片
2.3 肺泡灌洗结果
2.3.1 灌洗液回收率
各组平均回收率可达到80%以上,基本满足测定需要。见表1。
表1 肺泡灌洗液回收率结果(s,%,n=4)

表1 肺泡灌洗液回收率结果(s,%,n=4)
组别对照组低浓度清开灵组高浓度清开灵组第1次83±2.6 81±0 82±0.7第2次79±2.6 81±0 81±0.7平均回收率81.0±2.6 81±0 81.5±0.7
2.3.2 BCA试剂盒和LDH试剂盒测试结果
以吸光度为纵坐标(Y),灌洗液蛋白(μg/mL)为横坐标(X),进行线性回归分析,标准曲线的回归方程为Y=0.001 1 X-0.007 8(X范围在0~381 μg/mL),r=0.998 8。结果表明,灌洗液蛋白浓度在0~381 μg/mL线性关系良好。见图5。

图5 灌洗液蛋白标准曲线
以吸光度为纵坐标(Y),LDH活力单位为横坐标(X),进行线性回归分析,标准曲线的回归方程为 Y=0.000 2 X-0.005(X范围在0~240 1),r=0.998 8。结果表明LDH活力单位在0~240 1线性关系良好。见图6。

图6 灌洗液LDH活力单位曲线
2.3.3 灌洗液测定结果
BCA蛋白测定结果通过统计分析,给药组与对照组无显著性差异,表示蛋白浓度相差不大。LDH活力测定结果通过统计分析,给药组与对照组均有显著差异(P<0.05),且高浓度显著高于低浓度组。见表2。
表2 灌洗液测定结果(s,n=4)

表2 灌洗液测定结果(s,n=4)
注:与对照组比较, P<0.05;与低浓度清开灵组比较,P<0.05。
组别对照组低浓度清开灵组高浓度清开灵组蛋白浓度( g/mL)183.42±17.86 163.15±23.21 223.70±63.16 LDH活力单位24.08±31.53 159.50±78.61 1 479.99±63.16
3 讨论
清开灵注射液临床运用广泛,然而清开灵雾化吸入给药属于超说明书用药,需要重点监控。本试验结果显示,雾化吸入给药过程中观察到大鼠的眼睛、鼻腔出现不同程度出血,通过切片分析直观表现出大鼠口腔、鼻腔、肺部及气管有出血和损伤,高浓度清开灵组受损程度高于低浓度清开灵组。BCA蛋白测定无显著性差异,BCA是通过蛋白质将CU2+还原成CU+再与BCA试剂反应,根据吸光度值来显示蛋白质的含量,结果显示肺泡灌洗液中蛋白质含量无明显变化。LDH蛋白测定有显著差异(P<0.05),表示大鼠的肺中存在炎症,有多种组织损伤,患有肺炎,高浓度清开灵浓度组LDH含量高于低浓度清开灵浓度组,说明清开灵雾化剂对大鼠的口、鼻、气管及肺有一定刺激性,会造成口、鼻、气管及肺组织损伤,且随着清开灵雾化剂浓度的增加,对大鼠相关组织的刺激程度变强。
本研究结果表明,尽管已有大量的研究表明清开灵雾化剂可起到较好的化痰、消炎功效,并起到抗菌、抑制口腔致病菌、清热解毒、镇静安神等作用,但其对鼻腔、口腔、肺及气管刺激性大,带来的损伤不容忽视,在临床用药中应引起高度重视。
[1]张文乾.清开灵雾化吸入治疗慢性阻塞性肺病急性加重期36例[J].吉林医学,2010,31(9):1 215.
[2]赵柏庆,林秀云,张远荣,等.清开灵注射液雾化吸入联合抗生素治疗吸入性肺炎疗效观察[J].新中医,2014,46(10): 52-54.
[3]张 红.清开灵雾化吸入防治鼻咽癌放疗后急性口腔黏膜反应的临床观察[J].中国中医药科技,2008,15(6):468-470.
[4]程艳珂,郭懿望,尚可心,等.以溶解度与刺激性为指标筛选葛根素滴鼻液溶剂及增溶剂[J].中国中药杂志,2014(22): 4 335-4 339.
[5]Wen R,Li HY,Du SY,et al.Preparation of mPEG 2000-PLA-modiĝed Xingnaojing microemulsion and evaluation in mucosal irritation[J].JournalofBiomaterialsScience,2014,25(9): 923-942.
Stimulation of Qingkailing Inhalation on Rats′M outh,Nose,Trachea and Lung
Yang Xin,Dong Boyu
(School of Chinese Medicine,Beijing University of Chinese Medicine,Beijing,China 100102)
Objective To study the stimulation effect of Qingkailing Inhalation on SD rats′mouth,nose,trachea and lung.M ethods 12 Wistar rats were randomly divided into 3 groups,namely the control group(saline),Qingkailing low concentration group(1∶10)and Qingkailing high concentration group(1∶1),for a 7 d atomization inhalation experiment and the behavior of rats after each administration was observed.On the 8th day,the oral mucosa,nasal septum mucosa,trachea,left lung,paraffin sections were prepared to observe the structural changes of the morphology.The right alveolar lavage was performed at the 8th day,and the lavage fluid protein and LDH activity were measured.Results There was an obvious damage in the mouth,nose,trachea and lung in the high and low concentration groups,and the damage in the high concentration group was significantly higher than that in low concentration group.There was no significant difference between the BCA protein in the bronchoalveolar lavage fluid in the 3 groups.LDH activity assay showed significant differences between the two Qingkailing groups and the control group,and showed a positive correlation.Conclusion Qingkailing atomization inhalation has stimulation effect on rats′mouth,nose,trachea and lung,and high concentration of atomization can cause huge tissue damage of the respiratory mucosa.
Qingkailing;inhalation;pathological section;alveolar lavage;stimulation
R285.5;R286
A
1006-4931(2016)09-0018-04
杨欣,女,大学本科,主要从事中药研究,(电子信箱)810210331@qq.com。
2015-10-14)

