滴灌条件下不同灌水处理对秋播紫花苜蓿根瘤数的影响
王亚东,苏德荣,焦 健,李兴福,罗 琰
(北京林业大学草地资源与生态研究中心,北京 100083)
0 引 言
土壤微生物作为长足久远发展计划已经在国际上得到认可[1],生物固氮能在减少化肥用量的同时不降低农作物的产量[2,3],小小的紫花苜蓿根瘤菌年均固氮量为100~300 kg/hm2[4],而人工接种根瘤菌使得紫花苜蓿能从空气中获取更多氮素[5]。影响紫花苜蓿根瘤形成有诸多因素:水分[6]、温度[7]、光照[7]、土壤pH值[8]、化合态氮[8]、微量元素[9]、磷钾营养[10]及刈割[11]。土壤水分对根瘤菌与豆科植物构建的共生固氮体系具有很大的影响,土壤水分或多或少都对紫花苜蓿根瘤的形成有影响。水分过量致使土壤氧气偏少形成厌氧环境、土壤降温、养分流失或有效性改变,使得作物根部呼吸困难,结瘤效果也会随之变差[12]。而土壤水分较少的情况下,植物根系的延伸受阻,就会减少紫花苜蓿根瘤的侵染机会,根瘤繁殖也会受到阻碍,并且根瘤大小、形态以及生理特性都或多或少受到影响[6]。水分干旱直接影响豆科作物的根瘤形态与生理作用,间接影响寄主作物的蒸腾作用以及光合作用[13,14]。在干旱条件下,光合产物的减少导致更少的糖类用于调节根瘤[15];或者由于水分的缺乏,碳水化合物运输被阻止[16]。
本文对滴灌条件下对秋播苜蓿的不同灌水处理的试验,研究紫花苜蓿在不同灌水处理对其根瘤数量的影响,探讨秋播苜蓿根瘤数随水分变化规律,为苜蓿栽培生长提供试验依据。
1 材料与方法
1.1 试验地概况
试验于2015年在北京克劳沃草业技术开发中心试验基地(116°28′N,39°34′E)进行,海拔50 m左右,年均温10~12 ℃,全年无霜期190~200 d,≥10 ℃年积温4 200 ℃;多年平均降水量在600 mm,75%集中在7-9月。试验地整体地势平坦开阔,光照以及通风条件良好。前茬作物为紫花苜蓿。试验地为中壤土,土壤速效氮为48.48 mg/kg,土壤速效磷为14.36 mg/kg,土壤速效钾为70.33 mg/kg,有机质含量为5.29%,土壤pH值为7.89,土壤容重为1.62,田间持水量重量百分比为27.02%,萎蔫含水量重量百分比为9.01%。
1.2 试验设计
以皇冠(Medicago sativa L. cv. Phabulous)紫花苜蓿进行实验,试验小区面积为1.5 m×3 m,每个小区11行,行距15 cm。试验为6种灌水处理方式,处理方式见表1,每个处理3个重复,共18个小区。相邻两小区间隔1 m作为保护行。播种时期为秋播,试供品种均在2015年8月10日播种,播前对紫花苜蓿种子进行拌菌,种子与根瘤菌(Dormal根瘤菌)的重量为1 000 g:100 g[17]。播种量为15 kg/hm2,播前进行机械耕耙,细平整后使用专业锄具开沟约2 cm深,拌沙后人工条播,播前施基肥。播后当天灌水,灌水方式为喷灌。待出苗整齐后采用地面滴灌的灌水方式。滴灌材料由北京双羽技术开发中心提供,滴灌系统主管道直径25 mm,支管道直径20 mm,毛管为行列式,直径16 mm,滴头流量1.6 L/h,滴头间距30 cm。每个小区单独设置一个开关阀门,每个小区铺设6条滴灌管。
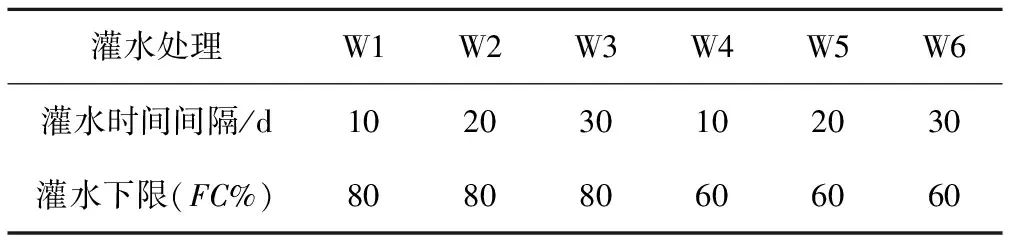
表1 试验设计Tab.1 Experimental design
注:这里的灌水下限指灌水前1~2 d土壤含水量进行测定后,根据当前土壤含水量计算30 cm土层所需最少灌水量。
测得试验期间各个处理30 cm土壤含水量见图1,试验期间水量补给见表2。

图1 试验期间各处理30 cm土壤含水量Fig.1 Treatment of 30 cm soil moisture content during the test
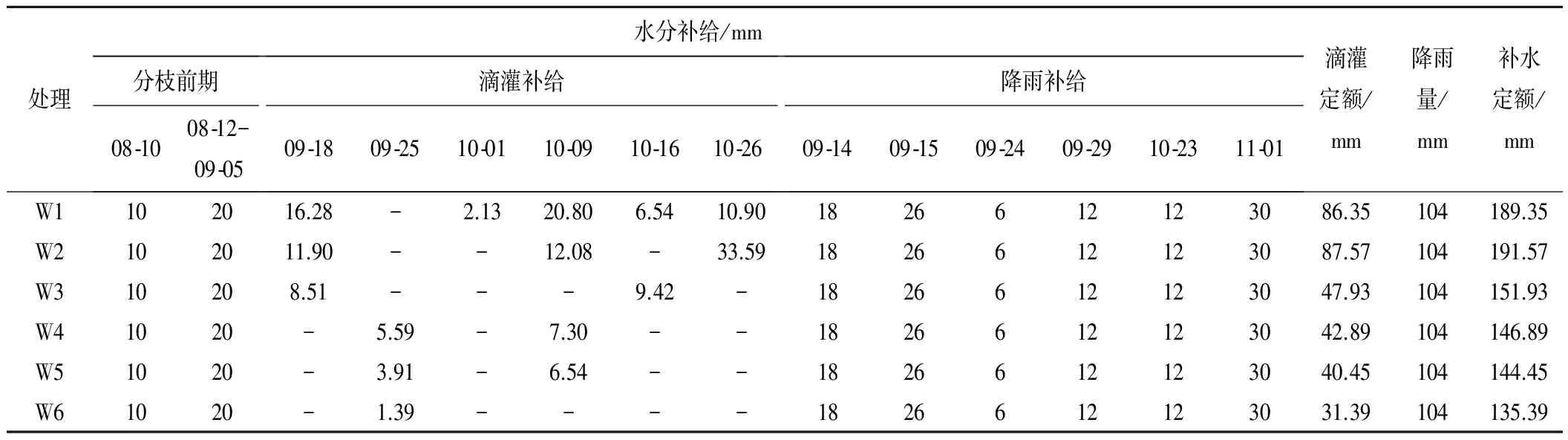
表2 试验期间大田补给水量Tab.2 Water supply in field during the experiment
注:分枝期滴灌开始时间为9月18日;8月10日为播种后的第一次灌水;8月12日-9月5日为分枝前期滴灌灌水量;提前1~2 d测量土壤含水量,再进行水分补给。
采用烘干法测量土壤的含水量,根据土壤的含水量确定每次的灌水量。根据监测到的土壤现状含水量,应用田间持水量以及植物当前的根系层深度(i设定值为30 cm),就可以计算最大灌水量,即一次的灌水定额。如果土壤现状含水量为θ,则一次最大向上土壤中补充的水量,即灌水量就是:
(1)
式中:Ii为第i次最大的灌水深度,cm;FC为土壤的田间持水量,用质量百分比表示,%;θi为当前土壤含水量,用质量百分比表示,%;γ为30 cm层的土壤干容重,g/cm3;γw为水的容重,g/cm3;Hi为第i次灌水时的植物根系层深度,30 cm。
1.3 测定指标与方法
在播种后50 d后进行根样的收取工作,用深30 cm取根器将根取出后,随机选取10株根,冲洗干净,数其根瘤总数、有效根瘤数[18]、主根根瘤数与侧根根瘤数。将清洗干净的根系部分在距离根茎处5 cm用电子数显(精度为0.02 mm)游标卡尺测其根粗与将游标卡尺旋转90°测得的根粗取平均值,为其根粗。称取重量后,于烘箱105 ℃杀青1 h,70 ℃烘干至恒重,冷却后取出称为干根重。根干鲜比=干根重/根系生物量。
1.4 数据分析
用Microsoft Excel 2013对数据进行整理,IBM SPSS Statistics 20.0统计分析软件对数据进行单因素方差(ANOVA)分析,并用LSD法进行差异显著性多重比较。
2 结果与分析
2.1 不同灌水量对秋播紫花苜蓿根的影响
在秋播条件下,不同灌水处理条件对紫花苜蓿根粗、根系生物量与干根重均无影响(P<0.05),见图2(a),(b),(c),而对苜蓿根干鲜比有极显著影响(P<0.01),见图2(d)。①随着干旱的加重,秋播紫花苜蓿根粗在W4、W6灌水条件下最大,说明灌水下限较灌水时间间隔更能影响紫花苜蓿的根粗,但是各个处理之间未呈现一定的规律性。②整体来看随着干旱的加重,紫花苜蓿根系生物量与干根重呈增长的趋势,在灌水条件W6比灌水条件W1分别增加了55.56%、31.21%。③秋播紫花苜蓿根干鲜比随着干旱时间间隔(10、20、30 d)的增加呈减少的趋势,说明干旱时间间隔较灌水下限更能影响紫花苜蓿的根干鲜比,灌水处理W6(灌水时间间隔30 d+灌水量下限为60%FC)时,根干鲜比最大为27.75%。

注:不同小写字母表示表示差异显著(P<0.05);不同小写字母表示差异极显著(P<0.01)。图2 不同灌水量对秋播紫花苜蓿根的影响Fig.2 The influence of different irrigation treatment of alfalfa root
2.2 不同灌水量对秋播紫花苜蓿根瘤菌的影响
不同灌水处理对紫花苜蓿的根瘤总数与有效根瘤数有显著性影响(P<0.05),对主根根瘤数并无显著性影响(P<0.05),而侧根根瘤数则在P<0.01水平上有极显著差异。灌水处理为W6(灌水时间间隔30 d+灌水量下限为60%FC)时秋播苜蓿的总根瘤数与侧根根瘤数最多,侧根根瘤数在灌水W6比灌水W4增加94.29%,灌水处理为W5(灌水时间间隔20 d+灌水量下限为60%FC)时秋播苜蓿的有效根瘤数最多,比W4增加91.67%。整体来看并不是灌水越多根瘤数越多,根瘤总数、有效根瘤数与侧根根瘤数均在灌水条件W4时最少,见表3。
随着滴灌定额的减少,根瘤总数、有效根瘤数与侧根根瘤数均在灌水条件W5与W6表现出数量优势,而且适当的进行灌水时间间隔秋播苜蓿根瘤数呈增长的趋势(W1除外)。由此可见,对秋播苜蓿进行适当调亏滴灌有利于其根瘤菌的形成。
3 结 语
环境保护与生态农业的发展使得微生物肥料发挥了举足轻重的作用[19]。土壤微生物作为长足久远发展计划已经在国际上得到了认可[1]。在不增加土地面积和矿质化肥的前提下达到预期的高产是农业科研工作者面临的一个巨大挑战之一。
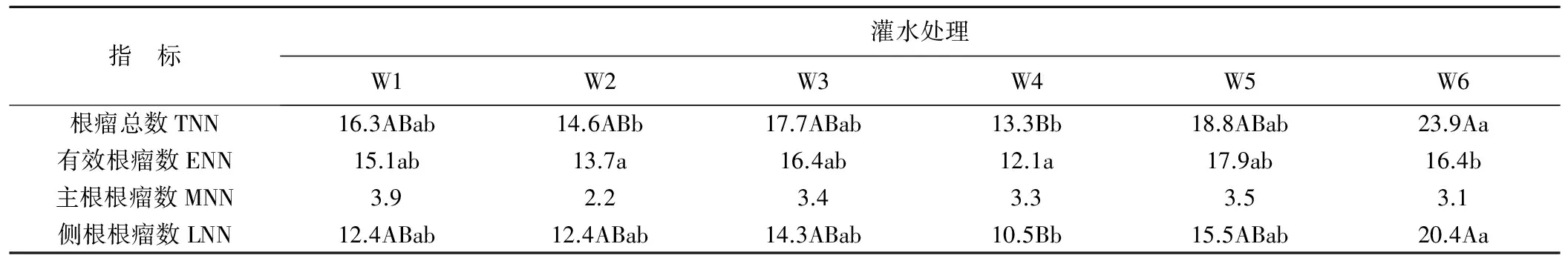
表3 不同灌水处理下紫花苜蓿的根瘤数Tab.3 The influence of different irrigation treatment of alfalfa nodule number
注:①同行中不同大写字母表示各指标在不同灌水处理条件下差异显著(P<0.01),同行中不同小写字母表示各指标在不同灌水处理条件下差异显著(P<0.05)。②TNN指根瘤总数;ENN指有效根瘤数;MLL指主根根瘤数;LNN指侧根根瘤数。
实现这个目标比较有效的办法就是让豆科植物参与到作物轮作当中,只有生物固氮能在减少化肥用量的同时不降低农作物的产量[2,3]。人工接种根瘤菌使得紫花苜蓿能从空气中固定更多氮素,接种根瘤菌紫花苜蓿全年产量增长大于10%,而且接种根瘤菌可以提高紫花苜蓿的蛋白质含量[20]。土壤水分对根瘤菌与豆科植物构建的共生固氮体系具有很大的影响。在适宜的土壤水分环境中生长的豆科植物根瘤数要显著的多于水分过高或过低的土壤环境[11, 21]。
研究发现灌水处理为W6(灌水时间间隔30 d+灌水量下限为60%FC)时秋播苜蓿的总根瘤数与侧根根瘤数最多,灌水处理为W5(灌水时间间隔20 d+灌水量下限为60%FC)时秋播苜蓿的有效根瘤数最多,整体来看并不是灌水越多根瘤数表现为越好。灌水越多则致使土壤水分越大,水分过量对豆科植物生长的影响比较复杂,此环境中土壤氧气偏少形成厌氧环境、土温降低、养分流失或有效性改变,因此使作物根部呼吸困难,导致水肥吸收受阻[12]。支金虎等[21]对新疆南部不同灌水量对紫花苜蓿的结瘤情况进行了探究,发现灌水量并非越多越好,适量的灌水量更能促进紫花苜蓿结瘤固氮,增加产量。Carter和Sheaffer[11]也发现灌溉对紫花苜蓿根瘤的形成有影响,根瘤数与根瘤干重均在水分灌溉条件下表现良好。本试验研究发现,随着干旱的加重,根瘤总数、有效根瘤数与侧根根瘤数均在干旱条件下表现为数量优势,这与许多人的研究结果不一致[6,22]。
植物根系从土壤中吸收水分以及养分供植物生长,根系是最早感知非生物胁迫的最重要的营养器官[23]。根系生物量在不同的灌水处理条件下虽然没有显著性差异,但是,呈现出随着灌水的减少或者干旱时间间隔的加大,秋播苜蓿根系生物量增加,这样更有利于根瘤菌的形成与根系营养的供给。范俊俊等[24]在室内盆栽发现,在苗期苜蓿根瘤数量竟不超过10个,而本试验为分枝期生长进行观测,但是最少根瘤数为13.3个,可见大田根瘤数比盆栽结瘤情况较好,可能是因为大田原状土当中有土著根瘤菌存在。
寇丹等[25]对甘肃石羊河流域地下滴灌紫花苜蓿进行调亏灌溉,发现在分枝期进行亏水处理,更有利于紫花苜蓿的茎叶比降低,增加蛋白营养指数。蔡焕杰等[26]在陕西长武以及甘肃民勤分析适度亏缺水分对作物产量的有益效应,表明调亏灌溉适宜时段应该在作物的早期生长阶段。而本试验对苜蓿分枝期进行调亏滴灌发现,分枝期进行适当的调亏灌溉可以增加苜蓿的结瘤数。
[1] Wall D H, Six J. Give soils their due[J]. Science, 2015,347(6 223):695.
[2] Golding A, Dong Z. Hydrogen production by nitrogenase as a potential crop rotation benefit[J]. Environmental Chemistry Letters, 2010,8(2):101-121.
[3] M. Dashadi H K A M. Co-Inoculation of rhizobium and azotobacter on growth of faba bean under water deficit conditions[J]. American-Eurasian J. Agric. & Environ. Sci., 2011,11(3):314-319.
[4] Mueller S C, Teuber L R. Alfalfa growth and development. In Irrigated Alfalfa Management for Mediterranean and Desert Zones, Publication 3512; Summers, C G Putnam, D H Eds, University of California/Agricultural and Natural Resources: Davis, CA, USA, 2008:31-38.
[5] 贾小红,周顺桂,李旭军,等. 北京地区紫花苜蓿根瘤菌接种剂的研制[J]. 应用基础与工程科学学报,2007,(1):17-22.
[6] Mouradi M, Farissi M, Bouizgaren A, et al. Effects of water deficit on growth nodulation and physiological and biochemical processes in Medicago sativa rhizobia symbiotic association[J]. Arid Land Research & Management, 2016,30(2):193-208.
[7] Harper J. Effect of Light, Dark, and Temperature on Root Nodule Activity (Acetylene Reduction) of Soybeans[J]. Plant Physiology,1980,65(1):51-56.
[8] 俞 艳,刘晓静,齐敏兴,等. pH和氮素形态对紫花苜蓿根瘤特性的影响[J]. 草原与草坪,2012,(5):7-11.
[10] 齐敏兴,刘晓静,张晓磊,等. 不同磷水平对紫花苜蓿光合作用和根瘤固氮特性的影响[J]. 草地学报, 2013,(3):512-516.
[11] Carter P, Sheaffer C. Alfalfa response to soil water deficits. Ⅲ. nodulation and N2 fixation[J]. Crop Science,1983,23(4):676-680.
[12] 陈利云. 盐渍地紫花苜蓿根瘤菌研究[D]. 兰州:兰州大学, 2009.
[13] Minchin F R, Pate J S. Effects of water, aeration, and salt regime on nitrogen fixation in a nodulated legume— definition of an optimum root environment[J]. Journal of Experimental Botany, 1975,26(90):60-69.
[14] Huang C, Boyer J, Vanderhoef L. Limitation of acetylene reduction (nitrogen fixation) by photosynthesis in soybean having low water potentials[J]. Plant Physiology, 1975,56(2):228-232.
[15] Drand J, Sheehy J E, Minchin F R. Nitrogenase activity, photosynthesis and nodule water potential in soyabean plants experiencing water deprivation[J]. Journal of Experimental Botany, 1987,38(187):311-321.
[16] Walsh K B. Vascular transport and soybean nodule function III: Implications of a continual phloem supply of carbon and water[J]. Plant Cell & Environment, 1990,194(13):893-901.
[17] 聂素梅,翁森红,徐恒刚. 沙打旺接种根瘤菌丸衣化和拌种比较试验[J]. 中国草地,2004,(3):39-42.
[18] Armstrong D L. Effects of Phosphorus on Nitrogen Fixation[J]. Better Crops With Plant Food, 1999,83(1).
[19] 刘丹丹,李 敏,刘润进. 我国植物根围促生细菌研究进展[J]. 生态学杂志,2016,(3):815-824.
[20] 曾昭海,隋新华,胡跃高,等. 紫花苜蓿-根瘤菌高效共生体筛选及其田间作用效果研究: 第二届中国苜蓿发展大会暨牧草种子、机械、产品展示会[Z]. 中国北京:2003.
[21] 支金虎,马春晖,蒋 慧,等. 干旱区水氮耦合对苜蓿产量及结瘤的调控[J]. 西南农业学报,2014,(3):1 143-1 146.
[22] 姚新春,师尚礼,王亚玲. 间歇性干旱对苜蓿根瘤形成的影响[J]. 草地学报,2007,15(3):216-220.
[23] 李希铭,宋桂龙. 镉胁迫对紫花苜蓿镉吸收特征及根系形态影响[J]. 草业学报,2016,(2):178-186.
[24] 范俊俊,刘晓静,李文卿. NO-3-N/NH+4-N配比对紫花苜蓿根系生长及固氮特性的影响[J]. 甘肃农业大学学报,2016,(1): 114-119.
[25] 寇 丹,苏德荣,吴 迪,等. 地下调亏滴灌对紫花苜蓿耗水、产量和品质的影响[J]. 农业工程学报,2014,(2):116-123.
[26] 蔡焕杰,康绍忠,张振华,等. 作物调亏灌溉的适宜时间与调亏程度的研究[J]. 农业工程学报,2000,(3):24-27.

