高温胁迫对不同热敏型辣椒同工酶及DNA甲基化的影响
胡能兵,隋益虎,舒英杰,何克勤
(安徽科技学院 农学院,安徽凤阳 233100)
高温胁迫对不同热敏型辣椒同工酶及DNA甲基化的影响
胡能兵,隋益虎,舒英杰,何克勤
(安徽科技学院 农学院,安徽凤阳 233100)
摘要:分别以耐热型晚熟紫色辣椒‘7036’和热敏型早熟绿色辣椒‘9050’为材料,研究了40℃高温胁迫对其POD同工酶以及DNA甲基化表达的影响。结果显示:(1)在POD同工酶表达方面,未经高温胁迫的辣椒‘7036’比其它处理多出1条带,而同工酶活性在2种辣椒中呈现不同的变化趋势。(2)随着高温胁迫时间延长,辣椒‘7036’DNA无甲基化和全甲基化比率增加,半甲基化和总甲基化比率降低,而辣椒‘9050’只有高温处理7 d (T7)的甲基化水平变化与之类似,但半甲基化和全甲基化比率的绝对值远低于辣椒‘7036’。(3)高温处理7 d的 DNA甲基化模式中,辣椒‘7036’去甲基化C型条带比率较高,辣椒‘9050’以超甲基化B型条带为主。实验表明,高温胁迫下紫色辣椒‘7036’的POD同工酶活性恢复,半甲基化水平大幅下降和全甲基化水平快速上升以及去甲基化等变化可能与其耐高温胁迫特性相关。
关键词:辣椒;高温胁迫;POD同工酶;DNA甲基化;去甲基化
高温是植物生长发育过程中最常见的环境胁迫因子之一,严重影响植物正常生长、产量以及品质等[1]。特别是随着全球性温室效应的持续加剧,严重高温逆境给全球种植业带来挑战[2]。以中国为例,夏秋之际的高温会严重影响全国绝大部分地区的蔬菜生产和供应,导致蔬菜产量急剧下降,价格不断攀升。
茄科植物是中国的主要蔬菜作物,尤以辣椒最受喜爱。辣椒原产南美洲地区,是一种喜温怕热的蔬菜[3]。辣椒生长的适宜温度为20~30 ℃,超过32 ℃就会发生高温胁迫[4]。邹学校研究表明,在40 ℃高温处理下,辣椒的发芽率、发芽势、发芽指数以及生长速率均有所下降,但品种间存在差异,表现为热敏品种降幅更大[5];Pagamas等研究表明,耐热品种在不同温度处理下,其株高、根长、茎粗等降幅小于热敏品种[6];此外,热胁迫主要导致辣椒‘三落’(落叶、落花、落果)而影响产量,超过30 ℃高温会使辣椒座果率降至10%~20%[5]。
目前,研究者已对辣椒的耐热性开展了相关的应用及基础研究[4,7-10]。此外,安徽科技学院辣椒课题组以当地的紫色辣椒为材料,在育种方面做了有益的工作,即紫色辣椒自交或作为母本用于杂交的座果率要极显著高于绿色品种[11]。结合本课题组以及前人在紫色辣椒的研究成果,说明紫色辣椒具有耐高温强光的特性,明确其在抗性和品质育种方面的巨大潜能[12-13]。然而,迄今为止尚未有从分子水平探索紫色辣椒耐高温的机制。
本实验以耐热型晚熟紫色辣椒‘7036’和热敏型早熟绿色辣椒‘9050’为材料,以40 ℃为高温胁迫条件,在该条件下分别对上述不同热敏型辣椒进行不同时间的处理,通过比较‘7036’和‘9050’在同工酶、甲基化水平和模式的变化,明确紫色辣椒适应高温胁迫的生理生化机理,为后续克隆与高温胁迫相关的序列片段、进而发掘耐高温胁迫的关键基因奠定基础。
1材料和方法
1.1供试材料
耐热型晚熟紫色辣椒‘7036’和热敏型早熟绿色辣椒‘9050’分别由安徽科技学院辣椒课题组多年选育、纯化而成。其中,紫色辣椒‘7036’开花结果期叶片、茎秆呈浓紫色,果实在整个生育期会经历紫、绿相间-紫色-紫、红相间、红色等4个过程,具体见相关文献[12]。
1.2高温胁迫处理
2014年11月初在温室内播种育苗,待辣椒长至6叶1心期,将幼苗移至育苗基质中炼苗10 d左右。置于恒温培养箱中,每天40 ℃处理3 h,分别于处理第0、1、3、5、7天取整株叶片,取样时间为处理后2 h,每个样品随机取3株,分别标记为CK、T1、T3、T5、T7。一部分叶片用于POD同工酶提取,其余叶片则置于-20 ℃条件下保存,用于后续DNA提取。
1.3POD同工酶检测
按照叶片重量∶提取缓冲液体积(0.065 mol/L Tris-柠檬酸,pH 8.2)=1∶2的比率在冰浴条件下研磨,10 000 r/min转速4 ℃离心5 min,置于-20 ℃条件下保存备用。浓缩胶和分离胶浓度分别为4%和7%。POD电泳时间为2.5 h,电泳完毕后,采用联苯胺法进行染色[14]。
1.4甲基敏感扩增多态性(MSAP)分析
DNA提取采用改良CTAB法[8]。提取的DNA分别经过琼脂糖凝胶电泳和紫外分光光度计法检测,各处理DNA调整为一致浓度后用于后续试验。MSAP试验步骤等参照Reyna-López等[15]方法,主要包括酶切、连接、预扩增和选择性扩增等4个步骤。MSAP的接头和引物序列见表1,所用双酶切组合为EcoRⅠ/HpaⅡ(MspⅠ),其中选择性扩增为E1~E6与H1~H4共24个引物随机组合。采用银染法染色[16]。
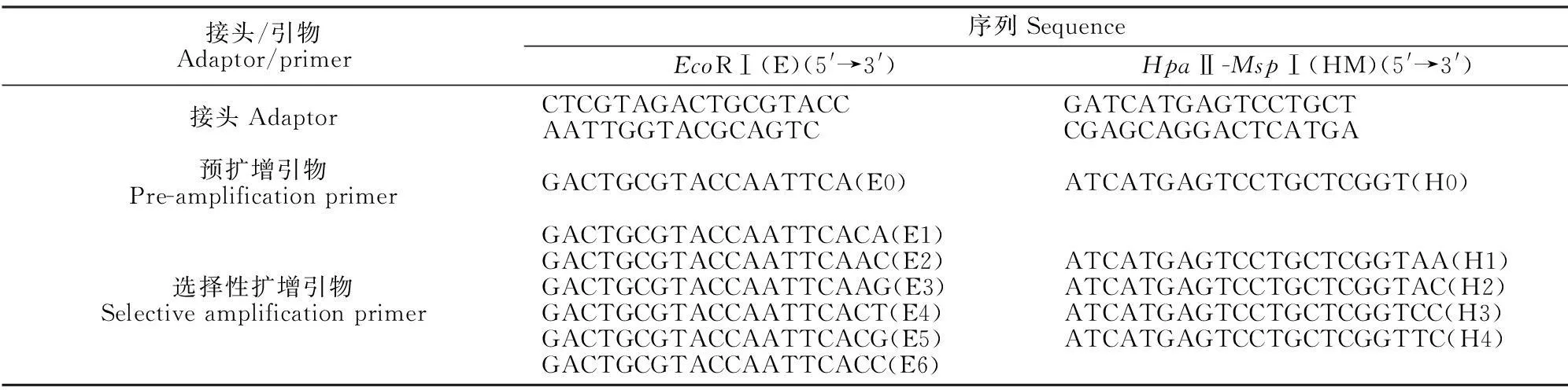
表1 接头和引物序列
1.5数据统计
对双酶切后的条带数量和条带的类型进行统计与分析。其中,1个酶切识别位点即为1条带,条带的有无分别用1和0来表示。
2结果与分析
2.1高温胁迫对2种辣椒POD同工酶表达的影响
POD同工酶是一族能够利用H2O2氧化供氢体的酶,在高等植物中广泛存在,而高温胁迫会引起同工酶类型和活性的变化,且该变化会随着种质的不同而有所差异。本试验所有处理中,耐热型种质‘7036’的CK表达了最多的8个谱带,在电场作用下其迁移率Rf值分别是0.05、0.28、0.45、0.59、0.63、0.67、0.70、0.74,依次标记为a、b、c、d、e、f、g、h(图1),其它处理均缺失1条e带,表现为种质类型和处理时间的不同引起的POD同工酶类型上的差异;在活性较强的共有谱带d、f、g、h上,随着高温胁迫时间的延长,耐热型种质‘7036’的POD活性经历先下降(1 d)、后迅速恢复(3 d)并逐渐稳定(5 d、7 d)的过程,活性最强出现在CK,最弱为T1处理;与耐热型种质‘7036’表现不同的是,热敏型种质‘9050’ POD同工酶活性初期先迅速升高(1 d),后显著下降(3 d、5 d)并逐渐恢复(7 d),活性最强出现在T1处理,最弱为T5处理。总体而言,在2种不同热敏性辣椒材料中,未经高温处理时(0 d),耐热型种质‘7036’的POD同工酶活性要显著高于热敏性种质‘9050’,胁迫初期(1 d)在2份种质呈现相反的变化趋势,处理的中后期(3~7 d) 种质‘7036’的POD同工酶活性趋于稳定,而种质‘9050’的POD同工酶活性仍呈现剧烈变化(T5处理)。
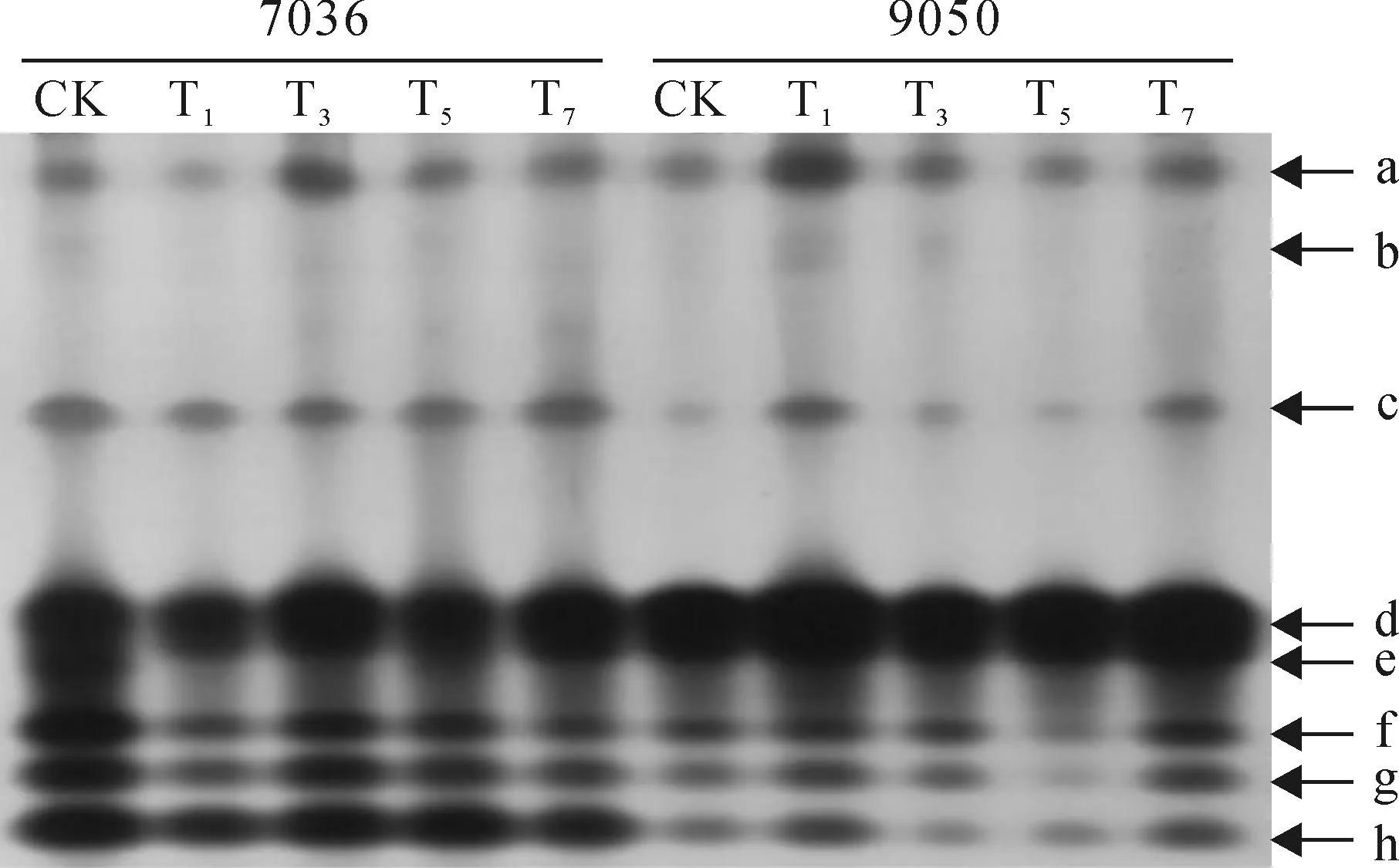
CK、T1、T3、T5、T7分别为40 ℃处理(3 h/d) 0、1、3、5、7 d;下同
2.2辣椒叶片DNA质量检测
10个处理的辣椒叶片DNA用0.8%的琼脂糖检测其浓度和质量,其电泳结果见图2。提取的DNA呈单一条带,无降解现象;进一步用紫外分光光度计检测表明提取的DNA纯度较高,将上述处理的DNA浓度统一调整到20 ng/μL用于后续实验。
2.3高温胁迫对2种辣椒甲基化水平的影响
本实验中,运用同裂酶HpaⅡ、MspⅠ与EcoRⅠ的组合对不同处理进行双酶切,尽管同裂酶HpaⅡ和MspⅠ都能够识别并切割基因组中的CCGG序列,但对于该序列位点出现的胞嘧啶甲基化,两者的反应不同,会产生3种不同甲基化类型:类型I的两种酶切组合EcoRⅠ-HpaⅡ和EcoRⅠ-MspⅠ都有条带,为无甲基化位点;类型Ⅱ的EcoRⅠ-HpaⅡ有带而EcoRⅠ-MspⅠ无条带,表明在该位点单链外甲基化,为半甲基化位点;类型Ⅲ的EcoRⅠ-HpaⅡ无带而EcoRⅠ-MspⅠ有带,表明在该位点双链内甲基化,为全甲基化位点(图3)。
为比较高温胁迫下耐热型辣椒‘7036’和热敏型辣椒‘9050’全基因组DNA甲基化水平的变化,实验共利用24个引物组合对上述不同处理的DNA样品进行了MSAP分析。由结果(表2)可知,辣椒‘7036’各处理扩增的总条带数为294~402,甲基化条带总数为186~213,总甲基化条带比率为48%~63.3%;其中的半甲基化条带比率为19.8%~50.6%,全甲基化条带比率为12.6%~36.5%;辣椒‘9050’各处理扩增的总条带数为290~441,甲基化条带总数是165~252,总甲基化条带比率为53.5%~60.2%;其中的半甲基化条带比率为22.3%~26.8%,全甲基化条带比率为27.8%~34.8%。
进一步比较不同处理与CK的DNA甲基化水平的差异可知,在辣椒‘7036’中,各处理无甲基化、全甲基化比率都高于CK,但半甲基化和总甲基化比率要低;在辣椒‘9050’中,只有T7处理与‘7036’各处理表现类似的变化规律,但其绝对值,尤其是半甲基化和全甲基化比率的数值要远低于辣椒‘7036’,而辣椒‘9050’其它处理的变化则不尽相同。该结果表明,随着热锻炼时间的延长(7 d),热敏型辣椒‘9050’对高温胁迫有了一定的忍受能力,但其耐受性仍然远低于耐热型辣椒‘7036’。
图2 DNA质量电泳图片
H和M分别表示由引物组合EcoRⅠ-HpaⅡ和EcoRⅠ-MspⅠ
2.4高温胁迫对2种辣椒甲基化模式的影响
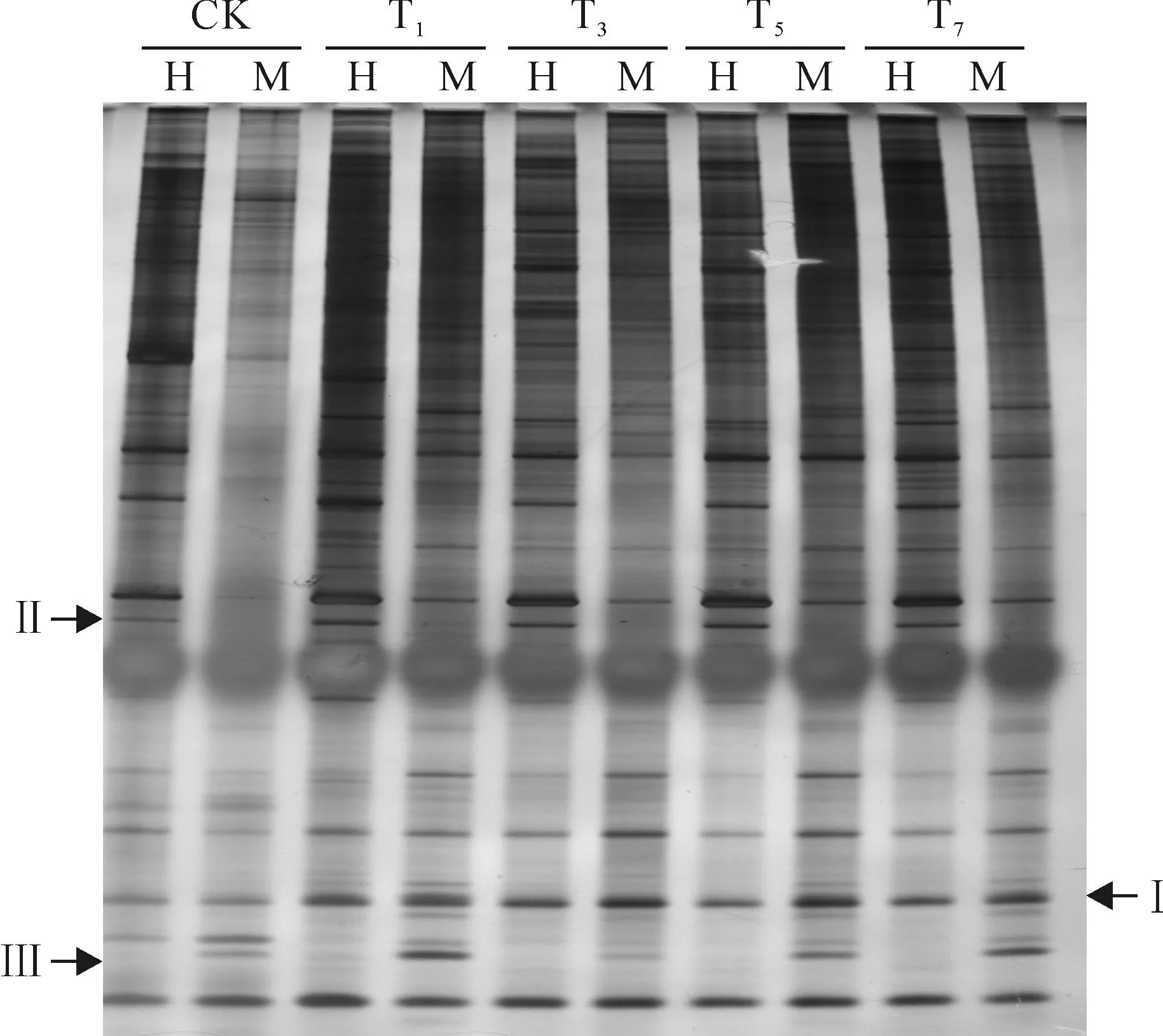
根据高温胁迫辣椒基因组所导致的甲基化状态,以CK和T7进行对比,在2种辣椒中共发现3大类13种带型。A类为单态性条带,即T7与CK的甲基化位点相同,表明高温胁迫并未引起不同处理间甲基化状态的改变。其中,A1、A2、A3依次为无甲基化类型、半甲基化类型和全甲基化类型。B类为超甲基化类型,即与CK相比,高温胁迫处理T7会引起甲基化水平增加,增加的类型又细分为B1、B2、B3、B4、B5等5类;C类为去甲基化类型,表明高温胁迫处理T7会诱导甲基化水平的降低,降低的类型又细分为C1、C2、C3、C4、C5等5类。
为检测高温胁迫下辣椒‘7036’和辣椒‘9050’的全基因组DNA甲基化模式的变化,利用24个引物组合对对照和T7处理的样品进行了MSAP分析和比较,结果见表3和图4。在辣椒‘7036’的总条带为480时,A、B、C型条带的数目分别为164、62和254条,A、B、C型条带比率分别为34.2%、13%和52.8%;在辣椒‘9050’的总条带为539时,A、B、C型条带的数目分别为265、177和97条,A、B、C型条带比率分别为49.2%、32.8%和18%。
上述不同类型条带中,除了A型条带为对照和T7无差异性条带外,B型、C型均为与高温胁迫相关的DNA甲基化多态性带型。比较辣椒‘7036’和辣椒‘9050’在细分类型的不同可知,辣椒‘7036’以C型条带居多,表明是以去甲基化为主;而辣椒‘9050’以B型条带居多,表明是以超甲基化为主。上述结论表明,在高温胁迫条件下,DNA去甲基化而不是超甲基化可能是紫色辣椒耐高温胁迫的原因之一。
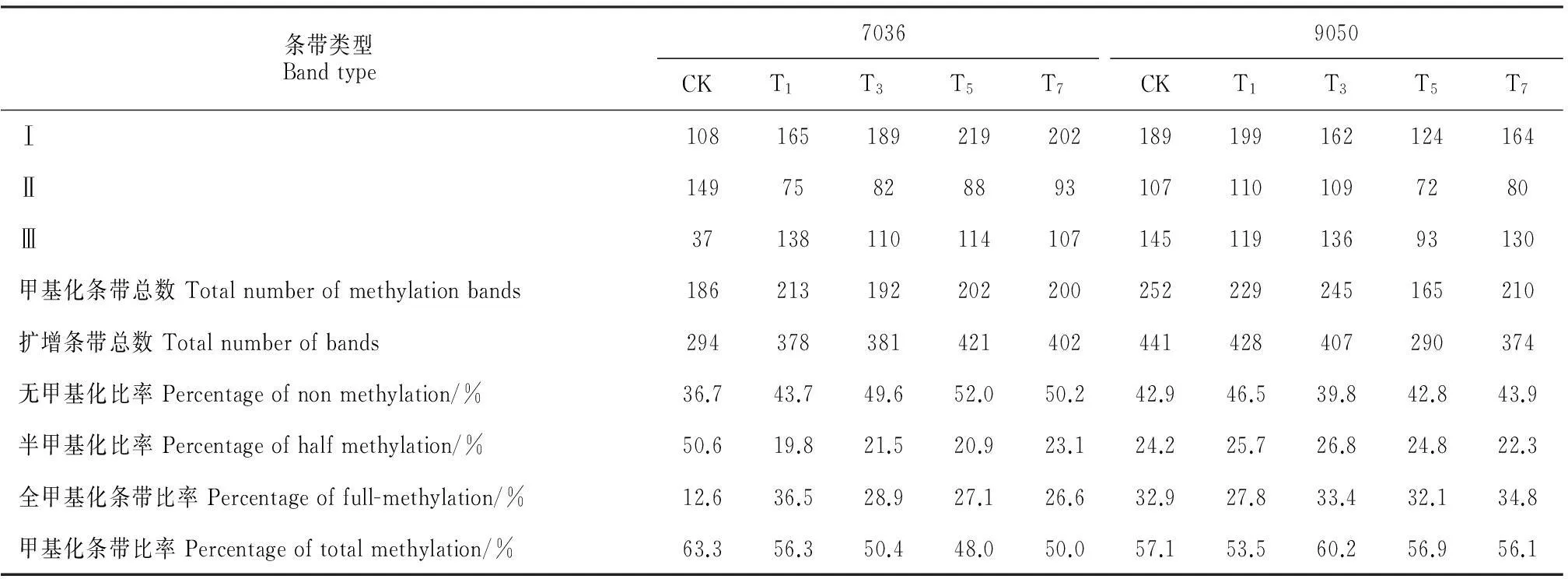
表2 2种辣椒不同处理的DNA甲基化水平
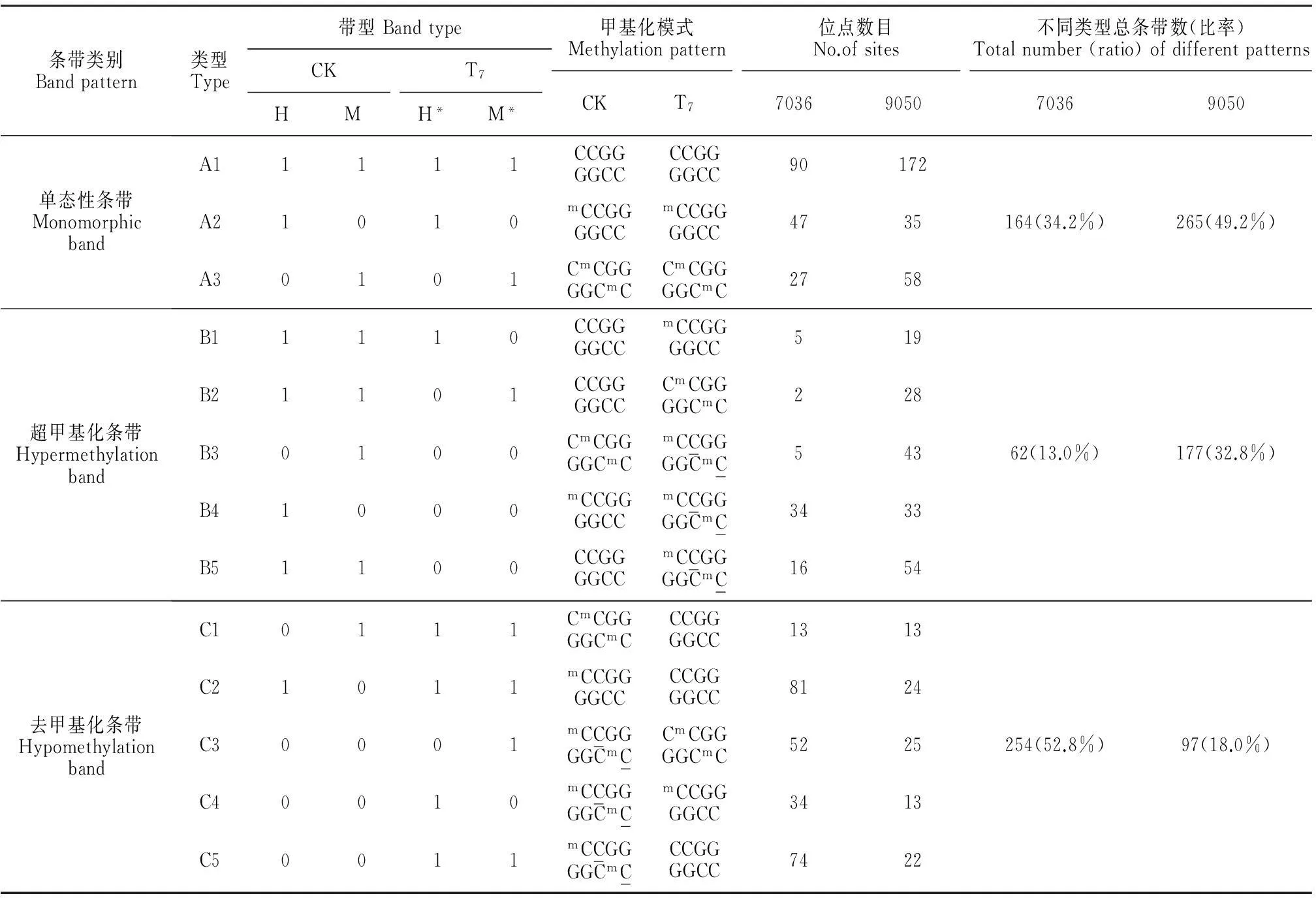
表3 CK与T7处理的甲基化状态比较
注:C.无甲基化的胞嘧啶;mC.有甲基化的胞嘧啶;C.甲基化不明确的胞嘧啶。
Note:C.Cytosine without methylation;mC.Cytosine with methylation;C.Cytosine with indefinite methylation.
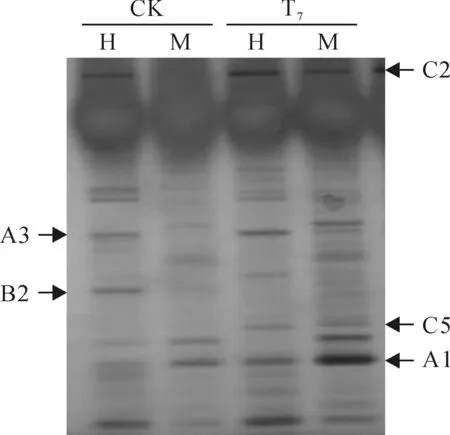
图4 用引物E5H4检测辣椒‘9050’的
3讨论
在中国中东部以及沿海地区,每年的6~8月份会有连续多天超过33 ℃以上的高温天气[17]。此时正值非设施辣椒的开花结果期,辣椒在高温胁迫条件下会发生一系列的生长障碍,进而导致其‘三落’现象严重、出现大面积的衰老和死亡。因此,亟需育种研究者在筛选耐高温胁迫的辣椒种质的同时,从不同角度分析辣椒耐高温胁迫的机理,以快速发掘抗性种质并予以改良和应用。
目前,有关辣椒应对高温胁迫的生理报道中,姚元干认为辣椒耐热性与电解质外渗率和MDA含量呈负相关,与POD、SOD活性以及Pro含量呈正相关[18];马宝鹏得出“SOD、POD活性以及Pro和MDA含量可作为辣椒耐热鉴定的辅助生理指标,且耐热品系的SOD和POD活性均显著高于热敏品系”的结论[9];而何铁光的研究与之有所差异,其研究表明,随着处理时间的延长,SOD和POD活性均表现先下降后上升趋势,其中热敏材料下降幅度高于耐热材料,上升幅度则相反[10]。本研究中,未经高温处理时(0 d),耐热型种质‘7036’的POD同工酶活性要显著高于热敏性种质‘9050’,随着高温胁迫时间的延长,辣椒‘7036’的POD同工酶活性经历先下降(1 d)、后迅速恢复(3 d)并逐渐稳定(5 d、7 d)的过程,而热敏型种质‘9050’则在胁迫初期(1 d)和后期(7 d)表现较高的同工酶活性。但总体上,耐热种质的POD活性要高于热敏种质,且具有较强的POD活性恢复能力。因此,综合前人的研究成果以及本研究的结论,以一段时间内(如本例中的7 d)辣椒POD平均活性的强弱作为判断耐热和热敏的指标,可能更具有客观性。
研究表明,植物核基因组中位于CG、 CHG和CHH序列(H代表A 或T或C碱基)中的胞嘧啶碱基存在甲基化现象,在植物正常生长、细胞分化、基因组印记和染色质失活等过程发挥着重要的作用[19-23]。目前,高效液相色谱法(HPLC)、亚硫酸氢盐法和甲基敏感扩增多态性(MSAP)技术是3种最常见的检测基因组甲基化的方法,其中以MSAP技术多态性高、引物设计简单、通用性强而得以广泛运用。本试验的24个引物组合除了E4H4外,其余23个组合都扩增出条带,而该引物在棉花、石斛等多种作物中都得以成功运用[24-26]。本试验中,2种辣椒的基因组CCGG位点的甲基化比率变化范围为50%~63.3%,其中,以耐热型辣椒‘7036’比热敏型辣椒‘9050’变化幅度要宽,该变化是否存在一定的规律性,目前尚无定论[27]。
此外,植物生长发育过程中会遭遇诸多生物以及非生物胁迫,而基因组胞嘧啶甲基化的变化是植物应付各种不同类型胁迫的防御机制[28]。DNA甲基化的产生是DNA甲基化酶和去甲基化酶共同作用的结果,高水平的甲基化使基因保持抑制,低水平甲基化则可以增强基因的表达,这可能是由于通过移除诸多不合理位点的甲基化,重新选择DNA位点安置甲基化,从而激活特定基因以应答逆境胁迫[29-30]。盐胁迫条件下,油菜、棉花中耐盐品系的甲基化位点数多于敏感品系,但去甲基化位点数大于敏感品系[31-32];在水稻中的研究表明,基因的去甲基化不是随机发生的[33];温度胁迫中,陈芳等以小麦种子和幼苗为材料进行超低温保存,该材料经低温处理后发生了不同程度的甲基化变化,但去甲基化变化是主要趋势[34];高贵珍等以油菜种子进行的热胁迫实验表明,耐热品种的去甲基化条带数多于不耐热品种,但甲基化条带数则相反,推测DNA去甲基化可能与植物对热胁迫的适应起到积极作用[35];生物胁迫中,Le等研究得出缺失3个DNA去甲基化酶rdd的拟南芥突变体WT Col-0易受尖孢镰刀菌(Fusariumoxysporum)的感染,在鉴定的348个基因中有279个活性发生了下调,比率达到80.2%,揭示植物DNA去甲基化与抗性之间的积极关系[36];病毒侵染会使烟草DNA甲基化水平显著升高,但与抗病性相关的亮氨酸重复序列区域却发生了低甲基化[37]。本试验比较了耐热型辣椒‘7036’和热敏型辣椒‘9050’在40 ℃高温胁迫下的甲基化水平变化。其中,辣椒‘7036’中各处理的无甲基化、全甲基化比率升高,而半甲基化和总甲基化比率降低;在辣椒‘9050’中只有T7处理与‘7036’各处理表现类似的变化规律,但其绝对值,尤其是半甲基化和全甲基化的数值要远低于辣椒‘7036’。该结果表明,随着热锻炼时间的延长(7 d),热敏型辣椒‘9050’对高温胁迫有了一定的忍受能力,但其耐受性仍然远低于耐热型辣椒‘7036’。该结论与徐小万等研究结果中关于“高温胁迫4 d后耐高温辣椒总甲基化率和全甲基化率有所下降、热敏辣椒总甲基化率和全甲基化率有所上升”存在差异[38]。其差异的原因除了所用材料的不同外,本实验结论是基于材料7 d的连续处理结果,且所用引物也更多。在甲基化模式变化上,辣椒‘7036’以C型条带居多,表明是以去甲基化为主;而辣椒‘9050’以B型条带居多,是以超甲基化为主。该结论与前人诸多的研究结论较为一致,即去甲基化可能积极参与紫色辣椒耐高温胁迫。
综上所述,本研究探讨了40 ℃高温胁迫对耐热型晚熟紫色辣椒‘7036’和热敏型早熟绿色辣椒‘9050’的POD同工酶以及DNA甲基化表达的影响。结果表明,同工酶类型和活性在不同种质以及不同处理阶段存在差异,未经高温胁迫的耐热型辣椒‘7036’比其它处理多了1条Rf值为0.63的e带,而在胁迫条件下其POD同工酶恢复能力要显著高于热敏型辣椒‘9050’;随着高温胁迫时间的延长,辣椒‘7036’的无甲基化和全甲基化比率增加,半甲基化和总甲基化比率降低,而辣椒‘9050’只有T7处理的甲基化水平变化与之类似,但半甲基化和全甲基化的绝对值要远低于辣椒‘7036’;甲基化模式分析表明辣椒‘7036’去甲基化C型条带比率较高,而辣椒‘9050’则以超甲基化B型条带为主。上述结论中,POD同工酶活性的恢复,半甲基化水平的大幅下降和全甲基化水平的快速上升以及去甲基化可能与紫色辣椒耐高温胁迫相关。
参考文献:
[1]徐小万,雷建军,李颖,等.基于数学模型的辣椒芽期耐高温多湿性综合评价方法[J].中国农业科技导报,2013,6:174-180.
XU X W,LEI J J,LI Y,etal.Comprehensive evaluation of high temperature and humidity tolerance of hot pepper at germination stage bases on mathematical model[J].JournalofAgriculturalScienceandTechnology,2013,6:174-180.
[2]高亮之,金之庆.全球气候变化和中国的农业[J].江苏农业学报,1994,2:1-10.
GAO L Z,JIN Z Q.Global climate change and China’s agriculture[J].JiangsuAcademyofAgriculturalSciences,1994,2:1-10.
[3]胡能兵.紫色辣椒再生体系的建立及种质亲缘关系分析[D].合肥:安徽农业大学,2008.
[4]马宝鹏.辣椒耐热性鉴定体系的建立及高温胁迫下花药基因表达差异的研究[D].陕西杨陵:西北农林科技大学,2013.
[5]邹学校.中国辣椒[M].北京:中国农业出版社,2002:10-22.
[6]PAGAMAS P,NAWATE E.Sensitive stages of fruit and seed development of chili pepper(CapsicumannumL.var.Shishto) exposed to high-temperature stress[J].ScientiaHorticulturae,2008,117(1):21-25.
[7]潘宝贵.高温胁迫对辣椒苗期光合作用和抗氧化系统的影响[D].江苏扬州:扬州大学,2005.
[8]徐小万,雷建军,罗少波,等.高温高湿对不同品种(系)现蕾期辣椒(CapsicumannuumL.)抗氧化性的影响[J].核农学报,2010,2:394-400.
XU X W,LEI J J,LUO S B,etal.Effect of high temperature and air humidity stress on antioxidant activity differences of hot pepper varieties at budding stage[J].JournalofNuclearAgriculturalSciences,2010,2:394-400.
[9]马宝鹏,逯明辉,巩振辉.辣椒幼苗对高温胁迫的生长生理响应[J].西北农林科技大学学报(自然科学版),2013,10:112-118.
MA B P,LU M H,GONG Z H.Responses of growth and physiology of pepper(CapsicumannuumL.) seedlings to heat stress[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.),2013,10:112-118.
[10]何铁光,董文斌,王爱勤,等.高温胁迫下辣椒生理生化响应机理初步探讨[J].西南农业学报,2013,2:541-544.
HE T G,DONG W B,WANG A Q,etal.Studies on physiological and biochemical response mechanism to heat stress in pepper seedlings with different heat tolerance[J].SouthwestChinaJournalofAgriculturalSciences,2013,2:541-544.
[11]隋益虎.辣椒紫色性状遗传分析、相关基因克隆和种间杂种创制[D].南京:南京农业大学,2011.
[12]胡能兵,隋益虎,张子学,等.紫色辣椒色素性状观察及其叶片色素提取体系优化[J].西北植物学报,2012,12:2 450-2 456.
HU N B,SUI Y H,ZHANG Z X,etal.Observation of pigment in purple pepper and extraction system optimization of leaf purple pigment[J].ActaBot.Boreal.-Occident.Sin.,2012,32(12):2 450-2 456.
[13]滕有德,徐向上,陈学群.川西南辣椒种质资源[J].中国蔬菜,1997,3:29-32.
[14]胡能兵,崔广荣,张子学,等.谷氨酰胺、氯化镧对石斛兰离体增殖及叶片POD、CAT同工酶表达的影响[J].稀土,2011,1:90-95.
HU N B,CUI G R,ZHANG Z X,etal.Effects of lutamine,lanthanum chloride on proliferation ofDendrobiuminvitroand POD,CAT isozyme expression of leaves[J].ChineseRareEarths,2011,1:90-95.
[16]BASSAM B J,CAETANO-ANOLLES G,GRESSHOFF P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].AnalyticalBiochemistry,1991,196:80-83.
[17]徐小万,雷建军,罗少波,等.辣椒苗期耐热耐湿鉴定方法的研究[J].核农学报,2009,5:884-890.
XU X W,LEI J J,LUO S B,etal.Identification of hot pepper(CapsicumannuumL.) seedling for high temperature and air humidity resistance[J].JournalofNuclearAgriculturalSciences,2009,05:884-890.
[18]姚元干,石雪晖,杨建国,等.辣椒耐热性与叶片质膜透性及几种生化物质含量的关系[J].湖南农业大学学报,2000,2:97-99.
YAO Y G,SHI X H,YANG J G,etal.Relations of the permeability of plasma membrane of leaves and the contents of several biochemical matter to heat-tolerance of pepper[J].JournalofHunanAgriculturalUniversity,2000,2:97-99.
[19]XIONG L Z,XU C G,SAGHAI M A,etal.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymorphism technique[J].MolecularandGeneralGenetics,1999,261:439-446.
[20]BARANEK M,KRIZAN B,ONDRUSIKOVA E,etal.DNA-methylation changes in grapevine somaclones following in vitro culture and thermotherapy[J].PlantCellTissueandOrganCulture,2010,101:11-22.
[21]SUZIKI M M,BIRD A.DNA methylation landscapes:provocative insights from epigenomics[J].NatureReviewsGenetics,2008,9:464-476.
[22]ZHANG M S,KIMATU J N,XU K Z,etal.DNA cytosine methylation in plant development[J].JournalofGeneticsandGenomics,2010,37,1-12.
[23]PORTIS E,ACQUADRO A,COMINO C,etal.Analysis of DNA methylation during germination of pepper (CapsicumannuumL.) seeds using methylation-sensitive amplification polymorphism (MSAP)[J].PlantScience,2004,166:169-178.
[24]关蕾,樊洪泓,陈沙沙,等.强光下H2S对石斛DNA甲基化及抗氧化系统的影响[J].核农学报,2013,8:1 090-1 098.
GUAN L,FAN H H,CHEN S S,etal.Effect of sodium hydrosulfide on DNA methylation and antioxidant system ofDendrobiumofficinaleunder high light stress[J].JournalofNuclearAgriculturalSciences,2013,8:1 090-1 098.
[25]郭宁,席晓广,张晓旭,等.乙烯利处理对棉花子叶DNA表观遗传变化的甲基化敏感扩增多态性(MSAP)分析[J].农业生物技术学报,2014,9:1 131-1 140.
GUO N,XI X G,ZHANG X X,etal.Methylation sensitive amplified polymorphism(MSAP) analysis of DNA epigenetic changes of cotton(GossypiymhirsutunL.) cotyledons under ethephon treatment[J].JournalofAgriculturalBiotechnology,2014,9:1 131-1 140.
[26]FAN H H,LI T C,GUAN L,etal.Effects of exogenous nitric oxide on antioxidation and DNA methylation ofDendrobiumhuoshanensegrown under drought stress[J].PlantCellTissueandOrganCulture,2012,109:307-314.
[27]潘雅姣,傅彬英,王迪,等.水稻干旱胁迫诱导DNA甲基化时空变化特征分析[J].中国农业科学,2009,9:3 009-3 018.
PAN Y J,FU B Y,WANG D,etal.Spatial and temporal profiling of DNA methylation induced by drought stress in rice[J].ScientiaAgriculturaSinica,2009,9:3 009-3 018.
[28]李青芝,李成伟,杨同文.DNA甲基化介导的植物逆境应答和胁迫记忆[J].植物生理学报,2014,50(6):725-734.
LI Q Z,LI C W,YANG T W.Stress response and memory mediated by DNA methylation in plants[J].PlantPhysiologyJournal,2014,50(6):725-734.
[29]FINNEGAN E J,GENGER R K,KOVAC K,etal.DNA methylation and the promotion of flowering by vernalization[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1998,95:5 824-5 829.
[30]KUMAR S,KUMARI R,SHARMA V,etal.Roles,and establishment,maintenance and erasing of the epigenetic cytosine methylation marks in plants[J].JournalofGenetics,2013,92(3):629-666.
[31]MARONI G,PACE R,TRAINI A,etal.Use of MSAP markers to analyse the effects of salt stress on DNA methylation in rapeseed(Brassicanapusvar.oleifera)[J].PloSOne,2013,8(9):e75597.
[32]ZHAO Y L,YU S X,YE W W,etal.Study on DNA cytosine methylation of cotton(GossypiumhirsutumL.) genome and its implication for salt stress tolerance[J].AgriculturalSciencesinChina,2010,9(6):783-791.
[33]WANG W,ZHAO X,PAN Y,etal.DNA methylation changes detected by methylation-sensitive amplified polymorphism in two contrasting rice genotypes under salt stress[J].JournalofGeneticsandGenomic,2011,38(9):419-424.
[34]陈芳,王子成,何艳霞,等.超低温保存小麦种子和幼苗的遗传变异分析[J].核农学报,2009,4:548-554,638.
CHEN F,WANG Z C,HE Y X,etal.Analysis of genetic variation of wheat seeds and seedlings caused by ultra-low-temperature preservation[J].JournalofNuclearAgriculturalSciences,2009,23(4):548-554,638.
[35]高桂珍,应菲,陈碧云,等.热胁迫过程中白菜型油菜种子DNA的甲基化[J].作物学报,2011,37(9):1 597-1 604.
GAO G Z,YING F,CHEN B Y,etal.DNA methylation of seed in response to heat stress inBrassicarapaL.[J].ActaAgronomicaSinica,2011,37(9):1 597-1 604.
[36]LE T,SCHUMANN U,SMITH N A,etal.DNA demethylases target promoter transposable elements to positively regulate stress responsive genes inArabidopsis[J].GemomeBiology,2014,15:458.
[37]BOYKO A,KATHIRIA P,ZENP F J,etal.Transgenerational changes in the genome stability and methylation in pathogen-infected plants[J].NucleicAcidsResearch,2007,35(5):1 714-1 725.
[38]徐小万,雷建军,张长远,等.高温多湿胁迫下辣椒DNA甲基化分析[J].核农学报,2014,7:1 175-1 180.
XU X W,LEI J J,ZHANG C Y,etal.Methylation-sensitive amplified polymorphism analysis of DNA methylation in hot pepper under high temperature and air humidity stress[J].JournalofNuclearAgriculturalSciences,2014,7:1 175-1 180.
(编辑:宋亚珍)
Effect of Heat Stress on Isoenzyme and DNA Methylation of Different Heat-sensitive Peppers
HU Nengbing,SUI Yihu,SHU Yingjie,HE Keqin
(College of Agriculture,Anhui Science and Technology University,Fengyang,Anhui 233100,China)
Abstract:By using heat-resisting,late-maturing purple pepper‘7036’and heat-sensitive,early-maturing green pepper‘9050’,we studied the effects of heat stress on POD isozyme and DNA methylation expression.The results indicated that:(1)as for POD expression,one more band existed in treatment without heat stress in pepper‘7036’,and different change tendency of POD activity existed in two peppers.(2)With the time extending,percentage of non-methylation and full-methylation increased,whereas percentage of half methylation and total methylation decreased in pepper‘7036’,and only percentage of methylation in the treatment of heat stress for 7 days(T7) showed similar changing tendency in pepper‘9050’,while its absolute values of full-methylation and half methylation ratio were significantly less than those of‘7036’.(3)As regards to methylation profiles of T7treatment,higher ratio of C type band of hypomethylation existed in pepper‘7036’and B type band of hypermethylation showed in pepper‘9050’.The results above showed that,recovery of POD activity,declining in percentage of half methylation and rising in percentage of full-methylation rapidly,and hypomethylation were relevant to resisting heat stress in purple pepper‘7036’.
Key words:pepper;heat stress;POD isozyme;DNA methylation;hypomethylation
中图分类号:Q945.78
文献标志码:A
作者简介:胡能兵(1980-),男,博士,副教授,主要从事园艺植物组织培养及育种工作。E-mail:hunengbing@126.com
基金项目:安徽省教育厅重点项目(KJ2014A057);安徽科技学院自然科学项目(ZRC2013374);安徽科技学院第十二批大学生创新基金
收稿日期:2015-10-20;修改稿收到日期:2015-12-15
文章编号:1000-4025(2016)01-0131-08
doi:10.7606/j.issn.1000-4025.2016.01.0131

