枯草芽胞杆菌和吡唑醚菌酯协同防治草莓病害
姚克兵,张玉军,王劲根,许 媛,杨敬辉
(江苏丘陵地区镇江农业科学研究所,江苏 句容 212400)
枯草芽胞杆菌和吡唑醚菌酯协同防治草莓病害
姚克兵,张玉军,王劲根,许 媛,杨敬辉*
(江苏丘陵地区镇江农业科学研究所,江苏 句容 212400)
为了探索化学农药在草莓病害防治上的减量使用,采用枯草芽胞杆菌DJ-6菌株的制剂(BCA)和化学农药吡唑醚菌酯(Pyraclostrobin,PS)联用来协同防治。用浊度法检测了DJ-6菌株在不同浓度PS中的敏感性。结果表明,在所有参试的浓度中,DJ-6菌株都能生长。田间防治结果表明,BCA能有效降低PS的使用浓度,BCA单用能防治草莓炭疽病和草莓白粉病,但防效低于PS在标准施用剂量下的防效。然而,BCA与PS联用后能减少50 %的PS的施用量。BCA与PS联用后能提高DJ-6在草莓叶围的存活率。两者联用后草莓叶片中过氧化酶、多酚氧化酶、苯丙胺酸裂解酶、β-1,3-葡聚糖酶活性显著上升了近2倍。
草莓病害;枯草芽孢杆菌DJ-6;吡唑醚菌酯;协同防治
草莓炭疽病菌(Colletotrichumfragariae)和白粉病菌(Sphaerothecaaphanis)是导致草莓减产的主要病原菌,常年造成10 %~60 %不等的损失[1]。当前国内的草莓主栽品种大都高感炭疽病和白粉病,其防治主要依赖于化学药剂。吡唑醚菌酯(Pyraclostrobin,PS)属新型线粒体呼吸抑制剂类杀菌剂[2],是近年来防治草莓地上部病害的当家药剂[3],但由于连年高频次施用,局部地区抗药性水平已相当高,随着PS在中国专利保护到期,运用PS防治的成本将大大降低,将会有更高频次和更大范围的应用,抗药性暴发流行的风险增大。加之,吡唑类为中等毒性药剂,而草莓生产中开花和采果交替进行,因此,该类药剂在草莓开花后需谨慎使用,需注意残留毒性对果品安全存在的潜在风险。
先前研究表明,杜鹃内生枯草芽胞杆菌DJ-6菌株对多种植物病原菌有很好的颉颃活性,在大棚控制条件下,利用枯草芽胞杆菌(Bacillussubtilis) DJ-6菌株的制剂(BCA)防治草莓枯萎病害是一种有效的途径[4]。虽然,BCA对叶面病害有很好的防效,但推广到农户时则防治效果不稳定,制约了生防活菌制剂的推广。
生物和化学协同防治策略,在减少化学药剂施用量的同时又能提高生物防治的稳定性,但在国内运用细菌与化学药剂协同防治植物病害的研究报道不多[5-7]。随着农药化肥“两减”政策的实施,生物和化学协同防治方面的研究将成为新的热点。本文系统研究了BCA与PS的相容性、BCA单用和与化学杀菌剂联合使用对草莓炭疽病和白粉病的协同防控作用,以及协同使用增效的初步机理。
1 材料与方法
1.1 杀菌剂与培养基
供试杀菌剂。25 %吡唑醚菌酯SC(商品名凯润,巴斯夫欧洲公司生产,用PS表示),50 %多菌灵WP(江苏扬农化工集团有限公司生产,用MBC表示),80 %代森锰锌(美国陶氏益农化工有限公司,用MC表示)。
供试培养基。PDA培养基:用于植物病原指示菌的培养。R2A培养基:每1000 mL蒸馏水中含酵母粉0.5 g,酪蛋白胨0.25 g,肉蛋白胨0.25 g,水解酪蛋白0.5 g,葡萄糖0.5 g,淀粉0.5 g,丙酮酸钠0.3 g,磷酸氢二钾0.3 g,水合硫酸镁0.024 g,琼脂15 g,pH7.2,用于细菌的分离、纯化和发酵种子液的制备。FM培养液:20 L水中含豆粕100 g、马铃薯淀粉200 g、蔗糖25 g、酵母粉25 g、碳酸钙20 g、硫酸锰1.0 g,用于菌种上罐发酵。
1.2 生防菌剂的制备
1.2.1 菌液的获得 用无菌牙签挑取事先在R2A固体培养基上划线培养好的DJ-6菌株的单菌落斑,接种于装有5 mL R2A液体培养基的容积为20 mL的三角瓶中,于30 ℃、200 r/min条件下振荡培养16 h(一级种子培养液);将所得培养液5 mL全部接种于装有400 mL R2A培养液的容积为1000 mL的三角瓶中,200 r/min、30 ℃条件下振荡培养16 h(二级种子培养液);把所得的400 mL培养液接种于装有20 L FM培养液的容积为30 L的发酵罐(镇江东方GUS-30)中,设置发酵条件为:溶氧100 %,搅拌速度为350 r/min,发酵温度30 ℃,发酵时间36 h,自动酸碱流加控制在pH为7.0~7.2。
1.2.2 制剂的加工 将1.2.1中的上罐发酵液离心(8000 r/min)后用20 %丙三醇溶液(V/V)(溶液用无菌水配制)重新悬浮,测定悬浮液的活芽胞含量,根据测定结果用20 %丙三醇溶液(V/V)调节悬浮液的活芽胞数,调节芽胞终含量约为1.0×1010cfu/mL。在上述调节好的悬浮液中按5 g/L(W/V)的用量加入黄原胶,并搅拌均匀,得成品悬浮剂的浓度约为100亿活芽胞/mL(BCA),置4 ℃保存备用。
1.3 DJ-6菌株在不同浓度PS中的生长测定
250 mL三角瓶中加50 mL R2A培养液,设计成PS浓度分别为50、100、150、200和250 mg/L,设不加药剂(对照),每个浓度4瓶。每瓶中加入0.1 mL DJ-6二级种子培养液。置30 ℃,200 r/min振荡培养。每间隔6 h在610 nm波长下测定吸光度值,共测定到54 h。
1.4 田间试验
在田间验证BCA 和PS单用和/或联用对草莓炭疽病和白粉病的防治效果。试验随机区组设计4重复,小区面积20 m2。试验处理:C1: PS(500 mL/hm2); C2:BCA(2.5 L/hm2);C3:PS(250 mL/hm2)+ BCA(2.5 L/hm2);C4:MC (1 kg/hm2);C5:MBC(1 kg/hm2);C6:水喷雾。供试草莓品种为“红颊”(高感炭疽病和白粉病),于草莓移栽50 d始见病后喷雾,用水量为500 L/hm2,隔10 d防治第2次。于第2次防治时记录病原菌发病基数,第2次防治14 d后调查结果并计算防效。炭疽病严重度分级标准为:0级,叶片无病斑;1级,病斑直径<5 mm;2级,病斑直径6~10 mm;3级,病斑直径11~15 mm;4级,病斑直径>15 mm。白粉病的分级标准为:0级,叶片无白粉;1级,白粉面积占叶片总面积的1 %~10 %;2级,白粉面积占叶片总面积的11 %~15 %;3级,白粉面积占叶片总面积的16 %~25 %;4级,白粉面积占叶片总面积的26 %~50 %;5级,白粉面积占叶片总面积50 %以上。每小区随机记录20穴(5点取样),每穴取15个老叶(新出的叶片不记录)。病情指数按下列公式计算:病情指数=∑(各级叶片数×级值)/(调查总叶片数×最高病级)×100。
1.5 BCA在草莓叶围的定殖动态
利用DJ-6菌株对利复平的抗药性标记,检测BCA单用和与PS联用时在草莓植株上定殖动态。在施用后不同的间隔期0(接种1 h后)、1、2、3、4、5、6和7 d分别取草莓叶片。取样叶片浸渍于50 mL 0.1 M pH 7的磷酸缓冲液,180 r/min振荡30 min。系列稀释悬浮液,并涂于含100 mg/L利复平的R2A培养基中,3平板每浓度。置30 ℃培养箱,48 h后观察细菌菌落数。菌落数计算成log cfu/g。
1.6 BCA诱导防卫相关蛋白的测定
取50日龄的无病健苗移栽于装有无菌土盆钵中,2苗/钵。移栽30 d后,做如下处理:C1-PS (500 mL/hm2);C2-BCA (2.5 kg/hm2);C3-BCA+PS (2.5 kg/hm2+250 mL/hm2);C4-PS (250 mL/hm2);CK1-防治处理1 d后再接种炭疽病菌分生孢子悬浮液;CK2-未处理空白对照。每个处理4个重复,6钵/重复。温室相对湿度在80 %,白天温度26~28 ℃,晚上温度20~22 ℃,光暗比为12 h:12 h。接种分生孢子悬浮液的制备:用含1 %吐温20无菌水将事先在PDA培养基上长好的炭疽病菌分生孢子堆洗下,并充分振荡,实验中所用的分生孢子悬浮液浓度是2.56×105孢子/mL。
在接种后0(接种1 h后)、1、3、5、7和9 d取草莓叶片。每个重复取4个单株的叶片组织,取样叶片样品用事先预冷的研钵在液氮条件下研磨均匀,置-40 ℃冰箱中保存用于酶活测定。在4 ℃下取1 g叶片研磨样品加2 mL 0.1 M磷酸钠缓冲液(pH 7.0),在10 000 r/min条件下离心20 min,上清液当作粗酶提取液,过氧化物酶(PO)测定参Hammerschmidt等1982方法[8],β-1,3-葡聚糖酶参考Pan 等1991方法[9],多酚氧化酶(PPO)和苯丙胺酸解胺酶(PAL)测定参考Ross等1992方法[10]。
2 结果与分析
2.1 细菌与PS相容性
DJ-6菌株在含不同浓度的PS培养液中都能生长,即使在250 mg/L的浓度条件下也能生长。混浊度随着培养时间的延长而增大,在不同浓度PS之间生长量差异不显著,与不加药剂的空白对照相比,DJ-6菌株在含药剂的各浓度中生长均有下降但未达显著水平(图1)。
2.2 田间防治结果
BCA(2.5 kg/hm2)和PS(250 mL/hm2)联用对草莓白粉病和炭疽病的防治效果显著优于二者单用(表1)。BCA加PS联用时草莓炭疽病和白粉病的病指分别为2.31和1.98。单用PS和BCA对草莓炭疽病的病指分别为4.46和6.98,而对白粉病的病指分别为2.42和5.75。MC (1kg/hm2)单用对草莓炭疽病和白粉病的病指分别为12.41和10.74。MBC(1 kg/hm2)单用对草莓炭疽病和白粉病的病指分别为15.13和13.76。对照中炭疽病的病指从4.74上升到37.46,而白粉病的病指从2.74上升到23.47。与初始病指相比,BCA和PS单用或联用处理中无论是白粉病还是炭疽病的病指相对稳定,与空白对照病指相比,所有处理的病指都显著降低(表1)。
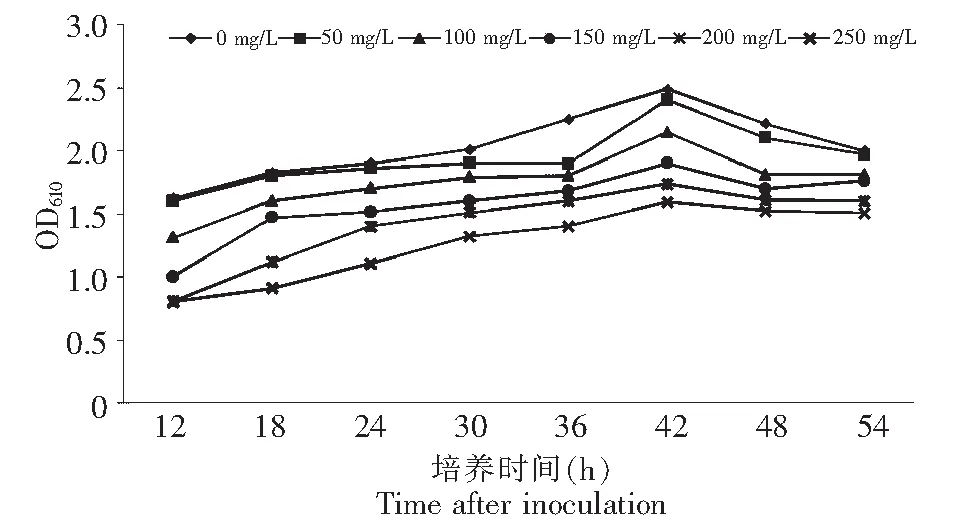
图1 DJ-6菌株在含不同浓度PS共培养时的生长动态Fig.1 Growth of Bacillus subtilis (DJ-6) in conjunction with different concentrations of PS
2.3 生防细菌在草莓叶面定殖动态
在田间草莓上施用7 d后,BCA单用时DJ-6菌株在草莓叶面上的数量分别从6.95降到2.57 (log cfu /g)。在同一取样时间段的检测结果中,BCA与PS联用时的细菌种群数量都高于单用。2个处理中细菌种群数量都随着时间的延长而显著下降(图2)。
2.4 防卫相关蛋白的诱导作用
BCA和PS单用和联用后用炭疽病菌分生孢子接种,对草莓植株防卫相关蛋白有诱导作用。两者联用后PO、PPO和PAL酶活性高于单用,相比之下对照当中防卫相关蛋白质的含量则较低。同样,在BCA加PS的处理中,抗病相关蛋白β-1,3-葡聚糖酶在炭疽病菌侵染后快速上升,而在健康的对照植株中则表达水平很低(图3)。上述相关蛋白质的积累都始发生在炭疽病菌分生孢子接种1 d后。在炭疽病菌分生孢子接种后第5天时防卫相关蛋白质上升到最高值,并且在整个9 d的取样时间里都保持在较高水平,在只接种病原菌而不用生防菌和PS的处理中,防卫相关蛋白在最初时段上升,但随后急剧下降(数据未列出)。
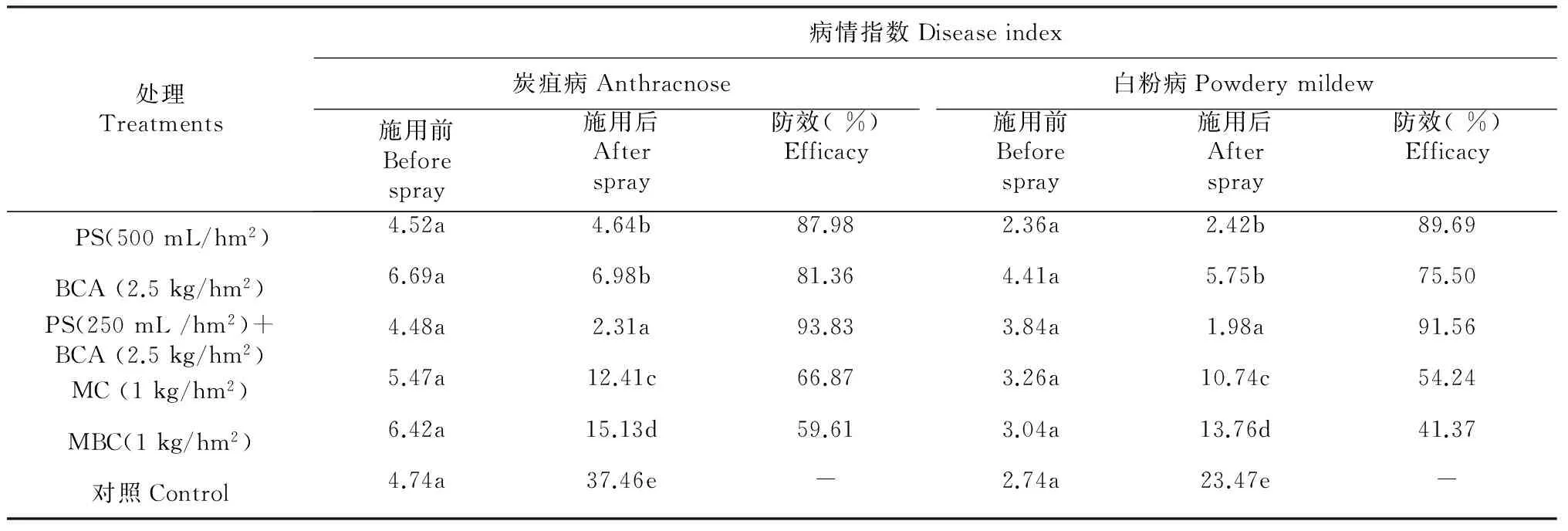
表1 PS和BCA对草莓炭疽病和白粉病的防效试验
注:*同列中相同字母表示处理间差异未达显著水平(P<0.05)。
Note:* In a column, means followed by a common letter are not significantly different at the 5 % level by DMRT.
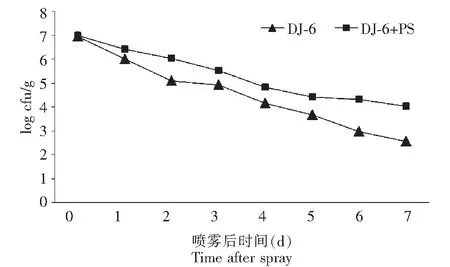
图2 DJ-6和PS混用后在草莓叶围的定殖动态Fig.2 Population of Bacillus subtilis (DJ-6) in the strawberry phylloplane as affected by addition of PS
3 讨 论
不同浓度PS对枯草芽胞杆菌DJ-6菌株的生长没有负面影响,即使在高浓度下(250 mg/L)下影响也很小,说明了在生产上由DJ-6菌株加工而成的制剂(BCA)可以和PS联用。PS不影响细菌生长的机理,可能是其抑制线粒体呼吸链细胞色素b到c的电子传递,而这一过程在枯草芽胞杆菌或别的细菌中不存在。
细菌生防制剂和杀菌剂联用,为化学杀菌剂的减量施用提供了一个很好的途径。细菌生防制剂和化学杀菌剂联用方面也有类似报道。Kataria等(2002)报道,嘧菌酯低用量与枯草芽胞杆菌联用处理种子,对立枯丝核菌(RhizoctoniasolaniKuhn)有很好的增效活性[11]。Sendhil Vel等(2004)报道,嘧菌酯在高浓度下也不影响枯草芽胞杆菌的生长[12]。Kishore 等(2005)报道PseudomonasaeruginosaGSE18和GSE19两菌株对百菌清(Chlorothalonil)的耐受浓度可高达2000 mg/L,与单用百菌清(2000 mg/L)相比,P.aeruginosaGSE18和百菌清(500 mg/L)联用,能有效的减少花生叶斑病,与未处理的对照相比,产量提高了2倍[13]。Kondoh等(2001)报道,用枯草芽胞杆菌 EPS 288菌株和Rb14-C菌株分别与减半的化学杀菌剂联用,分别防治对由Penicilliumexpansum引起的梨果病害和西红柿立枯病的防治效果比单用的高[14]。研究结果也表明,BCA和减半用量的PS对草莓病害的防治效果优于二者单用,这一发现对当前草莓病害绿色防控有重大指导作用。
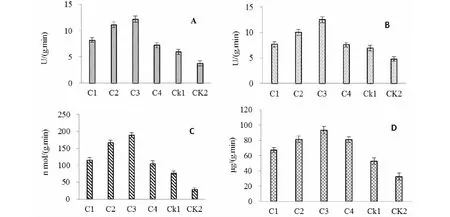
图A、图B、图C和图D分别指过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶和葡聚糖酶在不同处理下的活性。C1指PS (500 mL/hm2);C2指BCA (2.5 kg/hm2);C3指BCA+PS (2.5 kg/hm2 +250 mL/hm2);C4指PS (250 mL/hm2);CK1指接种炭疽病菌的对照;CK2指未处理对照Fig A, fig B, fig C and fig D represent for the activies of peroxidase, polyphenol oxidase, phenylalanine ammonia-lyase and β-1,3-Glucanase, respectively. C1, PS (500 mL/hm2); C2, BCA (2.5kg/hm2); C3, BCA(2.5kg/hm2) + PS (250 mL/hm2); C4, PS (250 mL/hm2); CK1, inoculated control; CK2, uninoculated control图3 用BCA和PS处理草莓植株后再用炭疽病菌挑战接种时防卫反应相关蛋白的表达(病原菌接种5d时检测)Fig.3 Induction of defense enzymes and PR-proteins in strawberry by application of PS and BCA against C.fragirae (5 days after pathogen inculation)
通过BCA和PS联用,能提高细菌在叶围的存活率。可能的原因是由于PS的存在抑制或减少了其它微生物的竞争,导致叶围上营养提供相对增加所至。相似的情况发生在P.aeruginosa与百菌清共用后提高了细菌在叶围的存活率[13]。
枯草芽胞杆菌控制植物病原菌的作用机制呈多样性,其主要通过微生境的营养和空间的竞争作用[15]、抗生作用[16]、噬铁素的产生作用和细胞溶解酶[17-18]。近年来发现,诱导抗性也是生防细菌重要的生防因子,通过提前施用生防制剂来诱导植物自身的防卫反应,抵抗病害的早期侵入,是当前植物病害综合治理的新策略。
施用BCA提高了草莓植株中防卫相关蛋白的活性,并延续至病原菌接种侵染后的第9天。通过BCA与PS联用增强了多种抗病相关酶的活性。在用BCA和PS联用的处理中,PAL活性的峰值出现在炭疽病菌接种后的第5天,并且在整个试验期间一直保持在较高水平,在单独接种病原菌的植物中,接种4d后酶活性则显著下降,同样用BCA加PS处理后草莓植株体内的PO和PPO活性显著上(数据未列出)。相似的报道有,Chen等(2000)用P.corrugate处理黄瓜根部后用Pythiumaphanidermatum挑战接种能检测到较高的PO和PPO活性[19]。Maurhofer等(1994)报道,用枯草芽胞杆菌引发的诱导抗性与几丁质和β-1,3-葡聚糖酶的积累相关[20]。本研究中BCA加PS联用处理草莓能诱导β-1,3-葡聚糖酶的增强。综合以上结果可以得出,BCA单用能诱发草莓产生系统性抗病性(ISR),能诱导草莓植株产生多基因抗性,从而有效的抑制多种致病病原菌的侵染。
有关BCA与PS联用后植株诱导抗性相关酶活性比BCA单用时高的协同作用的分子机理还需进行深入的研究。
[1]杨敬辉,陈宏州,肖 婷,等.葡萄炭疽病菌对多菌灵的抗药性检测[J].江西农业学报,2015,27(1):32-35.
[2]杨敬辉,陈宏州,肖 婷,等.14种杀菌剂对葡萄炭疽病菌的毒力测定[J]. 江苏农业科学,2014,42(12):163-166.
[3]汪建国,赵帅锋,徐云红,等.PS防治草莓、苦瓜及黄瓜炭疽病田间试验[J].中国园艺文摘,2014(5):56-58.
[4]JI, M X,YAO, K.B,LI, G P. Control effects ofBacillussubtilisDJ-6 and Pyraclostrobin alone and in combination againstFusariumoxysporum[J]. Agricultural Scence and Technology, 2014,15(11):2020-2025.
[5]刘永锋,陈志谊.拮抗细菌和化学农药协同防治植物病害中的增效分析[C].华东植物病理学术研讨会论文集,2003:174-177.
[6]韩 丽,常建民,张柏林,等.枯草芽孢杆菌 B26与化学药剂协同防治木材蓝变[J]. 东北林业大学学报,2013,41(4):126-130.
[7]刘邮洲,常有宏,王 宏,等.用枯草芽孢杆菌B-916与化学药剂协同作用防治梨黑斑病[J].园艺学报,2010,37(增刊):2070.
[8]Hammerschmidt R, Nuckles EM, Kuc J. Association of enhanced peroxidase activity with induced systemic resistance of cucumber toColletotrichumlagenarium[J]. Physiology and Plant Pathology, 1982,20: 73-82.
[9]Pan S Q, Ye X S, Kuc, J. Association of β-1,3 glucanase activity and isoform pattern with systemic resistance to blue mold in tobacco induced by stem injection withPeronosporatabacinaor leaf inoculation with tobacco mosaic virus[J]. Physiological and Molecular Plant Pathology, 1991,39:25-39.
[10]Ross, W W, Sederoff, R R. Phenylalanine ammonia-lyase from loblolly pine:purification of the enzyme and isolation of complementary DNA clone[J]. Plant Physiology, 1992, 98:380-386.
[11]Kataria, H R, Wilmsmeier, B, Buchenauer, H. Efficacy ofPseudomonasfluorescensstrains and some modern fungicides for control ofRhizoctoniasolaniAG-4 in bean and cucumber[J]. Journal of Plant Disease Protection, 2002, 109:384-400.
[12]Sendhil Vel V, Marimuthu T, Raguchander T. Compatibility of azoxystrobin SC with biocontrol agents[J]. Pestology, 2004, 28:61-64.
[13]Kishore G K, Pande S, Podile A R. Management of late leaf spot of groundnut with chlorothalonil-tolerant isolates ofPseudomonasaeruginosa[J]. Plant Pathology, 2005,54:401-408.
[14]Kondoh M, Hirai M, Shoda M. Integrated biological and chemical control of damping-off caused byRhizoctoniasolaniusingBacillussubtilisRB14-C and flutolanil[J]. Journal of Bioscience and Bioengineering, 2001, 91:173-177.
[15]Elad Y, Chet I. Possible role of competition for nutrient in biocontrol of Pythium damping-off by bacteria[J]. Phytopathology, 1987, 77:190-195.
[16]Howie W J, Suslow T V. Role of antibiotic biosynthesis in the inhibition ofPythiumultimumin cotton spermosphere and rhizosphere byPseudomonasfluorescens[J]. Molecular Plant-Microbe Interaction, 1991(4):393-399.
[17]Loper J E. Role of fluorescent siderophore production in biological control ofPythiumultimumby aPseudomonasfluorescens[J]. Phytopathology, 1988, 78:166-172.
[18]Frindlender M, Inbar J, Chet I. Biological control of soil-borne plant pathogens by a β-1, 3 glucanase producingPseudomonascepacia[J]. Soil Biology and Biochemistry, 1993, 25:1211-1221.
[19]Chen C, Belanger R R, Benhamou N. Defense enzymes inducedin cucumber roots by treatment with plant growth promoting rhizobacteria (PGPR) andPythiumaphanidermatum[J]. Physiological and Molecular Plant Pathology, 2000, 56:13-23.
[20]Maurhofer M, Hase C, Meuwly P. Induction of systemic resistance of tobacco to tobacco necrosis virus by the root-colonizingPseudomonasfluorescensstrain CHAO:influence of thegacA gene and of pyoverdine production[J]. Phytopathology, 1994, 84:139-146.
(责任编辑 李山云)
Integrated Control of Strawberry Disease Using Biocontrol AgentBacillussubtilisstrain DJ-6 and Pyraclostrobin
YAO Ke-bing, ZHANG Yu-jun, WANG Jing-gen, XU Yuan, YANG Jing-hui*
(Zhenjiang Agricultural Sciences, Hilly Region of Jiangsu, Jiangsu Jurong 212400,Chian)
A combined strategy of strawberry anthracnose and powdery mildew control consisting of reduced fungicide dose and biological control agent with antagonisticBacillussubtilisstrain DJ-6 (BCA)was evaluated. The sensitivity ofB.subtilisstrain DJ-6 to fungicide pyraclostrobin (PS) at different concentrations was tested by turbidometric method. The grown bacterium (DJ-6) was tolerant to all concentrations of PS. In field trials, BCA tested in combination with reduced concentration of PS was highly efficient in management of both diseases of strawberry. Biological control ofColletotrichumfragariaeandSphaerothecaaphaniswith BCA was effective but less than fungicide alone at the standard dose. However, combination of the BCA with a 50 % reduction of PS dose was as effective as the standard fungicide alone. Application of BCA along with PS significantly increased the survival of DJ-6 in the phylloplane of strawberry. Further, there were nearly ‘twofold’ increases in activities of peroxidase, polyphenol oxidase, phenylalanine ammonia lyase and β-1,3-glucanase, in plants treated with BCA plus PS.
Strawberry disease;Bacillussubtilisstrain DJ-6; Pyraclostrobin; Cooperative control
1001-4829(2016)10-2397-05
10.16213/j.cnki.scjas.2016.10.027
2015-12-07
江苏省农业科技自主创新基金[cx(13)3062];镇江市农业科技支撑(NY2013014,NY2015019);江苏省农业科技支撑(BE2013407,BE2015364)
姚克兵(1974-),男,江苏镇江人,硕士,高级农艺师,从事植病生防研究,E-mail:yjhnn32@126.com,*为通讯作者。
S668.4
A

