钛酸盐纳米管-聚苯胺-金纳米颗粒复合材料的制备及其生物电化学性能
朱 杰,霍小鹤,刘小强*,刘绣华,2
( 1.河南大学化学化工学院,河南开封475004; 2.河南大学河南省天然药物与免疫工程重点实验室,河南开封475004)
钛酸盐纳米管-聚苯胺-金纳米颗粒复合材料的制备及其生物电化学性能
朱杰1,霍小鹤1,刘小强1*,刘绣华1,2
( 1.河南大学化学化工学院,河南开封475004; 2.河南大学河南省天然药物与免疫工程重点实验室,河南开封475004)
摘要:采用水热法制备出钛酸盐纳米管( TNTs),然后使用氧化聚合法将苯胺聚合到TNTs表面生成聚苯胺( PANI),最终将金纳米粒子还原到PANI表面制备出三元复合纳米材料( TNTs-PANI-GNPs).其中PANI作为交联剂链接起TNTs和GNPs形成稳定和结合紧密的三元复合纳米材料,不同的光谱和显微图像技术证实了三元复合纳米材料的成功合成.我们将辣根过氧化物酶( HRP)与三元复合纳米材料充分混合均匀后涂抹于玻碳电极表面,伏安实验结果证明HRP已实现在TNTs-PANI和TNTs-PANI-GNPs修饰电极上的直接电子转移,而且后者相较于前者对过氧化氢的催化还原电流增强了大约74.9%.TNTs-PANI-GNPs复合纳米材料修饰的生物传感器的优越电化学性能主要归因于复合材料中TNTs、PANI和GNPs三者之间的协同作用,将优点最大化,将缺点最小化.
关键词:水热法;氧化聚合法;三元复合纳米材料;辣根过氧化物酶;电化学性能
氧化还原酶修饰电极在生物传感器、生物电子学和生物燃料电池方面具有良好的应用前景,因而近年来受到了广泛的关注和研究[1],在这些应用中酶与电极之间的电子转移行为是决定所制备酶器件性能的关键因素[2].由于电极材料和酶固定方法是影响酶与电极之间直接电子传递的重要因素[3],因此电极修饰材料的选择和制备也就决定了氧化还原酶修饰电极的性能.钛酸盐纳米管( TNT)由于其优异的生物相容性、高比表面积、强吸附性、化学惰性和多孔等优异性能而被广泛应用于构筑电化学生物传感器[4].但受限于其半导体特性,钛酸盐纳米管的导电性较差,不利于其在化学修饰电极和传感器的应用.因此,如何在保持钛酸盐纳米管各项优异性能的基础之上大幅提高其导电性是我们急需解决的科学问题之一.近几年来,贵金属,特别是金纳米颗粒( GNP),因其具有高导电性、生物亲和性和高比表面积等优点而被广泛应用于电化学生物传感器的制备中,尤其是金纳米颗粒能够促进氧化还原酶与电极之间的直接电子传递,这非常有助于改善酶生物传感器的分析性能.但金纳米颗粒极易团聚,必须与其他纳米材料结合生成复合纳米才能得以应用.例如,WANG等[8]利用化学还原法将金纳米颗粒种子修饰在二氧化钛纳米颗粒表面,并以此为电极修饰材料成功研制出辣根过氧化酶生物传感器,该传感器电催化还原H2O2的线性范围为4.1×10-5~6.3×10-4mol·L-1,检测限为5.9× 10-6mol·L-1.
有机高分子聚合材料-聚苯胺( PANI)由于拥有高电导性、导电性可调、强光催化性能和优良的环境与热稳定性而被应用于光伏器件[5]、气体传感器[6]和锂电池[7]等.但是聚苯胺也具有低机械强度、可塑性和生物相容性较差等缺点,导致其在电极表面的应用受到限制,因此聚苯胺需要与其他材料结合生成复合纳米材料来改进其性能,从而拓展其应用.据报道,聚苯胺分子非常有助于金纳米颗粒在聚苯胺纳米纤维上的沉积[16].其具体原理是:首先,高氯酸金阴离子( AuC)通过其表面负电荷与带有正电荷的质子化仲胺的静电相互作用吸附在盐酸掺杂的聚苯胺骨架上;然后,聚苯胺表面的AuC原位还原为金纳米粒子.
为了制备具有优良光电性能的复合纳米材料,并将其应用于电化学和光电化学传感器的制备,本文作者采用水热法合成钛酸盐纳米管为前体,利用氧化聚合法将苯胺聚合在钛酸盐纳米管表面,再利用化学还原法将金纳米颗粒沉积在聚苯胺表面从而制备出TNT-PANI-GNP复合纳米材料.同时,为了提高生物传感器的稳定性和增强辣根过氧化酶( HRP)与TNT-PTA-GNP之间的电子转移,本实验采用将HRP巯基化的方法使HRP通过-SH键与TNT-PTA-GNP结合的更紧密、牢固.最后,利用离子型聚合物Nafion和亲水性离子液体( Hydrophilic I-onic Liquids,HIL) : 1-癸基-3-甲基咪唑溴盐将巯基化的HRP和TNTs-PTA-GNP材料固定于玻碳电极表面,成功制备出TNT-PTA-GNP | HIL| Nafion | HRP电极,并应用于H2O2的催化降解.在复合材料中,聚苯胺不仅可以提高钛酸盐纳米管的导电性,而且可以促进金纳米颗粒在钛酸盐纳米管上的沉积,从而增强金纳米颗粒和钛酸盐纳米管之间的联系.因此,在钛酸盐纳米管-聚苯胺-金纳米颗粒复合物的合成中,聚苯胺作为交联剂,增强了三元复合物的稳定性和电化学性能.
1 实验部分
1.1试剂与仪器
二氧化钛纳米颗粒( P25,天津市化学试剂三厂) ; HAuCl4·3H2O,辣根过氧化酶( HRP),3-( 2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯( SPDP),二硫苏糖醇( DTT),二甲亚砜( DMSO)均购买于美国Sigma-aldrich公司;柠檬酸三钠(北京化工) ;硼氢化钠(国药集团化学试剂有限公司) ; 1-癸基-3-甲基咪唑四氟硼酸盐( [Demim]Br,中国上海成捷化学有限公司) ;以上试剂均为分析纯,实验用水均为去离子水.
Zeba脱盐离心柱(美国赛默飞世尔) ; AVATAR360型傅立叶红外光谱仪( FT-IR,美国尼高力公司) ; UV-4100型紫外可见分光光度计(日本日立公司) ; Tecnai G220型透射电子显微镜( TEM,美国菲达康公司) ; X-PertPro型X射线衍射仪( XRD,荷兰飞利浦公司) ; CHI630D型电化学分析仪(上海辰华仪器有限公司) ; IM6ex型电化学工作站(德国ZAHNER公司).
1.2 TNT-PANI-GNP复合纳米材料的制备
首先,称取0.450 0 g多晶型TiO2纳米颗粒,置于含有120 mL 10 mol·L-1的NaOH溶液的高压反应釜里,充分搅拌均匀,密封,将高压反应釜放进烘箱内,保持120℃反应48 h;自然冷却至室温,将反应釜内的溶液移至烧杯中,依次用0.1 mol·L-1的HCl、去离子水清洗至中性,离心分离,再用去离子水洗至无Cl-;离心,在真空干燥箱内60℃干燥,所得固体即为钛酸盐纳米管( TNTs).
然后,称取上述制备的0.280 0 g TNTs加入10 mL 0.1 mol·L-1的HCl溶液中超声30 min,加入4.5 mL的0.1 mol·L-1的苯胺HCl溶液,在0~5℃温度下逐滴滴加共4.5 mL的0.1 mol·L-1的过硫酸铵HCl溶液于上述混合溶液中,反应3 h,静置一夜,离心,洗涤.在真空干燥箱内60℃干燥,所得固体即为钛酸盐纳米管-聚苯胺( TNTs-PANI).
接着,称取上述制备的15 mg TNT-PANI复合物并置于15 mL的去离子水中,超声30 min;再依次称取0.004 0 g HAuCl4·3H2O和0.002 0 g柠檬酸钠加入到2 mL的去离子水中,将此混合液加入到上述的TNT-PANI悬浊液中;然后,边搅拌边快速地加入1 mL 2 g·L-1的NaBH4溶液,将此混合液在室温下温和搅拌超过20 min;离心,洗涤,在60℃下真空干燥,得到金纳米颗粒修饰的钛酸盐纳米管-聚苯胺,即三元复合纳米材料TNT-PANI-GNP.
1.3 HRP巯基化
首先,称取1 mg SPDP溶于160 μL的DMSO中,得到20 mmol·L-1的SPDP溶液;依次量取12.5 μL 20 mmol·L-1SPDP,称取1 mg HRP溶加入500 μL的PBS-EDTA溶液中( pH = 7.5,PBS浓度为20 mmol·L-1,EDTA浓度为1 mmol·L-1),在室温下反应30~60 min;两个脱盐柱在2 500 r/min的转速下离心5 min,以除去柱子中储存液,再用醋酸钠缓冲溶液清洗2~3次以平衡两柱子,然后将上述SPDP与HRP反应液过柱子,以除去反应副产物和过量的SPDP;接下来,称取0.005 4 g DTT溶于200 μL的醋酸钠缓冲溶液中,得到175 mmol·L-1的DTT溶液;将得到的DTT溶液与500 μL的SPDP处理过的HRP溶液混合,反应30 min,反应得到巯基化的HRP;最后,利用PBS-EDTA溶液进行溶液交换2~3次,将巯基化HRP溶液过柱子,以除去反应副产物及过量的DTT,脱盐,收集,得到纯化的巯基化HRP.
1.4修饰电极的制备
首先,将玻碳电极依次用0.3和1.0 μm的Al2O3粉末在抛光布上抛光,然后分别用无水乙醇和去离子水超声清洗,清洗过的电极在室温下晾干,备用;接下来,分别取300 μL 1.5 g·L-1的HRP溶液和50 μL Nafion加入到30 mg HIL与复合纳米材料TNTs-PTA-GNP的混合物中(质量比为1∶2),在恒温振荡器(空气浴)中保持2℃振荡4 h;最后,取4 μL混合液滴于玻碳电极表面,在冰箱中4℃晾干备用,从而得到巯基化HRP修饰电极.本实验中的所有修饰电极都运用类似方法制备而成.
1.5电化学性能测试
本实验的电化学测试均使用三电极体系(修饰电极为工作电极,铂柱电极为对电极,Ag/AgCl ( 3.0 molL-1KCl)电极为参比电极)在CHI630D型的电化学工作站上进行.电化学测试前,反应池首先通氮气15 min;测试中,在反应池上方保持N2饱和的条件.循环伏安实验中的扫描速率为50 mV·s-1,底液为0.05 mol·L-1pH=7.0的PBS.
2 结果与讨论
2.1样品的TEM表征
图1( a),( b)和( c)分别是样品TNTs,TNT-PANI 和TNT-PANI-GNP的TEM图.由图1( a)可以看到,我们已使用水热法成功合成出钛酸盐纳米管,并且管径均匀,平均直径约为8~10 nm,长度大概为几百纳米;经过苯胺氧化聚合反应,在图1( b)中可以清楚地看到钛酸盐纳米管被半透明的无定型聚苯胺包覆,在图1( a)中原本分散的纳米管也粘附在一起,这证明了聚苯胺的成功生成;最终,我们利用化学还原法将金纳米颗粒沉积到TNT-PANI二元复合物表面,从图1( c)可以清晰的看到,金纳米颗粒较为均匀的分散在钛酸盐纳米管-聚苯胺表面,团聚较少,金纳米颗粒的直径约为6~8 nm,大小较为均匀,同以往将金纳米颗粒直接沉积在钛酸盐纳米管上的方法相比,聚苯胺作为交联剂的方法更有利于金纳米的沉积,金纳米颗粒的沉积密度更大一些.

图1 样品的TEM图Fig.1 TEM images of the as-prepared samples
2.2样品的FT-IR分析
图2a、b、c、d分别是TNTs,PANI,TNT-PANI和TNT-PANI-GNP composite的FT-IR光谱图.从图2中可以看到,4条红外谱线在3 000~3 700 cm-1之间的吸收带均为吸附在各种材料表面的-OH基团的伸缩振动峰;另外,在谱线a中,介于400~700 cm-1范围内的峰归属于TNTs的Ti-O-Ti吸收峰[9],这是钛酸盐纳米材料的特征红外吸收峰,一般情况下二氧化钛或钛酸盐材料的红外谱图均有此峰存在.而在谱线b中,中心峰位置约为1 242 cm-1的吸收带归属于聚苯胺中的C-N+•伸缩振动;而峰位置约为1 299,1 126和797 cm-1的吸收带分别对应于二芳氨基的C-N伸缩,N=Q=N( Q代表醌环)伸缩振动以及C-H的面外弯曲振动;此外,1 561 cm-1和1 474 cm-1峰分别归属于醌环和苯环的伸缩振动.以上所有的特征峰均归属于高导电性的苯胺绿型聚苯胺[10],它们的出现证实了谱线b为苯胺绿型聚苯胺的红外吸收谱图.更为重要的是,我们可以看到谱线c包含了谱图a和b所有的特征峰,这表明我们已成功合成出TNT-PANI二元复合物;值得注意的是,生成二元复合物之后,谱图b中纯聚苯胺在1 561、1 474、1 299和1 242 cm-1的峰分别红移到了1 574、1 490、1 305和1 249 cm-1处,这很可能是由于聚苯胺氨基氮原子与钛酸盐氧或钛原子之间强相互作用所引起的;通过化学还原法将金纳米颗粒沉积到TNT-PANI二元复合物上面之后,我们观察到谱线d相对于c,-OH的伸缩振动峰偏移了29 cm-1,这可以归因于金纳米颗粒与钛酸盐表面-OH强相互作用所引起[11].

图2 样品的FT-IR图谱Fig.2 FT-IR spectra of the as-prepared samples
2.3样品的XRD分析
图3a、b和c分别为纳米材料TNTs,TNT-PANI 和TNT-PANI-GNP的XRD图.从谱线a中可以看出,钛酸盐纳米管在大约9.6°、24.7°、28.3°、48.9°和61.8°出现特征衍射峰,分别对应于其( 200)、( 110)、( 600)、( 020)和( 002)晶面,可据此判断钛酸盐纳米管为正交晶型[12].谱线b为TNT-PANI二元复合物的XRD图,图中除了钛酸盐纳米管的几个特征峰外,还可观察到15.1°,20.5°衍射峰分别对应于聚苯胺的( 010)和( 100)晶面.最重要的是,谱线c中除了出现前述钛酸盐纳米管和聚苯胺的特征峰外,还在38.6°,44.8°,64.9°和77.8°存在明显衍射峰,据文献报道分别对应于金纳米颗粒的( 110)、( 200)、( 220)和( 311)晶面[13].因此,从XRD图可以得出结论,金纳米颗粒已成功的沉积在TNTPANI复合物表面,三元复合物TNT-PANI-GNP已合成出来.
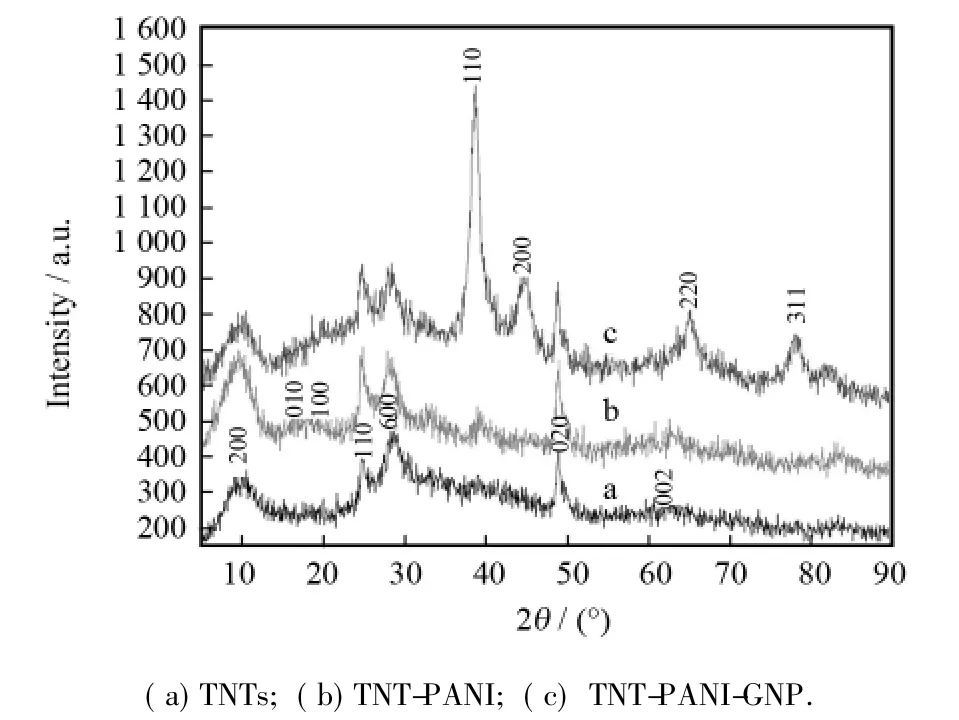
图3 样品的XRD图Fig.3 XRD spectra of the as-prepared samples
2.4复合纳米材料的生物电化学性能研究
我们合成纳米复合材料的最终目的是以TNTPANI和TNT-PANI-GNP作为氧化还原酶的载体构建电化学或光电化学生物传感器.因此本实验将一种常见氧化还原酶HRP与复合材料充分均匀混合后修饰于玻碳电极表面制备出酶修饰电极,然后利用循环伏安法对制备的修饰电极进行电化学性能研究,从而判断所合成材料是否适合于制备生物传感器.如图4所示,曲线a为TNT-PANI-GNP|HIL|Nafion|GCE电极在0.05 molL-1PBS缓冲溶液中( pH= 7.0)的循环伏安图.可以看到,该修饰电极在电位-0.45~0.15 V范围内没有出现任何氧化还原峰,说明该材料没有电化学活性,故不会产生电化学干扰; 而TNT-PANI | HIL | Nafion | HRP | GCE(曲线b)与TNT-PANI-GNP|HIL| Nafion| HRP | GCE(曲线c)在相同实验条件下均出现了明显的电化学还原峰,这表明了电极表面修饰体系中的HRP自身发生了电子转移;此外,曲线c的还原电流明显强于曲线b的,这表明了三元复合材料中的GNP起到了一定的催化作用,提高了复合材料的导电能力,增强了HRP与电极之间的直接电子传递,再加上复合材料给HRP提供了良好的生物微环境,使其能够显现出较好的电生物活性.因此,可以得出结论: TNT-PANI 和TNT-PANI-GNP复合物均适合构建生物修饰电极,而氧化还原酶在后者当中有更好的直接电子传递行为.
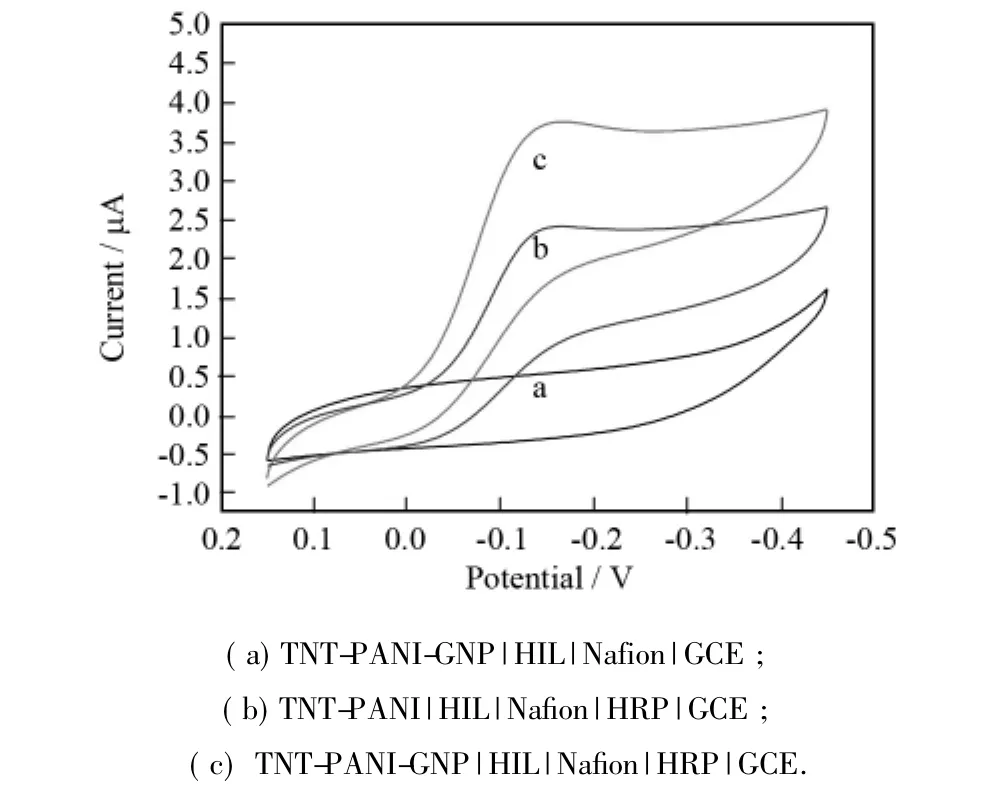
图4 纳米材料修饰电极的循环伏安描述Fig.4 Cyclic voltammetric characterization of different nano-material modified electrodes
3 结论
首先采用水热法合成出TNTs,然后利用氧化聚合法将苯胺聚合在TNTs表面生成TNT-PANI二元复合物,最终使用化学还原法将金纳米颗粒沉积在TNT-PANI表面合成出三元复合物TNT-PANI-GNP,并通过TEM、XRD、FT-IR等分析手段对其进行了表征.结果证明3种成份TNTs、PANI和GNPS紧密结合在一起,成功生成三元复合物.我们又以TNT-PANI 和TNT-PANI-GNP为电极修饰材料分别制备了HRP酶电化学传感器,并利用循环伏安法对其进行生物电化学性能研究.结果表明,TNT-PANI-GNP复合纳米材料结合了PANI和GNPs的良好导电性,以及TNTs 和GNPs良好的生物相容性,改善了它们各自的缺点,提高了材料的性能,促进了氧化还原酶HRP与电极之间的直接电子交换.因此,该材料在电化学生物传感器及生物电极材料制备中具有较好的应用价值.
参考文献:
[1]ZAFAR M N,TASCA F,GORTON L,et al.Tryptophan repressor-binding proteins from escherichia coli and archaeoglobus fulgidus as new catalysts for 1,4-dihydronicotinamide adenine dinucleotide-dependent amperometric biosensors and biofuel cells [J].Anal Chem,2009,81( 10) : 4082-4088.
[2]SI P,DING S J,YUAN J,et al.Hierarchically structured one-dimensional TiO2for protein immobilization direct electrochemistry and mediator-free glucose sensing [J ].ACS Nano,2011,5( 9) : 7617-7626.
[3]HOLLAND J T,LAU C,BROZIK S,et al.Engineering of glucose oxidase for direct electron transfer via site-specific gold nanoparticle conjugation [J ].J Am Chem Soc,2011,133 ( 48) : 19262-19265.
[4]ZHANG Z J,XIE Y B,LIU Z,et al.Covalently immobilized biosensor based on gold nanoparticles modified TiO2nanotube arrays [J].Electroanal Chem,2011,650( 2) : 241 -247.
[5]MENDE L S,BACH U,BAKER R H,et al.Organic dye for highly efficient solid-state dye-sensitized solar cells [J].Adv Mater,2005,17( 7) : 813-815.
[6]PAWAR S G,CHOUGULE M A,PATIL S L,et al.Room temperature ammonia gas sensor based on polyaniline-TiO2nanocomposite [J].Sensors Journal IEEE,2011,11( 12) : 3417-3423.
[7]LAI C,YUAN X C,CAO X L,et al.Enhanced high-rate capability of the C-N-doped TiO2as anode material for lithiumion battery [J ].Electrochemical and Solid-State Letters,2012,15( 5) : A65-A67.
[8]WANG Y,MA X L,WEN Y,et al.Direct electrochemistry and bioelectrocatalysis of horseradish peroxidase based on gold nano-seeds dotted TiO2nanocomposite [J].Biosensors and Bioelectronics,2010,25( 11) : 2442-2446.
[9]KARIM M R,YEUM J H,LEE M S,et al.Preparation of conducting polyaniline/TiO2composite submicron-rods by the gammaradiolysis oxidative polymerization method [J].Reactive and Functional Polymers,2008,68( 9) : 1371-1376.
[10]KARIM M R,LIM K T,LEE M S,et al.Sulfonated polyaniline-titanium dioxide nanocomposites synthesized by one-pot UV-curable polymerization method [J ].Synthetic Metals,2009,159( 3) : 209-213.
[11]XU J Z,ZHAO W B,ZHU J J,et al.Fabricating gold nanoparticle-oxide nanotube composite materials by a self-assembly method [J].Colloid Interface Sci,2005,290( 2) : 450-454.
[12]YANG J J,JIN Z S,WAND X D,et al.Study on composition,structure and formation process of nanotube Na2Ti2O4( OH)2[J].Dalton Trans,2003 ( 20) : 3898-3901.
[13]PARAMASIVAM I,MACAK J M,SCHMUKI P.Photocatalytic activity of TiO2nanotube layers loaded with Ag and Au nanoparticles [J].Electrochem Commun,2008,10( 1) : 71 -75.
[责任编辑:吴文鹏]
Preparation of titanate nanotubes-polyaniline-gold nanoparticle composite and its bioelectrochemistry study
ZHU Jie1,HUO Xiaohe1,LIU Xiaoqiang1*,LIU Xiuhua1,2
( 1.College of Chemistry and Chemical Engineering,Henan University,Kaifeng 475004,Henan,China;
2.Key Laboratory of Natural Medicine and Immunology of Henan Province,Henan University,Kaifeng 475004,Henan,China)
Abstract:A ternary composite consisting of titanate nanotubes ( TNTs),polyaniline ( PANI) and gold nanoparticles ( GNPs) was prepared for the first time and applied for the fabrication of a biosensor using horseradish peroxidase ( HRP) as model enzyme.TNTs were initially synthesized from TiO2nanoparticles using a hydrothermal method.Aniline was then polymerized on TNTs through an oxidation polymerization method.The GNPs were eventually deposited on PANI to form a ternary composite,in which PANI served as a cross linker between TNTs and GNPs to strengthen their contact.Different spectroscopic and microscopic techniques have confirmed the successful formation of the ternary composite.The ternary composite was then used for the immobilization of horseradish peroxidase ( HRP) on electrode surface.The voltammetric results demonstrated that the direct electron transfer of HRP had been achieved at both TNTs-PANI and TNTs-PANI-GNPs modified electrodes and the catalytic reduction current at the later towards H2O2has enhanced~74.9% compared to that at the former.The excellent electrochemical performance of the modified electrode can be ascribed to the superior synergistic properties of TNTs,PANI and GNPs.
Keywords:hydrothermal method; oxidation polymerization method; ternary composite; horseradish peroxidase; electrochemical performance
作者简介:朱杰( 1989-),男,硕士生,主要从事新型复合纳米材料光电化学生物传感器的研究.*通讯联系人,E-mail: 13781157777@ 163.com.
基金项目:中国博士后科学基金会资助项目( 2012M511569)
收稿日期:2015-08-31.
中图分类号:O632.3
文献标志码:A
文章编号:1008-1011( 2016) 01-0107-05

