我国非小细胞肺癌随机对照试验方法学与伦理学报告质量评价
,, ,,,,3
2010年,我国肿瘤登记中心的数据显示,我国肺癌的发病率约为0.46% (男性为0.62%,女性为0.30%),每年新发病超过600 000例(男性416 333例,女性189 613例)[1]。经分析发现,非小细胞肺癌(Non-small-cell Lung Cancer,NSCLC)是肺癌最常见的类型,占总数的80%-85%[2]。NSCLC的诊治一直是国内外关注的重要研究课题。
为了更客观地评价相关干预措施的疗效和获得最高级别的证据,国内研究人员及临床工作者长期以来设计并开展了大量NSCLC随机对照试验(Randomized controlled trials,RCT)。其中,设计严谨的RCT一般被看作评价临床疗效的金标准。然而,多数RCT为了达到科学的目的和标准,把患者/受试者看作一个群体,使其服从研究设计中的某些硬性诊疗程序,往往容易忽略或放弃对患者进行个性化处理的原则。因此,此类研究似乎面临着严峻的伦理学挑战[3]。国外相关研究表明,现有的RCT方法学和伦理学报告质量存在许多缺陷,伦理委员会的批准和受试者知情同意的报告常常不完整或者被忽视[4-10]。
目前国内尚无RCT伦理学报告质量评价的相关研究。国外有关伦理学报告与方法学质量相关[7,10]的论点不仅早已为人们接受,而且由法国研究者Berdeu等制定的Berdeu量表因其简短、可靠及有效而被广泛推荐使用[11-12],可以作为评价RCT伦理学质量的一种方法。本文采用Berdeu量表[11]和Jadad量表[13],调查我国中文发表RCT的伦理学和方法学报告质量,并探讨二者之间的关联性。
1 资料与方法
1.1 文献来源
计算机检索中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普数据库(VIP)和万方数据库,检索时限均从建库截至2013年6月30日,语种限定为中文,纳入病例为经病理学和组织学确诊的NSCLC,以及研究类型为RCT的中文文献。
1.2 文献筛选与资料提取
将检索获得的文献导入EndNote X6软件去重后,由2名研究人员严格按照纳入排除标准浏览题目和摘要,对符合纳入标准的文献进一步调阅全文,以确定是否最终纳入。在文献筛选过程中,如遇分歧则咨询第3位研究人员。
由4名研究人员根据Berdeu量表和Jadad量表独立提取数据,每个条目均按照试验符合程度评价为“完整报告”(记1分)、“部分报告”(记0.5分)和“未报告”(记0分)。内容包括基本资料、Jadad量表、Berdeu量表。基本资料包括作者、作者数量、发表年代、发表杂志、研究机构、是否有循证医学/统计学家/流行病学家参与、是否有基金资助、是否有利益冲突报告等,Jadad量表[13]包括为是否随机、是否采用盲法、是否描述失访和退出病例、是否明确研究目的、是否明确地定义结局指标、是否明确地描述病例纳入排除标准、样本量评估是否正确、是否明确描述干预措施、是否至少有一个对照组、是否明确描述毒副作用的评估标准、是否明确描述统计分析方法,Berdeu量表[11]包括是否获取了患者知情同意书、是否被伦理委员会批准、是否评估风险收益率、是否尊重先验原则、是否描述拒绝知情同意、安慰剂伦理使用是否正当、受试者选择是否公平、是否有中期数据分析计划、是否预先制定试验中止原则、是否有独立监察委员会的参与、是否有侵入性的诊断方法、是否有侵入性的疗效评估。
1.3 统计学处理
数据录入Excel 2013软件后,计数资料以频数和百分比呈现,计量资料以平均数和范围表示。Jadad共包括11个条目,满分11分,以8分为界,大于等于8分的研究被评价为高方法学质量,低于8分的被评为低方法学质量。采用X2检验分析方法学质量与伦理学报告质量的关联(高方法学质量 versus 低方法学质量),效应量为优势比(Odds Ratio,OR),并计算其95%可信区间(Confidence Interval,CI)。OR值小于1代表方法学条目的报告与伦理学报告质量负相关,OR值大于1代表方法学条目报告与伦理学报告质量正相关。
2 结果
2.1 检索及纳入研究的一般情况
检索共获得10 421篇文献,最终纳入3 065篇。第1篇NSCLC的RCT发表于1985年,此后呈递增趋势,2000年以后的发文量增长迅速(图1)。纳入的文献中,平均作者数为3.68(1-29)个,合作机构平均数为1.25(1-21)个,仅16.77% 的(514篇)文献被中国科学引文数据库(Chinese Science Citation Database,CSCD)收录,0.36%的文献(11篇)有循证医学/统计学家/流行病学家参与,13.15% 的(403篇)报告了基金赞助,0.13%(4篇)的报告了利益冲突,4.67%(143篇)的作者单位同时包含医院和研究所(或大学)。

图1纳入文献发表年代趋势
2.2 方法学质量评价
根据Jadad量表,对纳入的3 065篇文献逐篇进行评价(表1),完整报告率大于90%的条目有:条目1(2 909篇,占94.9%)、条目4(2 770篇,占90.4%)和条目5(2 760篇,占90%),完整报告率不足50%的条目有:条目2(28篇,占0.9%)、条目3(341篇,占11.1%)、条目6(1 394篇,占45.5%)和条目7(538篇,占17.6%)。
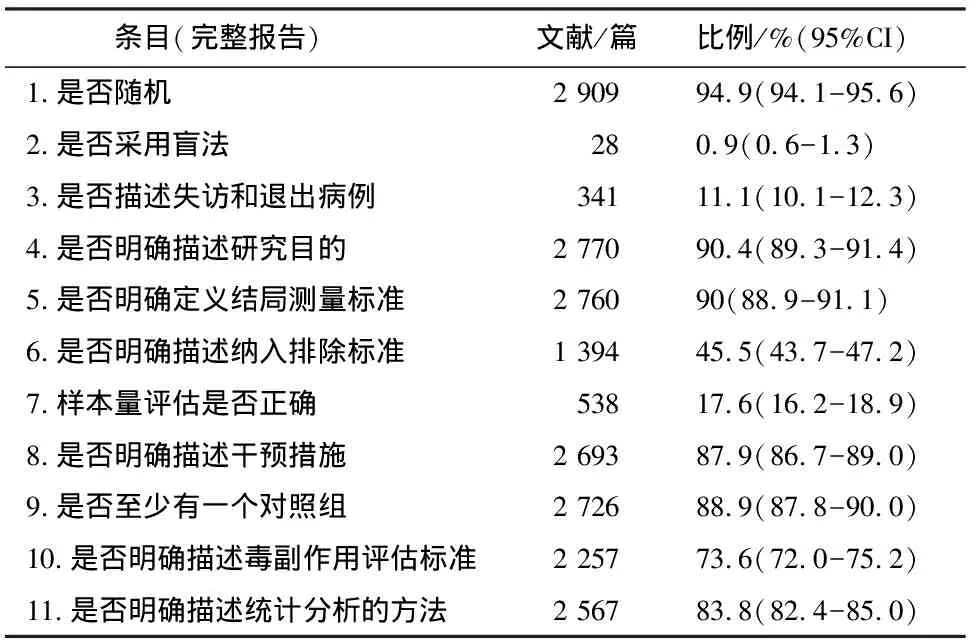
表1 Jadad量表各条目评价结果
2.3 伦理学质量评价
根据Berdeu量表,对纳入的3 065篇文献逐篇进行评价(表2),结果显示各条目完整报告率均小于50%。完整报告率不足10%的条目有:条目2(153篇,占5%)、条目3(167篇,占5.4%)、条目5(245篇,占8%)、条目6(108篇,占3.5%)、条目9(46篇,占1.5%)和条目10(18篇,占0.6%)。
2.4 方法学与伦理学质量关联性分析
从图2可以看出,方法学评价条目“侵入性疗效评估”(OR=1.064,95%CI:0.832-1.361,P>0.05)与伦理学质量关联性较小;其余条目的方法学质量越高,其伦理学报告质量也相对较高,两者之间存在正相关性。

表2 Berdeu量表各条目评价结果

图2 方法学与伦理学质量关联性分析
3 讨论
中文发表的NSCLC领域RCT论文数量呈逐年递增,然而其方法学质量有待提高,半数以上纳入RCT的伦理学报告存在严重缺陷。高方法学质量的RCT在伦理学的报告方面有所改善。
中文发表NSCLC的RCT存在较大的伦理报告偏倚风险,研究者在保证研究科学性的同时,未能使受试者权利受到良好保障。此外,方法学质量高的研究,其伦理学质量也较高,说明方法学质量是伦理学质量的首要前提[7],合理的方法学应用对提高RCT伦理学质量具有重要意义。
我国最新药物临床试验质量管理规范(Good Clinical Practice,GCP)规定,药品临床试验在确保科学性和可靠性的同时,必须对受试者的安全和权益给予充分的保障。其中,伦理委员会(Ethic Committee)与知情同意(Informed Consent)是保障受试者权益的两项主要措施[14]。本文所涉及的相关试验中,仅有5%的RCTs得到了伦理委员会的批准,这表明研究者在资格审查、试验方案设计、受试者入选、受试者风险-获益评估等方面的意识还需进一步加强。此外,数据与安全监察委员会(Data and Safety Monitoring Boards,DSMB)原本是一个由申办者建立,以专业人士为主要成员的独立建议组织,对伦理审查委员会(institutional review board,IRB)起到监督作用[15]。然而,本文条目10的完整报告率仅为0.6%,说明绝大多数试验无法提供IRB受监督的情况,使其伦理风险进一步增加。同样,本文中条目1的完整报告率仅为26.4%,表明我国知情同意的实施仍有待进一步落实。
临床试验是唯一在人体内研究药品有效性和安全性的手段,不可避免地给参加试验的受试者带来风险[16],因此对患者受益风险的评价显得十分重要。以2013年4月发表的一项研究为例[17],该研究对53例肝功能Child-Pugh分级中的A级及B级患者进行手术方法研究发现,两类患者中肝切除与肝移植术后累积生存率和无瘤生存率比较均无统计学意义,后者不仅不能比前者更多地改善这两类患者的预后,并且其术后移植物抗宿主病是一种病死率极高的并发症[18]。再如,在2013年发表的一项关于不同剂量吉非替尼治疗晚期非小细胞肺癌患者的研究中[19],研究人员对纳入的1 848例患者进行分析发现,多应用1倍剂量时并不能提高患者生存率,反而增加了不良反应,说明临床试验既要促进新药物、新仪器与新治疗方法早日应用于临床,又要确保受试者获得最大的收益[15]。然而,在本文所纳入的RCT中,“风险受益率评价”的完整报告率仅仅为5.4%,说明纳入的大部分RCT并不能向后续研究提供该干预措施对患者的受益情况,反而大大增加了伦理风险。
此外,医学领域的相关利益冲突中,临床治疗与由制药公司资助的生物医学研究相关的利益冲突非常值得关注。医院是药厂、制药公司与患者之间的缓冲机构,可以起到遏制前者无止境向患者攫取财富的作用。许多临床RCT是在医院中进行的,因此也应受到医院所起缓冲作用的保护。目前研究表明,纳入试验中报告利益冲突的RCT仅有0.13%,报告基金赞助的RCT有13.15%。加拿大研究人员Roseman等[20]对主要医学期刊和综述数据库收录的RCT的研究经费和作者的利益冲突进行的调查表明,纳入的509篇RCT中,62.5%报告了资助来源,远高于我国的13.15%。
4 结语
本文存在以下局限性。首先,本文基于Berdeu量表和Jadad量表评价发表的RCT报告情况,可能存在纳入RCT中研究质量高但报告存在缺陷的问题。其次,本文未对作者模糊或错误报告条目的研究进行深入调查,以帮助评价试验质量。第三,本文发现部分文献报告了相关的方法学条目,却使用了错误的方法。例如,研究中提及按就诊顺序,将受试者随机分入治疗组和对照组,显然研究者使用了错误的随机分配方法。因此,为了进一步了解我国中文发表的RCT方法学和伦理报告质量,今后的研究者应采用电话咨询、信访、问卷调查等方式深入调查论文中条目报告情况是否属实,从而增加RCT质量评价的可靠性。

