镇肝熄风汤对帕金森病肝阳上亢证大鼠中脑Akt和GSK-3β磷酸化的影响*
王晓丽,孙 影,朱兰芹,綦艳秋,张丽华,张红宇,董妙先**
(1.齐齐哈尔医学院药学院 齐齐哈尔 161006;2. 齐齐哈尔医学院卫生所 齐齐哈尔 161006)
镇肝熄风汤对帕金森病肝阳上亢证大鼠中脑Akt和GSK-3β磷酸化的影响*
王晓丽1,孙 影2,朱兰芹2,綦艳秋2,张丽华2,张红宇2,董妙先2**
(1.齐齐哈尔医学院药学院 齐齐哈尔 161006;2. 齐齐哈尔医学院卫生所 齐齐哈尔 161006)
目的:本研究主要观察镇肝熄风汤对帕金森病肝阳上亢证大鼠中脑Akt及其下游靶分子GSK-3β磷酸化的影响。方法:105只大鼠随机分为对照组、假手术组、模型组、镇肝熄风汤高、中、低剂量组和司来吉兰组。采用6-OHDA中脑微量注射合并附子汤灌胃制备帕金森病肝阳上亢证模型,采用分光光度法检测中脑组织caspase-3活性,Western blot检测脑组织Akt和GSK-3β磷酸化水平。结果:与假手术组比较,帕金森病肝阳上亢证大鼠中脑caspase-3活性明显增强,Akt和GSK-3β磷酸化水平明显升高,而镇肝熄风汤组中脑caspase-3活性明显减弱,Akt和GSK-3β磷酸化水平明显升高。结论:镇肝熄风汤能够减弱帕金森病肝阳上亢证大鼠中脑caspase-3活性,其机制可能与Akt活化和GSK-3β失活有关。
肝阳上亢证 镇肝熄风汤 帕金森病 半胱天冬酶3 糖原合成酶激酶-3β
帕金森病(Parkinson’s Disease,PD)是一种常见的中枢神经系统退行性疾病,特征性病理表现为黑质纹状体多巴胺神经元凋亡[1]。左旋多巴制剂是目前国际治疗PD最有效的补充治疗措施[2],但是长期服用会出现不良反应和疗效递减;左旋多巴制剂虽能缓解症状但不能阻止其病理进程[3]。中药复方多组分和多靶点调节作用,符合PD的多因素和多途径发病以及症状的复杂性和进展性等特点及其治疗需求[4]。近期国际研究提示中医药治疗PD具有良好的前景[5],在中医辨证论治理论指导下,临床应用镇肝熄风汤治疗PD肝阳上亢证取得良好效果[6],但机制尚不完全清楚。本研究在既往工作基础上,探讨镇肝熄风汤对PD肝阳上亢证大鼠中脑神经元凋亡(以caspase-3活性为指标)及蛋白激酶B(Protein Kinase B,PKB/Akt)和糖原合成激酶-3β(GlycogenSynthase Kinase-3β,GSK-3β)磷酸化的影响,为镇肝熄风汤治疗PD提供实验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级雄性Wistar大鼠,体质量220-240 g,维通利华(北京)实验动物科技有限公司提供,许可证号:SCXK(京)2012-0001。鼠颗粒饲料饲养,自由饮食。
1.1.2 药物
附子汤由单味制附子组成,附子(黄冈金贵中药产业发展有限公司,批号:D4120201)。盐酸司来吉兰片(成都蓉药集团四川长威制药有限公司,批号:20130902)。镇肝熄风汤由怀牛膝30 g、代赭石30 g、生龙骨15 g、生牡蛎15 g、生龟板15 g、生白芍15 g、元参15 g、天冬15 g、川楝子6 g、生麦芽6 g、茵陈6 g和甘草4.5 g组成(哈尔滨市盛泰中药饮片加工厂:批号分别为:130501、30301、130501、140301、140701、130401、130601、13110、140301、130501、130201、130601),水煎2次后合并煎液,过滤浓缩(含生药3.0 g·mL-1)。6-羟基多巴胺(美国Santa Cruz公司,批号:#D2312)。
1.1.3 试剂
碧波caspase-3活性分光度法检测试剂盒(南京碧波生物科技有限公司,批号:BA30100),细胞浆蛋白与核蛋白抽提试剂盒(上海碧云天生物技术有限公司,批号:P0028),ECL显影液(美国Thermo公司,批号:PH203837),p-GSK-3β抗体(美国Cell Signaling Technology公司,批号:0005),p-Akt抗体(美国Santa Cruz公司,批号:C0164),山羊抗小鼠 IgG HRP-conjugated和山羊抗兔IgG HRP-conjugated(北京康为世纪生物科技公司,批号:00051405、00081403)。
1.1.4 仪器
电泳槽(北京君意东方电泳设备有限公司,型号:JY-ZY2和JY-CZ1),Image Analysis System(北京赛智创业科技有限公司,型号:Smart Chemi™),超纯水系统(美国波尔公司,型号:PURELAB PLUS),Eppendorf Centrifuge离心机(德国Eppendorf公司,型号:5417R),移液器(美国RAININ公司,型号:L-1000),分析天平(瑞士METTLER TOLEDO公司,型号:XPE504),Thermo超低温冰箱(美国Thermo公司,型号:88000),微量进样器(上海高鸽工贸有限公司),全自动酶标仪(美国BioTek公司,型号:ELX800)。
1.2 方法
1.2.1 动物分组、造模及给药
Wistar大鼠随机分为7组:对照组、假手术组、模型组、镇肝熄风汤高、中、低剂量组(32、16、8 g·kg-1)和司来吉兰组,每组15只。微量注射6-羟基多巴胺(6-Hydroxydopamine,6-OHDA)单侧损毁大鼠黑质,建立PD模型;在此基础上,联合附子汤(生药2 g·kg-1)连续灌胃4周建立PD肝阳上亢病证结合模型。微量注射步骤为:1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉和常规消毒,固定于立体定向仪,沿正中线切开大鼠颅顶皮肤,剥离骨膜,暴露前后囟;将前囟确定为0,按下列坐标将2 μL 6-OHDA(溶于含0.2%抗坏血酸的生理盐水中,浓度为4 μg·μL-1)注射至右侧黑质致密部,即前囟后5.2 mm,正中线右侧1.8 mm,硬膜下7.6 mm,假手术组注射2 μL生理盐水(含0.2%抗坏血酸)。模型制备结束后,对照组和模型组(每日蒸馏水10 mL·kg-1),司来吉兰组(每日0.9 mg·kg-1)、镇肝熄风汤低剂量组(每日8 g·kg-1)、镇肝熄风汤中剂量组(每日16 g·kg-1)、镇肝熄风汤高剂量组(每日32 g·kg-1)大鼠连续灌胃用药28天。
1.2.2 分光光度法检测caspase-3活性
中脑组织剪碎,加入冰冷裂解液,匀浆、离心、取上清,按照碧波caspase-3活性分光光度法检测试剂盒说明书检测。
1.2.3 Western blot法检测大鼠磷酸化Akt和GSK-3β水平
取大鼠中脑黑质部位组织,蛋白提取试剂盒抽提组织浆蛋白,蛋白经10% SDS-PAGE分离,转移至PVDF膜上。5%脱脂奶粉室温封闭2 h后,加入抗p-Akt(1:500)或抗p-GSK-3β(1:1 000),4℃孵育过夜。TBST洗涤后加入辣根过氧化酶标记的二抗,室温孵育2 h。TBST洗涤,将ECL显影溶液加于膜上,用X线胶片曝光,磷酸化水平采用Alpha Ease FC图像分析软件进行分析。
1.2.5 统计学方法
采用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间差异采用单因素方差分析,两两比较用SNK检验。P<0.05为差异有统计学意义。
2 结果
2.1 镇肝熄风汤抑制PD肝阳上亢证模型大鼠中脑caspase-3活性
分光光度法检测caspase-3活性结果显示,与假手术组比较,PD肝阳上亢证模型组大鼠中脑caspase-3活性明显增加(P<0.05),而镇肝熄风汤高、中、低剂量组和司来吉兰组中脑caspase-3活性明显降低(P<0.05)。与司来吉兰组比较,镇肝熄风汤高、中、低剂量组中脑caspase-3活性明显降低(P<0.05)。镇肝熄风汤对PD肝阳上亢证模型大鼠中脑caspase-3活性影响见图1。
2.2 镇肝熄风汤促进PD肝阳上亢证模型大鼠中脑Akt磷酸化
Western blot结果显示,与假手术组相比,模型组大鼠中脑磷酸化Akt水平升高(P<0.05)。与模型组相比,镇肝熄风汤低、中、高剂量组大鼠中脑磷酸化Akt明显增加(P<0.05),司来吉兰组大鼠中脑磷酸化Akt水平未见明显变化(P>0.05)。镇肝熄风汤对PD肝阳上亢证模型大鼠中脑Akt磷酸化水平的影响详见图2。
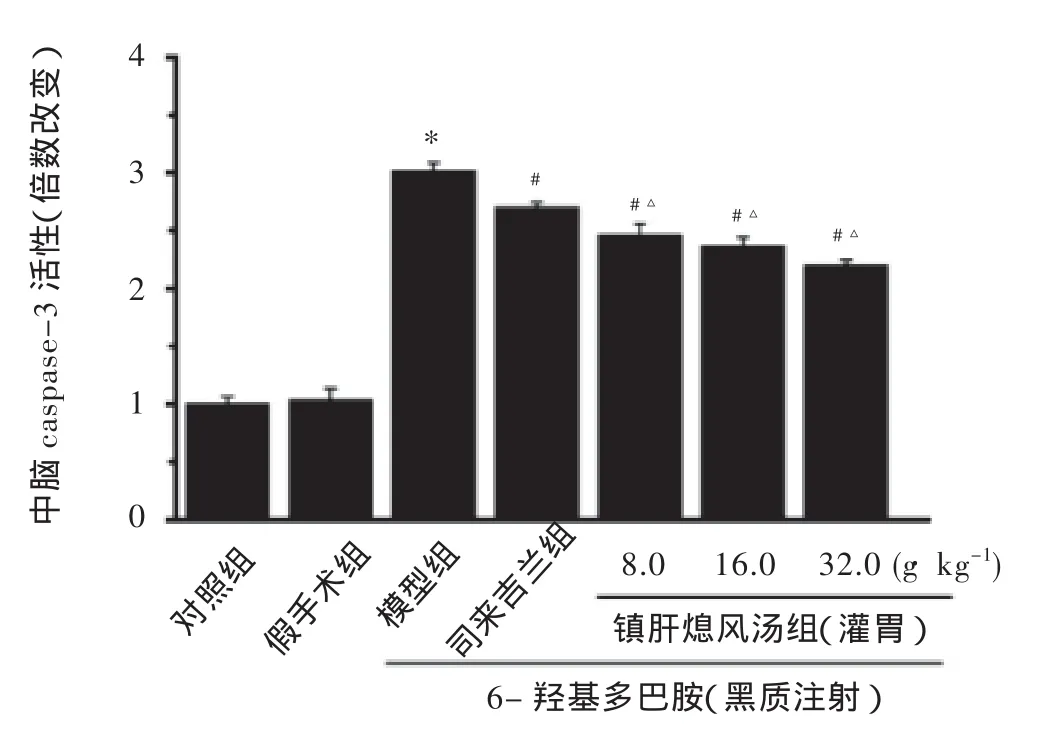
图1 镇肝熄风汤对各组大鼠中脑组织caspase-3活性的影响
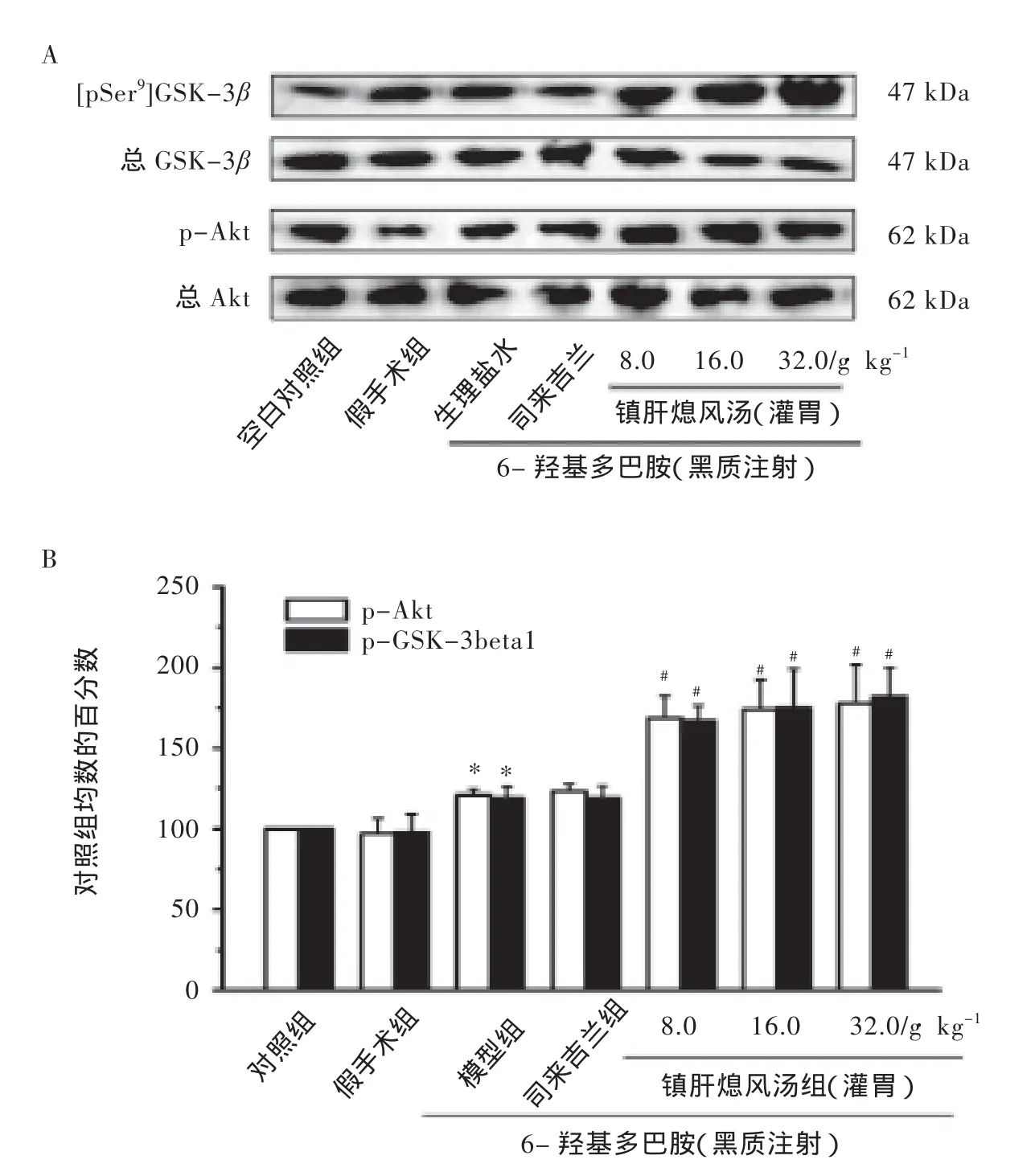
图2 镇肝熄风汤对PD肝阳上亢证大鼠中脑Akt和GSK-3β磷酸化水平的影响
2.3 镇肝熄风汤促进PD肝阳上亢证模型大鼠中脑GSK-3β(Ser9)的磷酸化
Western blot结果显示,与假手术组相比,PD肝阳上亢证模型组大鼠中脑组织p-GSK-3β(Ser9)水平明显升高(P<0.05)。与模型组相比,镇肝熄风汤低、中、高剂量组大鼠中脑p-GSK-3β(Ser9)明显增加(P<0.05)。与模型组相比,司来吉兰组大鼠中脑p-GSK-3β(Ser9)水平未见明显变化(P>0.05)。镇肝熄风汤对PD肝阳上亢证模型大鼠中脑GSK-3β磷酸化水平的影响详见图2。
3 讨论
证候是中医治疗的核心,是中药复方干预的对象。病证结合动物模型兼顾现代医学疾病的病理特点和中医证候特征,在证候生物学基础未阐明的情况下,是中药复方药效和药理研究的重要工具[7]。6-OHDA单侧损毁PD模型是目前PD研究最常用的模型,与人类PD的病理、生化改变相似[8]。附子为辛、甘、大热之品,灼伤肝肾之阴而发生肝阳上亢[9]。灌服附子汤联合6-OHDA单侧损毁的方法,从病和证两方面综合模拟PD肝阳上亢证模型,与单纯PD模型和单纯肝阳上亢证候模型相比,在研究镇肝熄风汤治疗PD的药效评价方面更具特色和优势。本研究发现PD肝阳上亢证大鼠更易激惹,结膜充血的发生率也明显增加。大鼠经阿朴吗啡诱导后,PD肝阳上亢证大鼠出现旋转行为,但正常大鼠未出现旋转行为,表明PD肝阳上亢证大鼠模型制备成功,详细研究结果另文报道。
引起PD临床病理症状的直接原因是黑质纹状体通路中的多巴胺(Dopamine,DA)含量大幅减少。黑质和纹状体多巴胺能神经元进行性变性是导致多巴胺含量显著降低的主要原因[10]。近年来,国内外研究表明,细胞凋亡速度加快或异常是PD病理进程的重要环节[11]。如果对引起DA能神经元凋亡的一系列链式事件中关键靶点进行干预,就有可能阻止DA能神经元的缺失。因此,抗细胞凋亡策略是PD神经保护性治疗的新途径。本实验结果表明,外源性神经毒素6-OHDA单侧损毁黑质联合灌胃附子汤显著增加了大鼠中脑caspase-3活性,说明细胞凋亡可能是PD肝阳上亢证大鼠的中脑DA能神经递质减少的原因之一,在PD肝阳上亢证发病过程中发挥了重要作用。镇肝熄风汤能显著抑制了PD肝阳上亢证大鼠中脑caspase-3活性,缓解外源性神经毒素联合附子汤灌胃所致的中脑神经元凋亡的发生。
Akt是一种丝氨酸/苏氨酸蛋白激酶,在细胞增殖、分化和抑制细胞凋亡方面起到重要作用。研究表明,Akt蛋白参与了多种神经系统疾病的发生,如脑缺血和PD等[12]。在PD患者的黑质Akt磷酸化水平显著下降,多种神经营养因子和神经保护剂通过活化Akt激酶抑制黑质神经元凋亡,发挥抗PD作用[13]。本实验发现在外源性神经毒素6-OHDA合并附子汤灌胃诱导的PD肝阳上亢证大鼠模型中,中脑磷酸化Akt水平升高,这与PD患者脑内检测到的磷酸化Akt耗竭的研究结果不一致,这种矛盾的结果需要进一步研究。而镇肝熄风汤显著增加了PD肝阳上亢证大鼠中脑磷酸化Akt水平,从而保护了6-OHDA单侧损毁黑质合并附子汤灌胃诱导的中脑神经元凋亡。
GSK-3β也参与调节了神经元凋亡,最近研究表明,GSK-3β与PD发生密切相关[14]。1-甲基-4-苯基-1,2,3,6-四氢吡啶注射诱导的PD模型小鼠DA能神经元中GSK-3β(Ser9)磷酸化水平降低,即GSK-3β活性增强,诱导了DA能神经元凋亡[15]。Gong等研究发现,6-OHDA通过抑制Akt活性激活GSK-3β,进而诱导神经细胞凋亡[16],抑制GSK-3β活性,即促进GSK-3β磷酸化可以对6-OHDA诱导的神经元损伤发挥保护作用。本研究发现6-OHDA单侧损毁黑质联合附子汤灌胃可使大鼠中脑GSK-3β活性降低,镇肝熄风汤进一步抑制了PD肝阳上亢证大鼠中脑GSK-3β活性。值得指出的是,6-OHDA诱导了caspase-3活化,同时6-OHDA又促进了具有抗凋亡作用的Akt和p-GSK-3β磷酸化水平的升高,这种似乎矛盾的结果与Santra等研究结果相似[17]。这一现象的原因可能是6-OHDA诱导神经元凋亡,而DA能神经元为了抵抗这种损伤,促使机体代偿性地提高了Akt磷酸化和GSK-3β(Ser9)磷酸化水平,以缓解6-OHDA诱导细胞凋亡。在6-OHDA单侧损毁黑质合并附子汤灌胃诱导PD肝阳上亢证模型中,镇肝熄风汤介导的caspase-3活化与Akt磷酸化和GSK-3β(Ser9)磷酸化之间的关系,需要在GSK-3β基因敲除小鼠和野生型小鼠上做进一步的对比研究[18]。
综上所述,镇肝熄风汤对PD肝阳上亢证大鼠中脑神经元凋亡具有抑制作用,其机制可能通过活化Akt(磷酸化)和失活GSK-3β(磷酸化),达到缓解PD肝阳上亢证的作用。这表明镇肝熄风汤在治疗PD方面具有较大的应用潜力,但其分子机制仍需进一步深入研究。
1 王述菊,马骏,刘芳,等.电针对帕金森病模型大鼠纹状体Glu浓度、GS和PAG表达的影响.世界科学技术-中医药现代化, 2015, 17(10): 2079-2082.
2 Günaydın Z Y, Özer F F, Karagöz A, et al. Evaluation of cardiovascular risk in patients with Parkinson disease under levodopa treatment. J Geriatr Cardiol, 2016, 13(1): 75-80.
3 Potts L F, Park E S, Woo J M, et al. Dual κ-agonist/μ-antagonist opioid receptor modulation reduces levodopa-induced dyskinesia and corrects dysregulated striatal changes in the nonhuman primate model of Parkinson disease. Ann Neurol, 2015, 77(6): 930-941.
4 梁建庆,何建成.中药复方治疗帕金森病的实验研究进展.中华中医药学刊, 2015, 33(3): 558-563.
5 Pan W, Kwak S, Liu Y, et al. Traditional chinese medicine improves activities of daily living in Parkinson’s disease. Parkinsons Dis, 2011, 2011: 789506.
6 谭文澜,张永全,陆晖.镇肝熄风汤治疗肝肾阴虚型帕金森病的临床研究.湖北中医药大学学报, 2012, 14(3): 52-53.
7 彭岳,韦燕飞,赵铁建,等.复合多因素法对血瘀型肝纤维化大鼠模型的建立和评价.世界科学技术-中医药现代化, 2016, 18(1): 141-149.
8 曲亮,王元,王强,等. 6-OHDA诱导大鼠多巴胺神经元选择性缺失的研究.中华神经外科疾病研究杂志, 2013, 12(6): 523-526.
9 毛禹康,苏洁贞,刘明平,等.川芎-天麻不同剂量配比对大鼠肝阳上亢型偏头痛的药效学差异研究.中药药理与临床, 2015, 31(4): 157-160.
10 Dragicevic E, Schiemann J, Liss B. Dopamine midbrain neurons in health and Parkinson’s disease: Emerging roles of voltage-gated calcium channels and ATP-sensitive potassium channels. Neuroscience, 2015, 284: 798-814.
11 孙玉芝,雒晓东,赵贝贝,等.帕病2号方对帕金森病模型大鼠黑质神经元形态学的影响.世界科学技术-中医药现代化, 2014, 16(10): 2131-2136.
12 Cohen M M Jr. The AKT genes and their roles in various disorders. Am J Med Genet A, 2013, 161(12): 2931-2937.
13 Zhao Y, Zhang Q, Xi J, et al. Neuroprotective effect of fasudil on inflammation through PI3K/Akt and Wnt/β-catenin dependent pathways in a mice model of Parkinson’s disease. Int J Clin Exp Pathol, 2015, 8(3): 2354-2364.
14 Golpich M, Amini E, Hemmati F, et al. Glycogen synthase kinase-3 beta (GSK-3β) signaling: Implications for Parkinson’s disease. Pharmacol Res, 2015, 97: 16-26.
15 Zhao Y F, Zhang Q, Xi J Y, et al. Multitarget intervention of Fasudil in the neuroprotection of dopaminergic neurons in MPTP-mouse model of Parkinson’s disease. J Neurol Sci, 2015, 353(1-2): 28-37.
16 Gong L, Zhang Q L, Zhang N, et al. Neuroprotection by urate on 6-OHDA-lesioned rat model of Parkinson’s disease: Linking to Akt/ GSK3β signaling pathway. J Neurochem, 2012, 123(5): 876-885.
17 Santra S, Xu L, Shah M, et al. D-512 and D-440 as novel multifunctional dopamine agonists: Characterization of neuroprotection properties and evaluation of in vivo efficacy in a Parkinson's disease animal model. ACS Chem Neurosci, 2013, 4(10): 1382-1392.
18 Mohamed R M, Morimoto S, Ibrahim I A, et al. GSK-3rimoto S, Ibrahim I's diseacardioprotective in a knockin mouse model of familial dilated cardiomyopathy. Am J Physiol Heart Circ Physiol. 2016, 310(11): 1808-1815.
Effects of Zhengan Xifeng Decoction on the Phosphorylation of Akt and GSK-3β in the Midbrain in Rats with Parkinson’s Disease and the Syndrome of Liver-Yang Hyperactivity
Wang Xiaoli1, Sun Ying2, Zhu Lanqin2, Qi Yanqiu2, Zhang Lihua2, Zhang Hongyu2, Dong Miaoxian2
(1. Department of Traditional Chinese Medicine, Qiqihar Medical Univeristy, Qiqihar 161006, China;
2. Health Center, Qiqihar Medical Univeristy, Qiqihar 161006, China)
The aim of this study was to investigate the effects of Zhengan Xifeng decoction (ZGXFD) on the phosphorylation of Akt and its downstream target molecule GSK-3β in the midbrain of Parkinson’s disease (PD) rats with the syndrome of liver-yang hyperactivity. A total of 105 pathogen-free male Wistar rats were randomly divided into seven groups∶ the control group, the sham-operated group, the model group, the ZGXFD high-, medium- and low-dose groups and the selegiline group. Microinjection of 6-OHDA into substantia nigra and the intragastric administration of Fuzi decoction were given to establish the rat model of Parkinson’s disease with syndrome of liver-yang hyperactivity. The activity of caspase-3 was detected using spectrophotometry. The phosphorylation of Akt and GSK-3β in the midbrain was analyzed by western blot. It was found that the activity of caspase-3 in the midbrain was enhanced while the phosphorylation of Akt and GSK-3β was increased in the PD rats of the model group compared with the sham-operated group. The activity of caspase-3 in the midbrain was inhibited and the phosphorylation of Akt and GSK-3β was up-regulated in the ZGXFD groups. In conclusion, it was demonstrated that the anti-apoptotic effects of ZGXFD may activate the Akt and suppress of the activity of GSK-3β in the midbrain of PD rats with the syndrome of liver-yang hyperactivity.
Syndrome of liver-yang hyperactivity, Zhengan Xifeng decoction, Parkinson's disease, caspase-3, glycogen synthase kinase 3β
10.11842/wst.2016.08.022
R2-031
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-04-14
修回日期:2016-05-20
* 国家自然科学基金委面上项目(81373629):基于PI3K/Akt/GSK-3β信号通路的镇肝熄风法抑制帕金森病氧化应激损伤的机制研究,负责人:董妙先。
** 通讯作者:董妙先,主任医师,主要研究方向:中药药理学研究。

