不同粒径的Fe3O4磁粉对纳米磁性高分子微珠的性能影响
黄波(黑龙江省科学院高技术研究院,哈尔滨150023)
不同粒径的Fe3O4磁粉对纳米磁性高分子微珠的性能影响
黄波
(黑龙江省科学院高技术研究院,哈尔滨150023)
摘要:采用化学共沉淀法来制备Fe3O4磁粉,控制反应条件得到不同粒径的Fe3O4磁粉。采用Fe3O4磁粉表面修饰、二次包覆和功能团嫁接技术,来制备磁性高分子微珠。运用红外光谱(FT-IR)、透射电子显微镜(TEM)、振动样品磁强计(VSM )等分析手段,对磁性高分子微珠的组成成分、形貌、粒径及磁学性能进行表征。试验结果表明:粒径为13nm的Fe3O4磁粉是纳米磁性高分子微珠理想的磁核选择。
关键词:磁性高分子微珠;表面修饰与包覆;功能团嫁接
1 引言
纳米磁性高分子微球是将磁性粒子和有机高分子复合而成的一种新型功能材料,在生物化学和生物医学中有广泛的应用[1-3],尤其是在细胞分离、靶向药物、微生物固定、免疫检测及化学工程等领域有诱人的应用前景。纳米磁性高分子微珠作为近年发展起来的一种新型磁性材料,不但具有纳米效应,即表面效应、小尺寸效应、宏观量子隧道效应和体积效应,还具有磁学性质,如超顺磁性与高磁化率等特性[4-6]。其应用已经从传统的技术领域发展到高新技术领域,从单纯的磁学范围扩展到与磁学相关的交叉学科领域,并以核酸分离领域应用最为广泛[7-12]。
纳米磁性高分子微珠简称纳米磁珠,是由磁性材料与高分子材料通过化学或物理方法复合而成的一种具有众多优异性能的功能材料。磁性材料主要有铁酸盐、铁磁矿、纯铁粉、Fe3O4等,高分子材料有天然高分子材料及合成高分子材料两种,天然高分子材料有淀粉、明胶、纤维素、壳聚糖等,合成高分子材料有聚苯乙烯、聚苯乙烯醇、消化纤维等。磁性微珠可以通过磁珠表面改性或者功能团嫁接等方式将功能团(-OH、-COOH、-NH2等)引入磁性微珠表面,进而得到具有功能化的磁性微珠。
本研究着重介绍在纳米磁珠制备过程中,不同粒径的Fe3O4磁粉对纳米磁性高分子微珠物化性能的影响。
2 试验
2.1试验材料与仪器
FeC13·6H2O,FeSO4·7H2O,无水乙醇,NaOH,C18H33O2Na,NH3·H20,丙酮,甲苯,甲醇,正硅酸乙酯,柠檬酸,亚氨基二乙酸,环氧丙基丙氧基硅烷,均为分析纯试剂。试验用水均为二次蒸馏水。
恒温水浴锅,真空干燥箱,漩涡振荡器,磁分离架,扫描电子显微镜(S-4800),振动样品磁强计(VSM9600-1)红外光谱仪,FTr-IR 8400S。
2.2纳米Fe3O4的制备
将0.5mol/L的FeSO4溶液和0.5mol/L的FeC13溶液按1∶2体积比加入到三颈瓶中,高速搅拌,搅拌速度为400 r·min,同时通入N2,并缓慢升温至40℃,持续搅拌20min。然后迅速将2mol/L的NaOH溶液加入混合液中,调节混合液pH值,使其达到11,缓慢升温至80℃,持续反应10min后,缓慢滴加2mLC18H33O2Na,调节溶液pH至8,80℃恒温反应60min。将反应温度降至室温后放在一块强磁铁上,静置10min后将上部清液倾出。用二次蒸馏水、甲醇、乙醇清洗数次,直到反应液显中性。过滤,将所得磁粉放置在真空干燥烘箱中,温度控制在30℃,干燥12h,得到纳米Fe3O4粉体。
2.3纳米Fe3O4的表面高分子包覆
称取0.5mol/L的柠檬酸溶液于三颈瓶中,加入5gFe3O4,用NH3·H2O调节溶液的pH值至5.5,在N2保护下磁力搅拌2h。磁性分离除去上清液,用丙酮洗2次,然后加入100mL蒸馏水超声分散30min。再加入分散介质乙醇-水体,以及一定量的NH3·H2O,缓慢滴加一定量的正硅酸乙酯,升温至80℃,强力搅拌下反应8h,得到Fe3O4/SiO2纳米磁性微珠。并用二次蒸馏水、无水乙醇反复洗涤,把得到的产品放入真空干燥箱中干燥24h,以备下一步试验使用。
2.4Fe3O4/SiO2纳米磁性微珠的表面羟化修饰
第一,磁性SiO2微珠的硅羟基化。将上一步所制备的Fe3O4/SiO2微珠(4.0g)加入体积比为5∶1乙醇-水溶液(192.0mL)中,分别加入浓氨水(4.0mL)和TEOS (1.2mL),于室温振荡反应3h。产物经布氏漏斗减压抽滤后,用去离子水洗涤至中性,以乙醇、丙酮洗涤,并于真空60℃下放置过夜,得到表面活化的磁性微珠。
第二,将1.66gNaOH溶于30mL去离子水中,随后加入2.66g亚氨基二乙酸使其溶解。所得亚氨基二乙酸钠溶液在60℃下真空加热除去其中大部分水分。于剩余溶液中加入大量甲醇溶液,使得亚氨基二乙酸钠盐析出,过滤收集。60℃下真空烘干。将表面活化的磁性微珠(1.0g)与亚氨基二乙酸钠(0.2g)先后加于甲醇(20mL)中,搅拌下反应48h。磁性微珠产物以甲醇、水处理以除去过量的亚氨基二乙酸钠后,浸泡于pH值为3的稀HCl中。30min后,用去离子水洗涤产物至中性,再以甲醇、丙酮各洗涤一遍,过滤收集、烘干得到表面包覆亚氨基二乙酸的磁性微珠。图1为核-壳复合结构纳米粒子形成过程示意图。

图1 核-壳复合结构纳米粒子形成过程Fig.1 Nano particles formation of core-shell composite structure
3 结果与讨论
3.1不同粒径的纳米Fe3O4的性能比较分析
控制反应条件我们制备了粒径7~46nm的3种Fe3O4磁粉,通过对其颗粒形貌和磁滞回线对不同粒径纳米Fe3O4的性能进行对比分析。图2为不同粒径的磁性Fe3O4纳米粒子TEM照片,图3为不同粒径Fe3O4纳米粒子磁滞回线对比图。

图2 不同粒径的磁性Fe3O4纳米粒子TEM照片Fig.2 Fe3O4magnetic nano particles TEM photograph in different particles

图3 不同粒径Fe3O4纳米粒子磁滞回线对比Fig.3 Fe3O4magnetic nano particles hysteresis comparison in different particles
从图2中我们可以看出,粒径为13nm的Fe3O4磁粉,其粒径均匀,而其他粒径的Fe3O4磁粉粒径分布不均,且发生团聚现象,从而影响Fe3O4磁粉在下一步包覆过程中出现大量团聚物,进而影响磁珠的包覆效果和功能团嫁接效果,以及在核酸提取过程中的分散混合效果。
从图3中我们可以看出,粒径为13nm的Fe3O4磁粉,其磁滞回线较其他粒径的都要大,7.5nmFe3O4磁粉由于其自身粒径小,其磁饱和强度σ最小。而粒径为46nm的Fe3O4磁粉,在测量体积时Fe3O4磁粉数量较少,进而造成磁饱和强度σ随着粒径的增加,其磁饱和强度σ反而变小的现象。同时,其磁滞回线没有通过0点,磁矫顽力不为0,这就说明当磁场为0时,粒径为46nm的Fe3O4磁粉在磁场消失时还有剩磁,不具备超顺磁性,进而会影响磁珠的性能。
因此,可以看出10~20nm的Fe3O4磁粉,具有较高的磁饱和强度和良好的超顺磁性,是磁珠制备中比较好的选择。
3.2Fe3O4磁粉与磁性微珠的红外光谱对比
以粒径为13nm的Fe3O4磁粉为核制备的磁珠为例,对磁珠进行红外光谱分析。图4为Fe3O4磁粉与高分子微珠红外分析对比图。
从图4中对比可知,高分子磁珠在1 295~1 050cm-1处有Si-C、Si-O伸缩振动峰,在578cm处有Fe-O键的吸收带,说明纳米Fe3O4表面接上了Y-甲基丙烯酰氧丙基三甲氧基硅烷。Fe3O4/PS复合微球的红外谱中,3 400cm-1、3 080cm-1处是不饱和C-H的伸缩振动峰,2 950cm-1处为-CH3、-CH2伸缩振动峰,在1 738cm-1处有强烈而尖锐的吸收峰,是羰基C=O伸缩振动,在1 250cm-1、l 176cm-1处出现C-O-C伸缩振动特征吸收峰,说明产物中有酯基的存在,3 440.7cm-1处一个弱的-OH伸缩振动峰则进一步说明有羧基的存在。这就说明,磁粉表面已经被高分子完全包覆,并成功嫁接上了羧基功能团。
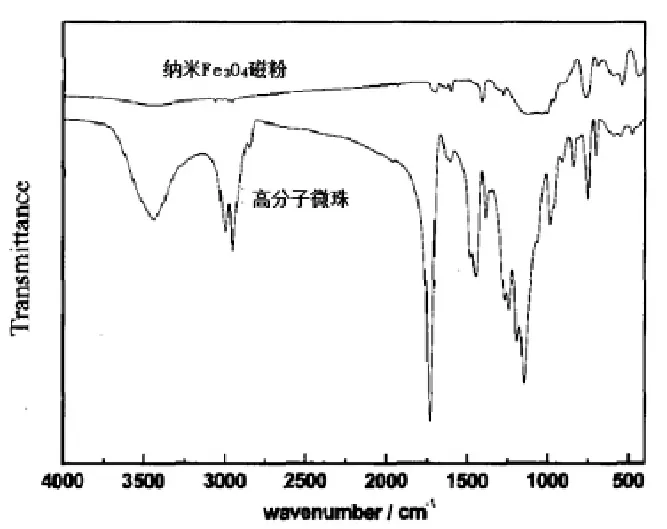
图4 Fe3O4磁粉与高分子微珠红外分析对比Fig.4 Comparison of Fe3O4magnetic powder andpolymer microspheres infrared analysis
3.3不同粒径的纳米Fe3O4磁粉对磁性高分子微珠的性能影响
将不同粒径的纳米Fe3O4磁粉通过试验制备成磁性高分子微珠,分析这些磁性高分子微珠的性能。
3.3.1不同粒径的纳米Fe3O4磁粉制备的磁性微珠红外光谱对比

图5 不同粒径Fe3O4制备的磁性微珠TEM照片Fig.5 Fe3O4prepared magnetic microsphere TEM photograph in different particles
图5为不同粒径Fe3O4制备的磁性微珠TEM照片。从图5中可以看出,粒径为7nmFe3O4磁粉由于其自身粒径小,磁粉悬浮于液体中,磁粉之间的范德华力与分子斥力相对较小,造成Fe3O4磁粉间的距离小,很容易产生团聚现象,在磁珠高分子包覆过程中,就会造成多个Fe3O4磁粉同时包覆在一个磁珠中,进而造成磁珠粒径不均。粒径为46nm的Fe3O4磁粉由于粒径较大,在磁珠高分子包覆过程中,高分子材料不能均匀地附着在磁粉的表面,从而磁珠表面凹凸不平,甚至有的地方还没有被包覆,影响磁珠的使用性能。
3.3.2不同粒径Fe3O4制备磁性微珠的磁滞回线对比
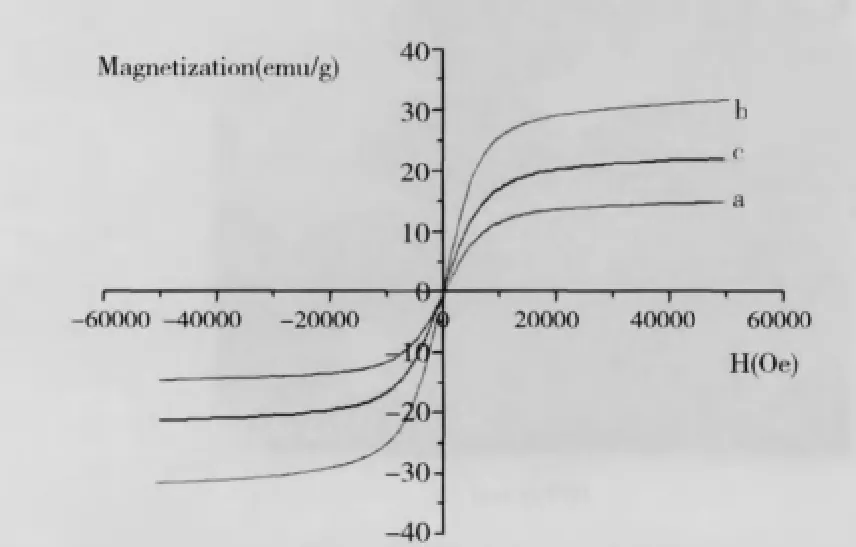
图6 不同粒径Fe3O4制备磁性微珠的磁滞回线对比Fig.6 Hysteresis loop comparison of Fe3O4prepared magnetic microsphere in different particles
图6为不同粒径Fe3O4制备磁性微珠的磁滞回线对比图。从图6中可以看出,粒径为7nm的Fe3O4磁粉,其磁饱和强度σ较粒径为13nm的Fe3O4磁粉小,所以在形成磁珠后,磁珠的磁饱和强度σ要<13nm 的Fe3O4。而粒径为46nm的Fe3O4磁粉所制备的磁珠,在测量体积时,Fe3O4磁粉含量较少,进而造成磁饱和强度σ随着粒径的增加,其磁饱和强度σ反而变小的情况。
4 结语
试验中可以看出,粒径为13nm的Fe3O4磁粉是纳米磁性高分子微珠理想的磁核选择,纳米Fe3O4/SiO2磁性微珠表面高分子包覆层强度高,通过功能单体共聚途径即可实现表面化学功能团的嫁接。所制备的磁性高分子微珠,粒径均匀、分散效果好,具有良好的超顺磁性。为以后进行核酸提取试验提供了良好的试验载体,同时也为磁性高分子微珠多种功能团的嫁接试验,提供了技术基础。
参考文献:
[1]Huang S H,Liao M H,Chen D H.Direct binding and characterization of lipase onto magnetic nanoparticles[J].Biotechnology Progress.2003,(19):1095-1 100.
[2]Zhang B,Xing J M,Liu H Z.Preparation and applica-tion of magnetic microsphere carriers[J].Front Chem Eng China.2007,1(11):96-101.
[3]丁明,孙虹.Fe304/壳聚糖核壳磁性微球的制备及特性[J].磁性材料及器件,2001,32(6):1-3.
[4]Ma M,Zhang Y,Yu W,et a1.Preparation and characterization of magn etite nanoparticles coated by amino silane[J].Colloids and Surfaces A:Physicochemical Engineering Aspects,2003,(212):219-226.
[5]赵吉丽,韩兆让,王莉,等.表面含羧基磁性高分子复合微球的制备[J].高分子材料科学与工程,2006,22 (4):204-207.
[6]施卫贤,杨俊,王亭杰.磁性Fe3O4微粒表面有机改性[J].物理化学学报,2001,17(6):507-510.
[7]Hawkins T L,McKernan K J,Jacotot L B,et al.DNA sequencing -A magnetic attraction tohigh-throughput genomics[J].Science,1997,276(5320):1887.
[8]Percin I,Karakoc V,Akgol S,et al.Poly(hydroxyethyl methacrylate) based magnetic nanoparticles for plasmid DNA purification from Escherichia coli lysate[J].Mater Sci Eng C:Mater Biolog Appl,212,32(5):1133.
[9]Chiang CL,Sung CS.Purification oftransfection-gradeplasmid DNA frombacterial cells with superparamagnetic nanoparticles[J].J Magn Mater,2006,302(1):7.
[10]Lee C M.Griffith J F.Kaiser W et a1.Covalently 1inked immunomagnetic separation/adenosine triphosphate technique (Cov-IMS/ATP)enables rapid,in field detection and quantification of Esche-richia coli and Enterococcus spp.in freshwater and marine environ-ments[J].J Appl Microbiol,2010;109 (1):324-333.
[11]Yang H,Qu L,Wimbrow A N et a1.Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR[J].Int J Food Microbiol,2007;118(2):l32-l38.
[12]Fedio W M.Jinneman K C,Yoshitomi K J et a1.Detection of E.coli O157:H7 in raw ground beef by Pathatrix immunomagnetie-sep-aration.real-time PCR and cuhural methodsl[J].Int J Food Microbiol,2011;148(2):87-92.
The Influence of Fe3O4Magnetic Powder in Different Particles on the Nano Magnetic Polymer Microspheres Performance
HUANGBo
(Institute of Advanced Technology, Heilongjiang Academyof Sciences, Harbin 150023, China)
Abstract:Fe3O4Magnetic powder in different particles was obtained under different reaction condition by chemical coprecipitation method.Nano magnetic polymer microspheres were prepared by Fe3O4Magnetic powder surface-modified, secondary cladding and functional grafting technology.The composition, size and morphology, magnetic properties was identified by FT-IR, TEM, and VSM.The results showed Fe3O4Magnetic powder of 13 nm was ideal choice for magnetism nucleus of Nanomagnetic polymer microspheres.
Key words:Magnetic polymer microspheres; Surface-modified and cladding; Functional grafting
作者简介:黄波(1980-),男,黑龙江哈尔滨人,高级工程师,工学学士,主要从事磁性流体与磁流变液及相关产品的研发工作。
收稿日期:2016-01-10
中图分类号:TM271
文献标志码:A
文章编号:1674-8646(2016)02-0010-04

