中药材北沙参种子DNA条形码鉴定研究*
张改霞,金 钺,贾 静,石林春**,孙稚颖
(1.山东中医药大学药学院 济南 250355;2.中国医学科学院 北京协和医学院药用植物研究所 北京 100193)
中药材北沙参种子DNA条形码鉴定研究*
张改霞1,2,金 钺2,贾 静2,石林春2**,孙稚颖1**
(1.山东中医药大学药学院 济南 250355;2.中国医学科学院 北京协和医学院药用植物研究所 北京 100193)
目的:本研究旨在建立鉴定北沙参种子的新方法,确保药材生产种植中种质基原准确。方法:对北沙参不同产地种子经初步形态特征鉴定后,取单粒种子为一份样品,提取基因组DNA、PCR扩增、双向测序拼接获得ITS2序列,结合序列比对、变异位点分析,基于中药材DNA条形码鉴定系统(http://www. tcmbarcode.cn),系统地完成种子样品的分子鉴定。结果:研究表明66份种子样品中,64份与《中国药典中药材DNA条形码标准序列》中北沙参序列特征一致,2份样品序列中各有一处SNP位点,为北沙参暂未发现过的遗传多样性信息,鉴定结果显示为北沙参。结论:DNA条形码技术能准确鉴定北沙参种子,并为中药材种子鉴定提供新方法,同时SNP位点的发现为后续研究北沙参品种多样性问题提供参考。
北沙参 中药材种子 ITS2条形码 分子鉴定
北沙参为伞形科植物珊瑚菜Glehnia littoralis Fr. Schmidt ex Miq. 的干燥根,是我国常用大宗中药材,具养阴清肺,益胃生津的功效,用于肺热燥咳,劳嗽痰血,胃阴不足,热病津伤,咽干口渴等症状[1]。目前北沙参野生资源极少,为国家三级保护濒危植物[2],被《国家重点保护野生植物名录》列为二级保护植物。据市场调查,流通北沙参药材现均为栽培品,引种区域从山东烟台、日照等沿海县市不断扩展到菏泽、济宁、聊城等内陆地区,并在河北安国、内蒙赤峰等地形成规模化产业化栽培种植[3]。北沙参药材的大规模人工培植,使得北沙参种源鉴定、良种选育问题尤为重要。
中药材种子是中药材产业化的基础,其质量与真伪直接影响中药材的种植、加工、流通、临床使用等后续各个环节。准确鉴定中药材种子,保证中药材种源的纯正优良,对后续种质优选、良种培育、规模化种植等各阶段具有重要意义。近年来,条形码技术广泛地应用于植物和动物的鉴定中,本文依据《中药材DNA条形码分子鉴定指导原则》[4],采用ITS2为主体序列,基于条形码技术,以中药材北沙参种子为研究对象,对收集到的22批66份北沙参种子样品鉴定,并从分子鉴定角度分析不同产地种源的可靠性,确保种子来源准确,为北沙参良种鉴定选育提供参考依据。
1 材料和方法
1.1 材料
为使实验结果具有代表性[4],通过产地调查和文献检索,从药材的主要分布区河北、安徽、内蒙古、山东等省份共收集22批次优质北沙参种子,每个批次种子取样3次,共66份样品。样品信息见表1。
1.2 方法
1.2.1 形态学考察
取北沙参种子,确保取样均匀性,于LY-WN-HPCCD型动态显微成像系统(成都励扬精密机电有限公司)下观察种子形状、大小、颜色等表面性状,并拍照记录,用游标卡尺(上海九量五金工具有限公司)精确测量长度、宽度,并用百粒法测其千粒重[5],准确记录各项结果。
1.2.2 DNA提取
从22批样品中,每批样品取样3次,分3批于不同时间、不同仪器实验,每批每次轻取一粒种子(约15 mg,避免带出它粒种子碎屑),使用75%乙醇擦拭表面、挥干,用DNA提取研磨仪MM400(德国Retsch公司)加2粒钢珠研磨2 min(30次/s),使用植物DNA提取试剂盒[天根生化科技(北京)有限公司]提取总DNA,加入裂解液后,56℃水浴过夜。其后加入等体积氯仿∶异戊醇(24∶1)抽提,取上清,吸附柱过滤并用缓冲液、漂洗液洗涤,最后用洗脱缓冲液(Buffer TE)洗脱。提取到的基因组DNA,采用NanoDrop 2000 (美国Thermo Scientific公司)测其浓度,并根据A260/A280,A260/A230的值判断DNA提取质量。
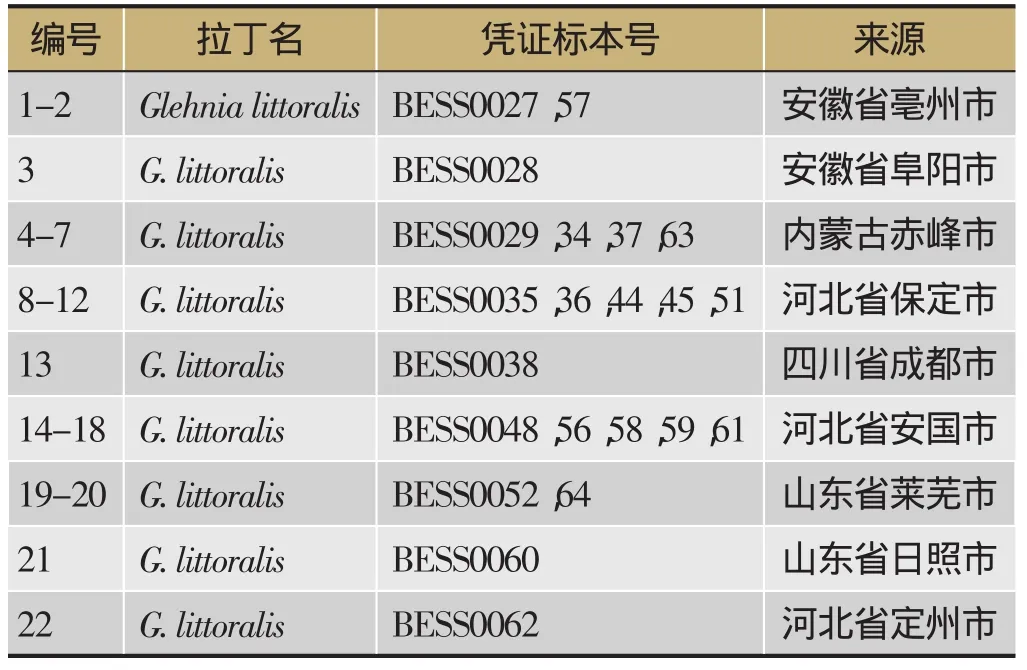
表1 实验材料编号及产地

图1 北沙参种子群体图、个体图
1.2.3 PCR扩增及测序
PCR反应为25 μL体系,反应体系的配置、扩增引物的选择及反应条件的设置依照Chen等[6]的研究方法操作,PCR产物纯化后使用ABI3730XL测序仪进行双向测序。
1.2.4 数据处理
测序峰图利用CodonCode Aligner V4.2.7(美国CodonCode公司)去除低质量区域、校对拼接、切除正反引物序列。基于隐马尔可夫模型(Hidden Markov Model)去除5.8S rRNA和28S rRNA区段获得ITS2序列[7]。利用Mega 5.05进行序列比对、变异位点分析,基于中药材DNA条形码鉴定系统,在物种鉴定项下植物类药材鉴定 (ITS2)项,将实验序列粘贴到鉴定框中,提交并查询,系统地完成实验种子样品的鉴定。
2 结果
2.1 形态特征
北沙参药材的“种子”实际上为珊瑚菜的双悬果,呈棕色,气香,灰黄色,近球形或椭圆形,分生果半椭圆形,合生面平坦棕色,长6-13 mm,宽6-10 mm,背部棱3,两边各1,稍延展,表面被棕色绒毛。将分生果果皮剥开现胚乳,腹面略凹陷。千粒重约15 g,群体图、个体图见图1。
2.2 DNA提取、PCR扩增和测序
DNA提取时,直接取单粒种子实验,在加入等体积冷冻异丙醇沉淀DNA过程中,会有个别样品底部出现白色团块胶状物,为避免对后续PCR扩增、测序造成影响,应不考虑部分DNA损失,只吸取上清过滤,舍弃沉淀物。NanoDrop 2000检测DNA浓度均大于10 ng·μL-1,OD260/280比值2.00左右,OD260/230比值2.00-3.00,扩增条带整齐明亮,约500 bp,测序峰图底峰干净,无杂峰套峰的出现。不同时间、使用不同仪器实验的3批样品结果一致,可见实验中各因素对结果影响较小,ITS2序列获取较为容易。
2.3 北沙参种子物种鉴定
本研究共收集22批样品,每批样品取单粒种子3次,经实验获得66条ITS2序列,长度均为227 bp。共出现3种单倍型,单倍型A1 64条序列,单倍型A2、A3各1条序列。如图2(正向测序峰图),峰图整体质量较高,单倍型A2 108位、单倍型A3124位各有1套峰,单倍型A1相应位点处并未出现套峰,且经反向序列验证,结果与之相对应,可知套峰处即为多拷贝位点处,即单倍型A2代表序列BESS0059-2在108 bp处G(T)多拷贝,单倍型A3代表序列BESS0029-1在124 bp处G(A)多拷贝,主导单倍型A1与《中国药典中药材DNA条形码标准序列》[8]中北沙参主导单倍型序列特征一致,可以确定其基原为北沙参。单倍型A2、A3有多拷贝位点出现,为新的单倍型,利用中药材DNA条形码鉴定系统网站,在物种鉴定项下植物类药材鉴定(ITS2)项,将所得样品ITS2序列粘贴到鉴定框中,提交并查询,结果显示种子样品主导单倍型A1与数据库中北沙参序列完全一致,单倍型A2、A3与数据库中北沙参序列相似性高达99.6%,比对结果显示为北沙参,表明所有种子样品均为北沙参种子,从而系统的完成对北沙参种子样品的鉴定。多拷贝位点分析峰图见图2。
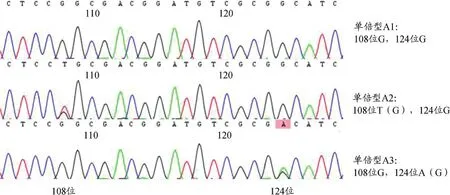
图2 北沙参种子ITS2序列种内多拷贝位点峰图
3 讨论
3.1 DNA条形码技术可准确鉴定中药材北沙参种子
北沙参种子传统鉴定法主要从种子表面形态、大小、形状及内部特征如油管等方面鉴别,传统鉴定方法一般需要丰富的专业经验,多方面、多角度分析辨别,不便于数字化和自动化。本研究采用DNA条形码技术对北沙参种子鉴定,采用单粒种子实验的方法,有效避免不同种粒遗传物质之间的相互干扰,66条序列,每条均源自一粒种子的DNA,从DNA 提取至ITS2序列获得,各步进行均较顺畅,没有出现未能获得序列的样品,结果较好。在对种子物种鉴定时,单倍型A1的64条序列与《中国药典中药材DNA条形码标准序列》中北沙参主导单倍型序列特征一致,可以确定其基原为北沙参,而单倍型A2、A3各有一个多拷贝位点,为北沙参ITS2序列中暂未出现的单倍型,可结合中药材DNA条形码鉴定系统网站鉴定,发现实验样品中并没有北沙参种子混伪品出现,从而系统地完成各序列的鉴定。《中国药典中药材DNA条形码标准序列》与中药材DNA条形码鉴定系统网站的结合应用简便准确,给中药材种子鉴定提供了新方法。序列比对中66条序列中只有2条序列分别各有1处多拷贝位点,可见ITS2条形码鉴定北沙参种子种内变异小,遗传稳定性高,新增变异位点的出现在一定程度上丰富了北沙参条形码序列数据库,为后续北沙参遗传多样性研究提供参考数据。
3.2 DNA条形码技术可用作中药材种子鉴定的通用方法
研究发现,目前对中药材种子的鉴定,主要有性状、显微、理化和现代生物学鉴定法等[9-13]。这些方法在长期中药材种子鉴定工作中发挥了重要作用,但各自又有一定的局限性,如易受研究者专业经验、实验设备条件、生物物种特异性等因素的影响。DNA条形码技术以中药材DNA条形码鉴定系统为核心,无过高的专业经验要求,所用实验设备简单且不受物种形态、性状、成分等的限制,鉴定准确,通用性高,关于DNA条形码在相关领域的应用,辛天怡等[14]做了详细综述。此外,《中药DNA条形码分子鉴定》、《中国药典中药材DNA条形码标准序列》等基于条形码技术对物种鉴定参考书目的出现,也充分说明DNA条形码鉴定的可靠性与通用性[15,8]。本研究是将条形码技术运用到中药材种子鉴定中,目前,我国中药材种子主要依托于已批准的17个中药材专业市场作为收售渠道,缺少对应的监管部门,大多数中药材种子质量检验以农作物种子标准作为参照。这种无质量标准可依、缺乏正规监管的种子市场势必给中药材生产及临床用药安全带来隐患,影响中药材在国内外市场的声誉[16,17]。本研究运用DNA条形码成功鉴定北沙参种子,是中药材种子鉴定新方法的成功应用,可以为今后条形码技术作为中药材种子鉴定的标准技术,以及全国中药材种质资源管理提供参考依据。
3.3 北沙参基因组内多拷贝问题的探讨
利用DNA条形码技术,经双向测序分别在两粒样品中各发现一处多拷贝位点(T/G、A/G),经验证发现并非由实验或测序等过程中的错误造成,初步确定为北沙参基因组内多拷贝,为北沙参基因组内遗传变异。在大多数物种中,由于经历了一致性进化, 具有主导拷贝变异类型,但也有例外情况,例如:Ma等[18]对同一居群内29个样品的ITS序列进行克隆研究,在获得的102个克隆中共发现773变异位点分布 在ITS2区段,并指出这种基因水平的多态性与自身生理特征、自身进化、环境因素等有关。Song等[19]利用高通量测序方法对178个物种基因组内ITS2序列的多拷贝情况进行研究,发现平均每个物种有35个变异类型,3个主导变异类型,这3个主导变异类型的拷贝数占全部拷贝数的91%。进一步研究表明,尽管ITS2基因组内变异频繁,多数情况下,仅依靠主导变异即可完成系统发育和物种水平的鉴定,次要和稀有变异可提高分辨能力。本研究中的北沙参种子为不同地区收集种子,遗传变异位点的出现是否与产地的环境差异、长期不同区域间的引种栽培有关还需进一步研究。在后期进化中,是否会有北沙参变种出现,这种变异会对北沙参物种产生什么样的影响等问题都值得深入探讨。
1 国家药典委员会.中华人民共和国药典(一部).北京:中国医药科技出版社, 2015∶ 100.
2 傅立国.中国植物红皮书——稀有濒危植物.北京:科学出版社1993∶ 698.
3 徐祝封,张钦德,李庆典,等.北沙参道地产区种子生产、种苗培育现状调查与分析.山东中医药大学学报, 2006, 30(6)∶ 493-496.
4 陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则.中国中药杂志, 2013(2)∶ 141-148.
5 国家技术监督局. GB/T 3543.7-1995农作物种子检验规程:其他项目检验,北京:中国标准出版社, 1996∶ 95-96.
6 Chen S L, Yao H, Han J P, et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species. PLoS ONE, 2010, 5 (1)∶ e8613.
7 Keller A, Schleicher T, Schultz J, et al. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation. Gene, 2009, 430∶ 50-57.
8 陈士林.中国药典中药材DNA条形码标准序列.北京:科学出版社, 2015∶ 163-164.
9 韦颖. 105种常用药用植物果实、种子性状与显微鉴别特征研究.北京:中国中医科学院, 2012∶ 33-271.
10 高飞燕.种子类中药微性状鉴定法研究.合肥:安徽中医药大学硕士学位论文, 2013∶ 11-63.
11 张玉杰,张建军,闫兴丽,等.不同产地正伪品沙苑子HPLC指纹图谱鉴别研究.中国中药杂志, 2003, 28(9)∶ 30-32, 71.
12 张琼光,陈科力,王克勤.厚朴两种类型种子的电泳鉴别.时珍国医国药, 2003, 28(9)∶ 541-542.
13 郑海燕.利用RAPD、ISSR和SRAP标记技术构建红麻(Hibiscus cannabinus L.)种质资源分子身份证.北京:中国农业科学院硕士学位论文, 2010∶ 10-40.
14 辛天怡,雷美艳,宋经元.中药材DNA条形码鉴定研究进展.中国现代中药, 2015, 17(2)∶ 170-176.
15 陈士林.中药DNA条形码分子鉴定.北京:人民卫生出版社, 2012∶ 1-568.
16 宁书菊,魏道智.关于我国中药材种子产业的思考.中国种业, 2013, 3∶ 3-4.
17 邵长勇,尤泳,王光辉,等.安国中药材种子种苗产业发展中的现代物理技术应用.种子, 2013, 32(12)∶ 70-72,75.
18 Ma X C, Xie C X, Guan M, et al. High levels of genetic diversity within one population of Rheum tanguticum on the Qinghai-Tibet Plateau have implications for germplasm conservation. Pharm Crops, 2014, 5∶ 1.
19 Song J Y, Shi L C, Li D Z, et al. Extensive pyrosequencing reveals frequent intragenomic variations of internal transcribedspacer regions of nuclear ribosomal DNA. PLoS ONE, 2012, 7(8)∶ e43971.
Identification of the Seeds of Glehniae Radix with DNA Barcoding Method
Zhang Gaixia1,2, Jin Yue2, Jia Jing2, Shi Linchun2, Sun Zhiying1
(1. College of Chinese Medicine, Shandong University of Traditional Chinese Medicine, Jinan 250355, China; 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China)
In this study, a new technique was adopted to discriminate and ensure the pure sources of the seeds of Glehniae Radix. The morphological characteristics of the seeds from different habitats had been first surveyed. Then the DNA extraction, PCR amplification, DNA sequencing and assembly were carried out. Species identification for each sample was implemented through the DNA barcoding system of traditional Chinese medicine (http://www.tcmbarcode.cn). The results showed that sixty-four sequences were genuinely based on “Standard DNA Barcodes of Chinese Materia Medica in Chinese Pharmacopoeia”, and two samples contained SNP loci. The identification results referred to Glehniae Radix of all sequences according to the DNA barcoding system. In conclusion, DNA barcoding technique was suitable for the identification of the seeds of Glehniae Radix, which provided a new method for identification of the seeds of Chinese herbal medicines. The finding of SNP loci also furnished with a reference for studies on the variety diversity of Glehniae Radix.
Glehniae Radix, Chinese herbal seeds, ITS2, molecular identification
10.11842/wst.2016.02.006
R282.5
A
(责任编辑:朱黎婷 张志华,责任译审:朱黎婷 王 晶)
2015-11-29
修回日期:2015-12-01
* 科学技术部国家科技支撑计划子课题(2011BAI07B08):中药种子种苗 DNA条形码鉴定及流通管理平台的建立,负责人:陈士林;山东省教育厅高等学校科技计划项目(J12LM05):基于DNA条形码技术的山东省珍稀濒危特有野生药用植物资源研究,负责人:孙稚颖。
** 通讯作者:石林春,副研究员,主要研究方向:中药鉴定学;孙稚颖,副教授,主要研究方向:药用植物资源与分类鉴定。

