硫酸软骨素酶ABC联合超短波治疗对脊髓损伤大鼠的功能恢复及胶质瘢痕形成的影响
王笑男,张志强,张立新
脊髓损伤(spinal cord injury,SCI)是一种严重威胁人类健康及生存质量的疾病,并且主要发病人群为青壮年,目前尚无有效治疗方法。SCI后形成的胶质瘢痕对中枢神经有一定的保护作用,使其免受进一步损害,但是胶质瘢痕形成阻碍了神经再生,影响功能恢复。因此,在治疗SCI过程中,抑制胶质瘢痕形成是非常重要的。Zhang等[1]通过骨髓间充质干细胞移植联合硫酸软骨素酶ABC(Chondritinase ABC, ChABC)注射治疗,证实二者联合作用对大鼠SCI后神经修复有效。临床上,小剂量超短波治疗具有改善血液循环、组织营养及消炎等作用,应用广泛。 胶质纤维酸性蛋白(glial fibrillaty acidic protein, GFAP)是活化星形胶质细胞标记物。活化的星形胶质细胞分泌大量的神经抑制因子——硫酸软骨素蛋白聚糖(chondroitin sulphate proteoglycans, CSPGs),CSPGs是参与胶质瘢痕形成的重要分子[2]。因此本实验通过术后观察大鼠运动功能及检测GFAP、CSPGs表达水平,来观察ChABC联合超短波治疗能否进一步抑制胶质瘢痕形成,从而进一步促进大鼠运动功能恢复。
1 材料与方法
1.1 实验器材与试剂 ①器材:脑损伤打击器,PE10微导管,微量注射器。②试剂: 硫酸软骨素酶ABC(Sigma公司,10U)。GFAP第一抗体,内源性过氧化物酶,抗原修复液I,GFAP第二抗体,SABC,DAB显色剂A、DAB显色剂B、DAB显色剂C。CSPGs第一抗体、抗原修复液。内源性过氧化物酶,CSPGs第二抗体,动物非免疫血清,链霉素抗生物素-过氧化氢酶(SP)溶液,DAB缓冲液,DAB底物,DAB色原。
1.2 方法 ①动物分组:8周龄SD大鼠,雌雄不限,共42只。随机分成3组,每组14只。分别为对照组(其中8只为单纯损伤组,另外6只为加PBS溶液治疗的安慰剂组)、ChABC组、联合组(ChABC联合超短波治疗)。②造模:按改良Allen's法制作大鼠脊髓损伤模型:大鼠在5%水合氯醛腹腔麻醉(0.6ml/100g)下俯卧固定,依据T2椎体,找到T10,以T10为中心作皮肤切口长约3cm,剥离周围软组织后显露并咬除T10及部分T9、T11棘突和椎板,骨窗大小约4×8mm,暴露脊髓背侧硬脊膜,将动物固定在致伤装置底座上,使冲击棒套管下端之弧形面与脊髓背面贴附良好,之后用10g冲击棒自10cm高处自由下落打击脊髓,形成脊髓损伤模型,冲击棒直径2mm,致伤能量为100gcf。然后,对照组中的单纯损伤组逐层关闭切口。术中操作注意严格无菌。术后腹腔注射青霉素3d,4万单位/日/只,观察有无血尿,必要时继续注射青霉素。根据伤情膀胱挤压协助排尿,2次/日,直至恢复自行排尿。此外,ChABC组和联合组及加PBS治疗的对照组打击脊髓后,再咬除T12右侧半椎板作为蛛网膜下腔置管区,将PE10导管置入蛛网膜下腔,孔尖距损伤区1~2mm。将导管固定于肌肉上。逐层关闭切口,同时进一步固定PE10导管。④干预:对照组中的加PBS安慰剂组、ChABC组和联合组术后立即用微量注射器经PE10导管注射1U/mL ChABC或PBS溶液6μl,以后每天同量给药1次,1周后停药。此外,联合组术后第2天予小剂量超短波治疗(上海产五官超短波治疗仪用2个2号极板放置于大鼠的两侧,位置在损伤的脊髓区,极板距离大鼠2cm),用无热量治疗,治疗前用氖泡灯调谐,每天1次,每次7min,至取材前一天。
1.3 评定标准 评估各组大鼠术后1天及1~4周每周的运动能力,测量术后2周、4周大鼠脊髓标本损伤区的GFAP、CSPGs平均光密度值。①运动功能评分:采用BBB(Basso,Beattie & Bresnahan locomotor rating scale, BBB)运动评分法,BBB评分包括:评判动物后肢各关节活动(0~7分);评判动物后肢的步态和协调功能(8~13分);评判动物运动过程中爪的精细动作(14~21分),满分21分。②免疫组织化学染色:各组大鼠脊髓取材做免疫组织化学染色。用装有图像采集软件NIS-Elements F 3.0的设备采集图像。先在低倍镜下确定脊髓损伤位置,再用400倍放大镜下采集脊髓损伤部位图像。图像采集方法是均匀沿瘢痕周边拍5张图片,以保证覆盖损伤区。用NIS-Elements Br 3.0对所有采集的图像进行半定量分析,直接测出GFAP、CSPGs的平均光密度值。因每个标本采集了5张图像,因此测出了5个平均光密度值。最后对每个标本的5个平均光密度值取算术平均值,并将其输入表格进行统计分析。
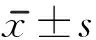
2 结果
2.1 BBB运动功能评分 对照组:术后1周的评分虽然比1d高,但差异无统计学意义;术后2周到3周连续提高(P<0.05,0.01);术后4周的评分虽然比3周高,但差异无统计学意义。ChABC组:术后1周的评分虽然高于1d但差异无统计学意义,术后2周开始均开始连续调高(P<0.05)。联合组:术后1周到2周评分连续提高(P<0.01,0.05);虽然3周与2周相比,4周与3周相比均有升高趋势,差异均无统计学意义;而4周评分明显高于2周(P<0.01)。组间比较:联合组在术后1~4周各时间点的BBB评分均高于对照组(P<0.05,0.01)。ChABC组仅在术后第4周高于对照组(P<0.01);其余各时间点与对照组比较差异无统计学意义。ChABC治疗组与联合治疗组在各时间点比较差异均无统计学意义。见表1。
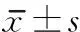
表1 3组术后各时间点BBB评分比较 分,
与组内前一时间点比较,aP<0.05,bP<0.01;与术后2周比较,cP<0.01;与同时间点对照组比较,dP<0.01
2.2 GFAP免疫组化 术后2周至4周,3组各自的GFAP平均光密度值均无明显变化。术后2周,ChABC组和联合组的GFAP平均光密度值均明显低于对照组(P<0.01);术后4周,对照组的GFAP平均光密度值与两个治疗组相比,差异均无统计学意义。见图1,表2。
2.3 CSPGs免疫组化 对照组术后4周时,CSPGs阳性表达明显低于术后2周(P<0.01),ChABC治疗组和联合组各自的GFAP平均光密度值均无明显变化。术后2周,ChABC组和联合组与对照组比较CSPGs平均光密度值明显降低(P<0.01),术后4周,组间差异消失。两个治疗组相比,两个时间点的组间差异均无统计学意义。见图2,表2。

图1 术后2周及4周时3组CSPGs免疫组化比较(×400)
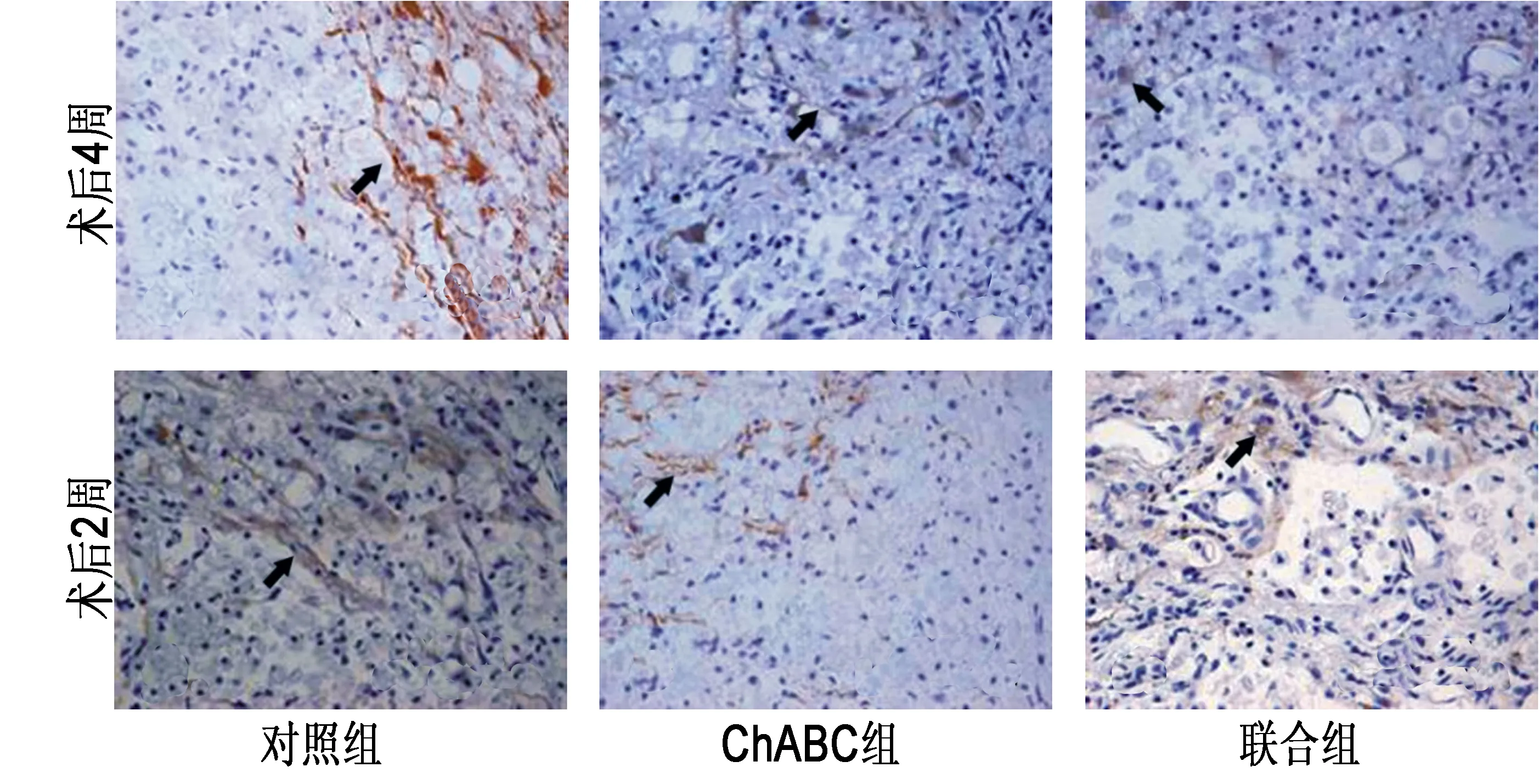
图2 术后2周及4周3组GFAP免疫组化比较(×400)
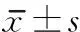
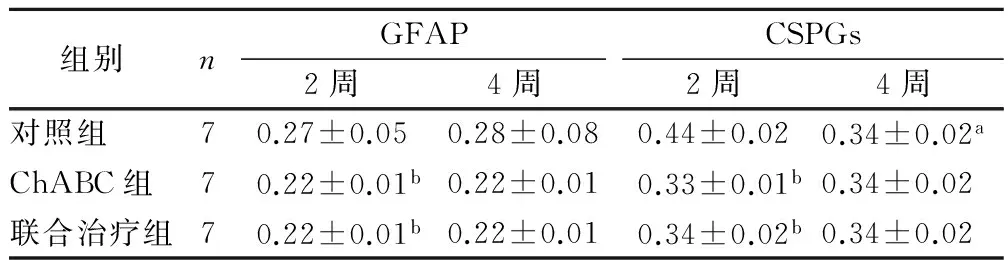
组别nGFAP2周4周CSPGs2周4周对照组70.27±0.050.28±0.080.44±0.020.34±0.02aChABC组70.22±0.01b0.22±0.010.33±0.01b0.34±0.02联合治疗组70.22±0.01b0.22±0.010.34±0.02b0.34±0.02
与组内术后2周时比较,aP<0.01;与对照组比较,bP<0.01
3 讨论
SCI后会产生复杂的免疫反应,包括细胞免疫、体液免疫。在此过程中,星形胶质细胞被激活,活化的星形胶质细胞过度增生导致胶质瘢痕形成。胶质瘢痕中的星形胶质细胞表现为胞体增大,突起增多变粗,胶质瘢痕将空洞与周围脊髓组织隔离[3]。虽然SCI后形成的胶质瘢痕可以起到保护作用,阻止了中枢神经系统的进一步损害,但是胶质瘢痕形成阻碍了神经再生,影响了SCI后神经功能恢复。所以,SCI后对胶质瘢痕形成的抑制是一个有价值的治疗。GFAP是神经胶质细胞的主要细胞骨架成分,在成熟的神经系统中,主要存在于星形胶质细胞中。GFAP是星形胶质细胞的标记物,它的变化反应了星形胶质细胞的状态。在SCI后,GFAP早期促进神经再生,后期形成胶质瘢痕[4]。SCI后,活化的星形胶质细胞可分泌表达CSPGs,而CSPGs主要是由星形胶质细胞分泌的,其是参与胶质瘢痕形成的重要分子[2]。Plant等[5]通过实验认为CSPGs很可能是阻碍轴索再生的分子抑制屏障。Morgenstern等[6]认为在中枢神经损伤处CSPGs是一重要的抑制因子,使中枢神经成功再生就要抑制产生CSPGs的细胞或分子。因此,本实验选择GFAP、CSPGs来观察ChABC治疗和超短波联合ChABC治疗对胶质瘢痕形成的抑制效果。张海燕等[7]的研究表明,CSPGs在损伤后开始上调,伤后7天开始达到高峰,至2周开始下调,1个月后开始趋于稳定;黄凯等[8]通过大鼠实验表明,脊髓损伤后4周胶质瘢痕厚度达到高峰,囊腔与残存轴突之间开始形成机械屏障,与我们对照组的实验结果相一致。因此,本实验在大鼠SCI术后立即给药,并选择术后2周、4周作为CSPGs、GFAP因子的观察时间点。
硫酸软骨素是一种酸性粘多糖类生物大分子,常见的有3种类型ChS-A、ChS-B、ChS-C。ChABC是一种裂解酶,具有降解ChS-A、ChS-B、ChS-C及透明质酸等功能,能特异性破坏大部分的CSPGs的葡糖胺聚糖链(GAG),酶的半衰期较短。Xu等[9]通过蛛网膜下腔注射ChABC,发现ChABC能抑制胶质瘢痕,改善损伤区微环境,提高GAP-43的表达,促进轴索生长和延伸。因此,本实验采用蛛网膜下腔给药,连续给药1周。实验结果显示,ChABC组和联合组在术后2周的CSPGs平均光密度值均明显低于对照组,术后4周的CSPGs平均光密度值无明显差异,说明在损伤后用ChABC治疗或超短波联合ChABC治疗确实能够较大幅度抑制CSPGs的上调,使CSPGs维持在较低的水平,从而有效抑制了阻碍轴索再生的化学屏障,但随着病程的延长,CSPGs的表达也可自然恢复到较低水平。因为GFAP是星形胶质细胞的标记物,活化的星形胶质细胞参与构成胶质瘢痕的机械屏障。Zhang等[10]通过实验认为ChABC能够抑制GFAP的表达,减弱胶质瘢痕形成,促进轴索再生。本实验结果显示:在术后2周,联合组与ChABC组的GFAP的平均光密度值均明显低于对照组,而术后4周,虽然对GFAP有作用,但是因平均光密度值结果差异较大,而且样本量不足,虽有趋势,但无统计学差异,实验结果说明用ChABC治疗也能够在SCI后有效抑制GFAP增高,进而抑制了SCI后胶质瘢痕形成的机械屏障。综上所述,ChABC治疗组和联合治疗组对SCI后胶质瘢痕形成产生了明显的抑制作用。
Starkey等[11]通过实验,认为用ChABC治疗能够促进功能恢复,本实验结果显示在术后4周ChABC治疗组和联合治疗组的大鼠后肢功能恢复均明显比对照组要好,证实了用ChABC治疗确实能够促进大鼠功能恢复。超短波治疗在临床上应用比较广泛,小剂量超短波可缓解炎症、提高免疫应答。而胶质瘢痕形成是在SCI后发生免疫反应,激活星形胶质细胞后形成的。Yin等[12]通过实验证明,脊髓损伤后用超短波联合骨髓间充质干细胞治疗比单纯用骨髓间充质干细胞或超短波治疗功能恢复更好。因此,在联合治疗组除用ChABC治疗外,还加用小剂量超短波治疗以观察能否进一步抑制胶质瘢痕的形成及促进大鼠运动功能恢复。然而本实验的结果显示,超短波联合治疗组与ChABC治疗组相比,在对CSPGs和GFAP的抑制上,均没有差异。表明在抑制胶质瘢痕形成上,超短波联合ChABC治疗效果和单纯ChABC治疗效果没有统计学差异。因此说明,小剂量超短波治疗虽然能缓解炎症、减轻水肿;但是,对SCI后抑制胶质瘢痕形成上没有明显治疗作用。但是,本实验对大鼠术后1天以及以后每周一次的运动功能评分观察结果显示:虽然术后各组大鼠的运动功能都在恢复,但是在术后1~4周各时间观察点上,应用超短波联合ChABC治疗的大鼠肢体功能恢复明显比对照组的大鼠好。而术后1至3周各时间观察点上,单纯ChABC治疗组的大鼠肢体功能恢复相比对照组没有统计学差异,只是在术后4周明显超过对照组,以上结果说明ChABC联合小剂量超短波治疗能更好的促进SCI后的功能恢复,其机制可能与早期抑制胶质瘢痕形成有关,但作用不持久,也可能是因为小剂量超短波治疗能改善循环,营养组织,从而促进了神经功能恢复,加上用ChABC治疗在SCI后又有效的抑制了胶质瘢痕形成,为神经再生及功能恢复创造了有利条件。因此,超短波联合ChABC治疗是促进SCI后功能恢复的一个有效治疗手段,其具体机制尚不清楚,需要进一步研究。
[1] Zhang C,Yao C,He XJ,et al.Repair of subacute spinal cord crush injury by bone marrow stromal cell transplantation and chondroitinase ABC microinjection in adult rats[J].Journal of Southern Medical University,2010,30(9):2030-2035.
[2] Jones LL,Sajed D,Tuszynski MH.Axonal regeneration through regions of Chond-roitin sulphate proteoglycan deposition after spinal cord injury: abalance of permissiveness and inhibition [J].JNeurosci,2003,23(28):9276-9288.
[3] 胡荣, 周建军, 吴国才,等. 大鼠脊髓损伤后轴突病理变化与胶质瘢痕形成的关系[J]. 中华神经外科杂志, 2008,24(4):304-306.
[4] Homor PJ,Cage FH.Regenerating the damaged central nervouis system[J].Nature,2000,295(5572):1029-1031.
[5] Plant CW,Bates ML,Bunge MB.Inhibitory proteoglycan immunoreactivity is higher at the caudal than the rostral Schwann cell graft-transected spinal cord interface[J].Mol Cell Neurosci,2001,17(3):471-487.
[6] Morgenstern DA,AsherRA,Fawcett JW.Chondroitin sulphate proteoglycans in the CNS injury response[J].Prog Brain Res,2002,137:313-32.
[7] 张海燕,杨朝阳,李晓光,等.大鼠脊髓损伤后胶质瘢痕形成的病理学规律[ J ].中国康复理论与实践,2011,17(3):215-218.
[8] 黄凯,盛伟斌.大鼠脊髓胶质瘢痕形成的规律[J].中国组织工程研究,2012,16(20):3671-3674.
[9] Xu J,Sun D,Liu H,et al.Effect of chondroitinase ABC on growth associate protein 43 and glial fibrillary acidic protein after spinal cord injury in rats[J].Chinese Journal of Reparative and Reconstruetive Surgery,2010,24(10):1212-1216.
[10] Zhang T,Shen Y,Lu L,et al.Effect of chondroitinase ABC on axonal myelination and glial scar after spinal cord in rats[J].Chinese Journal of Reparative and Reconstruetive Surgery,2013,27(2):145-150.
[11] Starkey ML,Bartus K,Barritt AW,et al.Chondroitinase ABC promotes compensatory sprouting of the intact corticospinal tract and recovery of forelimb function following unilateral pyramidotomy in adult mice [J].Eur J Neurosci,2012,36(12):3665-3678.
[12] Yin YM,Lu Y,Zhang LX,et al.Bone marrow Stromal cells transplantation combined with ultrashortwave therapy promotes functional recovery on spinal cord injury in rats[J].Synapse,2015,69(3):139-147.

