磁刺激对脊髓损伤后运动功能障碍的疗效观察
王艺,周贤丽,侯岷,张秀莉,尚超平,吴宗耀
随着世界各国经济水平的发展,脊髓损伤(spinal cord injury, SCI)发生率呈现逐年增高的趋势[1]。由于SCI所导致的社会经济损失,针对SCI治疗和康复已成为当今医学界的一大课题。经颅磁刺激(transcranial magnetic stimulation, TMS)是一种新发展起来的非侵入性的脑部刺激技术[2]。近年来,研究者们已发现TMS对SCI后运动功能的恢复有不同程度的影响,主要是在原始运动皮层区实施高频刺激[3],也有学者采用1Hz TMS亦取得一定疗效[4]。本文旨在观察高频TMS及脊髓受损下端神经根磁刺激对不完全性SCI患者运动功能的疗效。
1 资料与方法
1.1 一般资料 2013年3月~2014年9月本科室收治的不完全性T6~L1节段SCI患者40例。纳入标准:均为外伤性SCI后遗留双下肢功能障碍患者;SCI后3~6个月;美国脊髓损伤协会(American Spinal Injury Association,ASIA)评定B~C级;无颅脑疾病、严重心脏病和癫痫病史。排除有认知障碍、颅脑外伤史及癫痫发作史者及四肢瘫患者。随机分为2组各20例,①观察组:男11例,女9例,年龄(39.4±13.2)岁;病程(121.2±20.6)d。②对照组:男12例,女8例,年龄(36.5±12.2)岁;病程(116.3±19.1)d。2组一般资料比较差异无统计学意义。
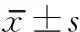
表2 2组患者治疗前后MEP潜伏期和波幅值比较 分,
与治疗前比较,aP<0.05,bP<0.01;与对照组比较,cP<0.05
1.2 方法 对照组接受常规康复治疗至少2个月,包括针灸、蜡疗、空气压力波治疗、肌力训练、关节活动度训练、站立训练、平衡训练等。治疗方案是每日1次,每周5次,连续8周。每项治疗的具体时间大约为20~30min。观察组在此基础上加用磁刺激治疗。选用CCY-Ⅰ型磁刺激仪(武汉依瑞德公司,最大输出强度2T),电极采用“8”字形线圈。每位患者分别经M1区(下肢运动皮质功能区)和受损下端完好的神经根磁刺激(距内固定下缘5~10cm):TMS患者取卧位,“8”字形线圈中心正对M1区,刺激强度为静息运动阈值的80%,刺激频率为20Hz,每个序列1s,间歇28s,连续 31个序列,共620个脉冲,每日1次,每周5次,连续8周;经受损下端神经根磁刺激患者取俯卧位,线圈中心距离内固定下缘5~10cm,刺激强度为静息运动阈值的80%,刺激频率25Hz,每个序列1s,间歇15s,连续56个序列,共计1400个脉冲,每日1次,每周5次,连续8周。
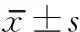
2 结果
治疗前后2组ASIA残损分级比较,观察组20例患者中3例从B级到C级,6例从C级到D级,11例无变化;对照组20例患者中2例从B级到C级,5例从C级到D级,13例无变化。将ASIA残损分级有变化视为有效,无变化视为无效;2组疗效比较差异无统计学意义。
治疗后,2组ASIA运动评分、WISCIⅡ分级均较治疗前明显提高(P<0.05),观察组更优于对照组(P<0.05)。治疗后MEP检查结果显示,2组潜伏期与治疗前相比明显缩短(P<0.01,0.05),且观察组优于对照组(P<0.05);治疗后2组波幅与治疗前相比均无显著统计学差异。见表1,2。
所有患者在TMS治疗期间无一例产生癫痫等不良反应。仅个别受试者在TMS治疗后出现一过性刺激局部不适感,未经特殊处理自行缓解。
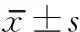
表1 2组治疗前后ASIA运动评分及WISCIⅡ分级比较 分,
与治疗前比较,aP<0.05;与对照组比较,bP<0.05
3 讨论
本文研究结果支持TMS联合经脊髓受损下端神经根磁刺激有利于胸腰段脊髓损伤致截瘫患者的运动功能恢复的假定。2组患者的总体功能指标ASIA残损分级略有变化,但疗效差异无统计学意义。康复评定的原则是分级越多则评定越灵敏,但是也越费时费力。ASIA残损分级将全部病情只定性地分为5级,很不敏感,所以本文的ASIA残损分级评定结果难以得出有统计学意义的结论。但是ASIA运动评分和WISCI Ⅱ分级评分是定量评分,灵敏度较高,明确显示了本组病例的治疗效果。
对不完全性SCI患者进行TMS治疗后,MEP潜伏期较治疗前缩短,说明TMS可使脊髓运动通路的传导效率提高[5];但本研究中MEP的波幅值在治疗前后没有显著统计学差异,原因可能是波幅指标变异性甚大,受多种因素影响,在整个测试过程中不易平衡和控制;而潜伏期指标排除了很多检查者主观因素的影响,更加灵敏可靠[6]。向艳平等[7]在研究不同频率TMS对SCI大鼠运动功能的影响时也发现,治疗前后MEP潜伏期有明显变化,而波幅无明显差异。郑秀琴等[8]观察TMS对SCI患者的临床疗效,结果显示MEP潜伏期是较为可靠的评价指标,而波幅值在不同个体或不同时间内有很大差异,建议不作为参考指标。
TMS在SCI康复应用中由于选择的参数不同,治疗效果并不一致。以往的研究多采用5~20Hz不等。Centonze等[9]报道,5Hz TMS治疗2周未获得运动功能是否改善的相关数据。Kuppuswamy[10]应用5Hz TMS治疗不完全性SCI患者5d,发现仅在治疗后1h出现上肢运动能力一过性提高。Kumru等[11]应用20Hz TMS治疗不完全性SCI患者,发现下肢肌力及步行速度改善,与本研究结果相符。
SCI后的修复一直是康复领域的一大难题。传统观点认为成年神经元已不具备细胞分裂增殖能力,不可再生。而神经损伤可塑性观点认为,脊髓神经细胞虽已失去有丝分裂能力,但却能产生新的突起,形成新的突触连接。表现形式为最先发生附近未受损伤神经元轴突的侧枝出芽;若受损神经元依然存活,可出现再生性出芽;在神经元轴突侧枝受损伤时,其他正常的侧枝可代偿性出芽[12]。TMS刺激大脑皮层,使之产生的感应电流激活上运动神经元,进一步诱发神经冲动在皮质脊髓束传导;TMS的积累效应除了活化轴突、促进再生之外,还可引发皮质网络突触的连接[13]。因此M1区被看做是TMS有效性最好的区域。
还有一个治疗部位是磁刺激脊髓受损下端神经根。此处采用25Hz的刺激频率还未见报道。刺激频率是突触可塑性的影响因素,频率更高的间歇性强直刺激诱发长时程增强(long term potentiation,LTP)更有效,而磁刺激神经根亦不会有TMS的安全考量,因此本研究采用25Hz磁刺激神经根进行治疗。刺激线圈置于内固定下缘5~10cm,可引起下肢运动,带动瘫痪肌收缩。磁场强度的刺激活化了线圈周围半径为1cm,深度为2~3cm的区域,且从中心的刺激轴呈现出指数衰减趋势。因此,将刺激线圈置于内固定下缘至少5cm处可以避免内固定的影响。SCI后,来自皮层的神经冲动不能有效地通过脊髓传递至靶肌肉。当磁刺激作用于受损下端神经根时,人工诱发动作电位在周围神经传导引起瘫痪肌收缩,可能与TMS的积累效应一起,共同改善SCI的运动功能。有关机制还需进一步探索。本研究在SCI患者的M1区、脊髓受损下端神经根分别进行磁刺激,发现治疗后的ASIA运动评分、WISCI Ⅱ分级评分提高,MEP潜伏期缩短,且效果优于单纯康复治疗。提示刺激M1联合受损下端神经根或许可丰富SCI的刺激方案,是促进运动功能恢复的有效康复手段。
磁刺激兴奋脊神经时,其实际作用的刺激点尚存争议,目前认为最可能的刺激点在椎间孔[14]。已有临床研究证实,TMS可促进中枢神经系统的可塑性变化以及皮质抑制指数下调是其重要机制[15]。但神经系统恢复涉及复杂的细胞和分子水平变化,因此TMS对中枢神经系统的干预机制还有待深入研究。本研究未将刺激M1联合受损下端神经根与仅M1区刺激进行比较,难以说明联合刺激与皮层刺激哪一个效果更明显,这是需要我们进一步探索与研究之处。
[1] Wyndael M, Wyndaele JJ.Incidence,prevalence and epidemiology of spinal cord injury:what learns a wordwide literature survey[J]? Spinal cord, 2006,44(9):523-529.[2] Thickbroom GW, Byrnes ML, Edwards DJ,et al. Repetitive paired-pulse TMS at I-wave periodicity markedly increases corticospinal excitability:a new technique for modulating synaptic plasticity[J].Clin Neurophysiol,2006,117(1):61-66.[3] 潘钰,汪漩,杜巨豹,等.重复经颅磁刺激对不完全性脊髓损伤患者的干预效果[J].中国康复理论与实践,2009,15(11):1058-1060.
[4] Mally J,Stone TW. New advances in the rehabilitation of CNS diseases applying rTMS[J].Exp Rev Neurother,2007,7(2):165-177.
[5] Haan P, KalKman CJ. Spinal cord monitoring: somatosensory and motor-evoked potentials[J]. Anesthesiol Clin North America, 2001,19(4):923-945.
[6] Poirrier A, Nyssen Y, Scholtes F, et al. Repetitive transcranial magnetic stimulation improves open filed locomotor recovery after low but not high thoracic spinal cord compression-injury in adult rats[J]. Neurosci Res, 2004,75(2): 253-261.
[7] 向艳平,唐锋,肖锋,等.不同频率重复经颅磁刺激对脊髓损伤大鼠运动功能的影响[J].中国康复医学杂志,2013,28(1):3-9.
[8] 郑秀琴,于苏文,鞠应秋.重复经颅磁刺激治疗脊髓损伤的临床疗效[J].癫痫与神经电生理学杂志,2010,19(1):38-41.
[9] Centonze D, Koch G, Versace V, et al. Repetitive transcranial magnetic stimulation of the motor cortex ameliorates spasticity in multiple sclerosis[J]. Neurology, 2007, 68(13): 1045-1050.
[10]Kuppuswamy A, Balasubramaniam AV, Maksimovic R, et al. Action of 5Hz repetitive transcranial magnetic stimulation on sensory, motor and autonomic function in human spinal cord injury[J]. Clin Neurophysiol,2011, 122(12): 2452-2461.
[11]Kumru H, Murillo N, Samso JV, et al. Reduction of spasticity with repetitive transcranial magnetic stimulation in patients with spinal cord injury[J]. Neurorehabil Neural Repair, 2010, 24(5): 435-441.
[12]Bear MF.Bidirectional synaptic plasticity: from theory to reality[J]. Phil Trans R Soc Lond,2003,358(1432):649-655.
[13]Massie CL, Tracy BL, Malcolm MP. Functional repetitive transcranial magnetic stimulation increases motor cortex excitability in survivors of stroke[J]. Clin Neurophysiol, 2013, 124(2): 371-378.
[14]Málly J, Dinya E. Recovery of motor disability and spasticity in poststroke after repetitive transcranial magnetic stimulation (rTMS)[J].Brain Res Bull, 2008, 76(4): 388-395.
[15]Belci M, Catley M, Husain M, et al. Magnetic brain stimulation can improve clinical outcome in incomplete spinal cord injured patients[J].Spinal Cord, 2004, 42(7): 417-419.

