褪黑激素对增生性瘢痕成纤维细胞增殖的影响及机制研究
慕生枝,康蓓,孙要文,王国栋,徐子寒
(陕西省人民医院烧伤整形医学美容外科1、神经内二科2,陕西 西安 710068)
褪黑激素对增生性瘢痕成纤维细胞增殖的影响及机制研究
慕生枝1,康蓓2,孙要文1,王国栋1,徐子寒1
(陕西省人民医院烧伤整形医学美容外科1、神经内二科2,陕西 西安 710068)
目的 探讨褪黑激素对人增生性瘢痕成纤维细胞增殖的影响及作用机制。方法收集人皮肤增生性瘢痕标本,原代培养人皮肤增生性瘢痕成纤维细胞(HSFBs)。将HSFBs细胞根据不同的处理方法分为空白对照组、低浓度褪黑激素组、中浓度褪黑激素组、高浓度褪黑激素组、NVP-BEZ235处理组、NVP-BEZ235+褪黑激素组、褪黑激素+siRNA-PTEN组、褪黑激素+siRNA-scramble组。MTT法检测各组细胞的增殖情况,qRT-PCR和Western blot检测各组细胞中磷酸酶与张力蛋白同源物(PTEN)、CyclinD1和Caspase-3的表达以及PI3k/AKt/mTOR通路相关蛋白p-Akt和p-mTOR的蛋白水平。结果与空白对照组比较,从低到高浓度褪黑激素均能够减少HSFBs细胞同一时间点OD值,上调PTEN和Caspase-3表达量,同时抑制CyclinD1、p-Akt和p-mTOR表达水平,组间差异具有统计学意义(P<0.05)。同时与高浓度褪黑激素组比较,NVP-BEZ235+褪黑激素组中细胞增殖显著被抑制,差异具有统计学意义(P<0.05);沉默PTEN后拮抗褪黑激素对HSFBs细胞增殖和PI3K/Akt/mTOR信号通路有抑制作用,差异具有统计学意义(P<0.05)。结论褪黑激素通过上调PTEN表达,抑制PI3K/Akt/mTOR信号通路活化从而抑制HSFBs细胞增殖。
褪黑激素;磷酸酶与张力蛋白同源物(PTEN);PI3k/AKt/mTOR信号通路;细胞增殖
在组织损伤修复过程中常常伴随瘢痕的形成,这是一种正常生理表现,也是创面愈合的最终结果。然而组织过度增生形成的增生性瘢痕则是一种病理性瘢痕,是人类皮肤特有的一种病理性改变[1-2]。研究表明增生性成纤维细胞 (hypertrophic scar fibroblasts cells,HSFBs)的凋亡减少和增殖过度是形成增生性瘢痕的核心因素[3]。因此有效抑制HSFBs过度增殖是改善瘢痕组织病变的主要途径。褪黑激素是一种主要由松果腺合成与分泌的吲哚类生物活性物质[4],研究表明褪黑激素能够抑制多种肿瘤的发展,例如乳腺癌、肝癌、黑色素瘤等,且机制可能与抑制肿瘤细胞过度增殖以及诱导凋亡有关[5-7]。目前,已经报道褪黑激素能够抑制HSFBs产生ROS,拮抗TGF-β1对HSFBs的转化作用[8]。但是褪黑激素对于HSFBs增殖的影响及其作用机制尚不明确。本研究通过体外培养HSFBs,探讨褪黑激素对其增殖的影响作用及其作用机制,为临床采用褪黑激素治疗增生性瘢痕提供理论依据。
1 材料与方法
1.1 实验材料 澳洲优质胎牛血清、DMEM培养基购自美国Gibco公司,RIPA细胞裂解液、BCA蛋白定量试剂盒、HRP标记山羊抗兔IgG购自中国凯诺生物技术公司,兔抗人PTEN多克隆抗体、兔抗人β-actin多克隆抗体、兔抗人p-Akt多克隆抗体、兔抗人CyclinD1单克隆抗体、兔抗人p-mTOR单克隆抗体以及兔抗人Caspase-3单克隆抗体均购自美国Cell signaling technology公司,qRT-PCR试剂盒购自日本Ta-KaRa公司。NVP-BEZ235和褪黑激素购自上海前尘生物科技有限公司。
1.2 增生性瘢痕成纤维细胞的分离与培养 取得患者或监护人同意后,收集本医院烧伤整形外科2013年2月至2014年1月期间整形手术中切除的6例增生性瘢痕组织。6例组织分离于患者四肢或腹部烧伤创面愈合后6个月~1年增生性瘢痕组织,患者年龄12~50岁,均无合并基础疾病并且瘢痕组织无溃疡现象。采用组织块法进行HSFBs分离与培养:用0.1 mol/L的磷酸盐缓冲液(PBS)清洗增生性瘢痕组织,剪成0.5 cm×0.5 cm×0.5 cm大小,浸泡于0.25% DispaseⅡ中,置于37℃恒温摇床中,120 r/min震荡2 h,用0.1 mol/L PBS反复洗涤,剪成1 mm3大小,接种于培养瓶中,于5%CO2,37℃培养箱中孵育4 h。加入含10%胎牛血清的DMEM液,待原代细胞生长成单层融合后进行传代培养。0.25%胰蛋白酶消化后分瓶传代。实验时应用第3代细胞。倒置显微镜下观察HSFBs生长形态。
1.3 HE染色 用PBS清洗制备好的细胞爬片15 min,将盖玻片按顺序依次放置于玻片架上,浸没于苏木素中15 min,移入盐酸酒精分化30 s,浸泡于伊红中3 min,流水冲洗至无色,依次放85%、95%酒精各自3 min,无水酒精脱水10 min,沾少量树脂滴于载玻片上,封片并晾干后放37℃恒温箱中烘烤,荧光显微镜采集图像。
1.4 HSFBs分组处理 将HSFBs细胞常规培养于10%胎牛血清DMEM培养液中,转染前一天对细胞进行传代,使其融合度为40%的时候进行转染。根据处理方法的不同将HSFBs细胞分为以下几组:①空白对照组:常规培养;②低浓度褪黑激素组:加入褪黑激素(用DMEM培养基配制成母浓度为0.1 mmol/L的母液)使其终浓度为10-5mmol/L,共同培养48 h;③中浓度褪黑激素组:加入褪黑激素使其终浓度为10-3mmol/L,共同培养48 h;④高浓度褪黑激素组:加入褪黑激素使其终浓度为0.1 mmol/L,共同培养48 h;⑤NVP-BEZ235处理组:加入NVP-BEZ235使其终浓度为1 μmol/L,共同培养48 h;⑥NVP-BEZ235+褪黑激素组:加入NVP-BEZ235使其终浓度为1 μmol/L,共同培养48 h,再加入褪黑激素,使其终浓度为0.1 mmol/L,共同培养48 h;⑦褪黑激素+siRNA-scramble组:按照瞬时转染试剂说明书,首先用无血清无抗生素的DMEM培养基稀释siRNA-scramble,充分混匀后加入Lipofectamine 2000,室温孵育15 min后加入细胞,继续培养24 h,再加入褪黑激素,使其终浓度为0.1 mmol/L,共同培养48 h;⑧褪黑激素+siRNA-PTEN组:首先用无血清无抗生素的DMEM培养基稀释siRNA-PTEN,其余步骤同⑦。
1.5 MTT法检测细胞增殖 分别取各组细胞,调整浓度为1×103个/mL接种于96孔板中,每孔体积为200 μL,每组细胞设置4个复孔,同时设置空白对照,各培养24 h、36 h、48 h和72 h。每孔加入20 μL 5 mg/mL溴化噻唑蓝四氮唑(MTT),37℃培养4 h后弃去培养基,加入150 μL DMSO,室温避光摇床震荡10 min,充分溶解结晶物。以空白孔为对照,酶标仪490 nm波长测定各孔吸光度值(OD值),OD值的大小表示细胞增殖能力的大小。
1.6 qRT-PCR检测细胞中PTEN、CyclinD1和Caspase-3 mRNA表达 收集各组细胞,根据按照GREEN spin组织/细胞RNA快速提取试剂盒说明书步骤提取总RNA。按照TaKaRa公司逆转录试剂盒Prime Script®RT Master Mix Perfect Real Time的操作说明书进行逆转录生成cDNA第一链。根据TaKa-Ra荧光定量PCR试剂盒操作说明,于荧光定量PCR仪上进行操作。设置PCR循环反应条件:95℃预变性30 s;95℃5 s,60℃34 s,40个循环。溶解曲线分析:95℃15 s,60℃60 s,95℃15 s。每次实验以相应融解曲线和2%琼脂糖凝胶电泳来判断扩增产物的特异性。全部反应结束后,FTC-3000实时荧光定量PCR仪附带的分析软件自动分析、计算出样品的△CT值,以比较域值法将其与同一样本内参基因β-actin的△CT值相比,即△△CT=待测基因△CT值-内参△CT值,而检测基因mRNA表达的相对量=2-△△CT。所用引物均有上海生工技术有限公司合成,引物序列见表1。

基因名称PTEN CyclinD1 Caspase-3 β-actin引物序列(5'-3') F:5'-CCTGGATACCGCAGCTAGGA-3' R:5'-GCGGCGCAATACGAATGCCCC-3' F:5'-GGAAGAGGACTACTGGATTGAC-3' R:5'-TCCATGTTGCAGAAAACCTTCA-3' F:5'-CCAGAACCGCAGTGAAGAGT-3' R:5'-GGGATAGATAAACAGGGAAAC-3' F:5'-GTAAAGACCTCTATGCCAACA-3' R:5'-GGACTCATCCTACTCCTGCT-3'
1.7 Western blot检测细胞中PTEN、CyclinD1、Caspase-3、p-Akt和p-mTOR表达 收获各组处理后的细胞,加入裂解液提取蛋白,BCA法总蛋白定量。取25 μg总蛋白上样,进行SDS-PAGE电泳,PVDF转膜,放入TBST配制5%的脱脂奶粉封闭液中,室温下约1 h,分别加一抗(所用的一抗稀释比例分别为PTEN抗体1:1 000、CyclinD1抗体1:2 000、Caspase-3抗体1:1 000、p-Akt抗体1:1 000和p-mTOR抗体1:1 000),4℃反应过夜,PBS洗膜5次,加辣根过氧化物酶标记二抗,室温孵育30 min,PBS洗膜5次。暗室中在PVDF膜上滴加适量的ECL染色,压片曝光,采用BIORAD GELDOC XR凝胶成像系统依次显影、定影,室温下晾干,胶片扫描,应用Image J软件分析灰度值。用目的蛋白条带与内参β-actin条带的灰度值比值表示各组样本目的蛋白的表达强度。
1.8 统计学方法 应用SPSS13.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,多组数据间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著差法(least significant difference,LSD),以P<0.05表示差异具有统计学意义。
2 结 果
2.1 HSFBs细胞形态学观察及HE染色 倒置相差显微镜观察HSFBs:呈长梭状,细胞核呈类圆形或是长椭圆形,核仁个数不等,细胞浆向两极突起,细胞排列不规则,数量增加后呈旋涡状分布(图1a)。细胞爬片HE染色:成纤维细胞为长梭形,胞浆为粉红色,胞核为淡蓝色,结合分离的组织来源,可证实此细胞为成纤维细胞(图1b)。
2.2 各剂量褪黑激素对HSFBs增殖的影响 与空白对照组比较,不同浓度褪黑激素处理均能够降低同一时间点OD值,并且呈现浓度依赖性,各组间差异具有统计学意义(P<0.05),见表2。
图1 HSFBs细胞形态观察及HE染色(×100)
表2 各组细胞不同时间在490 nm下OD值(±s)

表2 各组细胞不同时间在490 nm下OD值(±s)
组别空白对照组低浓度褪黑激素组中浓度褪黑激素组高浓度褪黑激素组检验值P值24 h 0.153±0.016 0.145±0.012a0.136±0.024ab0.124±0.017ac480.380 0.000 36 h 0.396±0.012 0.364±0.018a0.310±0.016ab0.285±0.011ac168.000 0.000 48 h 0.599±0.011 0.540±0.009a0.504±0.025ab0.475±0.016ac227.583 0.000 72 h 0.752±0.011 0.704±0.015a0.685±0.018ab0.526±0.017ac585.111 0.000
2.3 各剂量褪黑激素对PTEN及细胞周期相关蛋白CyclinD1、Caspase-3表达的影响 与空白对照组比较,不同浓度褪黑激素处理均能够逐渐增加细胞中PTEN和Caspase-3的基因表达和蛋白表达量,降低CyclinD1的基因表达和蛋白表达,并且呈现浓度依赖性,组间差异具有统计学意义(P<0.05),见图2。

图2 各剂量褪黑激素对PTEN、CyclinD1和Caspase-3表达的影响
2.4 各剂量褪黑激素抑制PI3k/AKt/mTOR信号通路的激活 与空白对照组比较,不同浓度褪黑激素处理均能够降低细胞中p-Akt和p-mTOR蛋白水平,并且呈现浓度依赖性,组间差异具有统计学意义(P<0.05),见图3。

图3 各剂量褪黑激素抑制PI3k/AKt/mTOR信号通路的激活
2.5 PI3k/AKt/mTOR信号通路参与褪黑激素调控HSFBs增殖 与空白对照组比较,NVP-BEZ235处理组细胞中OD值显著减小,细胞增殖受到抑制,同时细胞周期蛋白CyclinD1表达下降,凋亡相关蛋白Caspase-3表达增加,差异具有统计学意义(P<0.05),但对PTEN表达无影响。与高浓度褪黑激素组比较,NVP-BEZ235+褪黑激素组OD值明显减小,细胞增殖受到严重抑制,同时CyclinD1表达下降,Caspase-3表达增加,差异具有统计学意义(P<0.05),但对PTEN的表达无影响,见表3和图4。
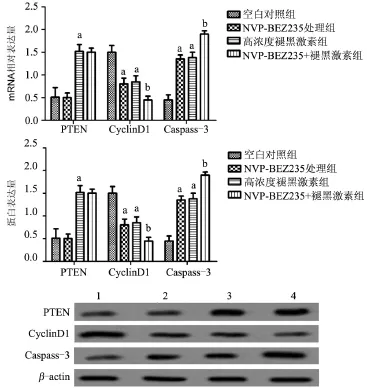
图4 Western blot检测各组细胞中PTEN、CyclinD1和Caspase-3表达
2.6 沉默PTEN拮抗褪黑激素对PI3k/AKt/ mTOR信号通路的抑制 与高浓度褪黑激素组比较,褪黑激素+siRNA-PTEN组细胞中p-PI3k和p-mTOR蛋白水平显著增加,差异有统计学意义(P<0.05),见图5。
表3 各组细胞不同时间在490 nm下OD值(±s)

表3 各组细胞不同时间在490 nm下OD值(±s)
注:与空白对照组比较,aP<0.05,与高浓度褪黑激素组比较,bP<0.05。
组别空白对照组NVP-BEZ235处理组高浓度褪黑激素组NVP-BEZ235+褪黑激素组检验值P值24 h 0.153±0.016 0.130±0.012a0.124±0.017a0.091±0.012b1 615.200 0.000 36 h 0.396±0.012 0.290±0.018a0.285±0.011a0.190±0.016b1 449.333 0.000 48 h 0.599±0.011 0.482±0.021a0.475±0.016a0.320±0.018b2 356.755 0.000 72 h 0.752±0.011 0.531±0.016a0.526±0.017a0.402±0.011b945.333 0.000
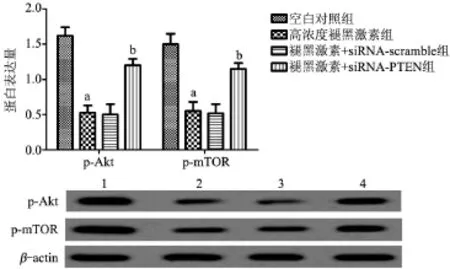
图5 Western blot检测各组细胞中p-PI3k和p-mTOR蛋白水平
3 讨 论
增生性瘢痕是烧伤、创伤和手术后常见的并发症,是创伤皮肤的病理性愈合过程,但目前仍缺乏治疗增生性瘢痕的有效方法[9],因此,深入了解增生性瘢痕的发病机制,寻求治疗增生性瘢痕的手段仍是目前急需解决的重点问题之一[10]。创伤愈合过程中HSFBs的异常增殖是目前比较公认的发病机制[11]。因此,抑制HSFBs的过度增殖将能够有效控制增生性瘢痕的形成,成为治疗瘢痕的有效手段。
褪黑激素是由松果体分泌的一种神经内分泌激素[12]。各种实验表明,褪黑激素能有效抑制多种恶性肿瘤肿瘤的发生、发展,例如乳腺癌、前列腺癌、结肠癌、肺癌等,同时研究表明褪黑激素抑制肿瘤的机制可能与抑制肿瘤细胞增殖诱导凋亡有关[13-15]。此外,研究发现褪黑激素能抑制细胞增殖通过阻止下游CyclinD1的表达使细胞进入S期[16]。本研究中发现不同浓度剂量的褪黑激素均能够抑制HSFBs增殖,增加PTEN的表达量,同时抑制细胞周期相关蛋白CyclinD1表达,上调细胞凋亡相关蛋白Caspase-3的表达,并且呈现剂量依赖性关系。这表明外源性补充褪黑激素能够有效抑制HSFBs细胞增殖,调控细胞周期。对其作用机制进一步研究发现,不同剂量褪黑激素均能够下调p-Akt和p-mTOR蛋白水平,这表明褪黑激素抑制细胞增殖可能与抑制PI3k/AKt/mTOR信号通路激活有关。
在介导细胞凋亡的信号通路中,PI3k/AKt/mTOR信号转导对凋亡的调节作用尤其重要[17]。已经证实该通路的活化可以抑制多种刺激诱发的细胞凋亡,促进细胞周期进展,从而促进细胞的生存和增殖[18]。在本研究中,与空白对照组比较,NVP-BEZ235处理组细胞增殖严重受到抑制,CyclinD1表达量降低,Caspase-3的表达量增加,同时与高浓度褪黑激素组比较,NVP-BEZ235+褪黑激素组中细胞增殖显著被抑制,CyclinD1表达量显著降低,Caspase-3的表达量显著增加。这表明PI3k/AKt/mTOR信号参与了HSFBs增殖与凋亡的调节,同时证实了褪黑激素通过抑制PI3k/AKt/mTOR信号通路的激活从而抑制HSFBs细胞增殖。
PTEN是一种具有双特异磷酸酶活性的抑癌基因,可以通过对细胞周期及凋亡的调控,从而调节细胞的正常生长与发育[19]。以往研究表明,PTEN缺失能够导致PI3k/AKt通路的活化,同时AKt通过活化mTOR增加CyclinD1 mRNA翻译,参与细胞周期的调节[20]。本研究中发现,沉默PTEN表达之后,细胞中p-Akt和p-mTOR表达增加,拮抗了褪黑激素对PI3k/ AKt/mTOR信号通路的抑制作用。这表明褪黑激素通过调控PTEN的表达抑制PI3k/AKt/mTOR信号通路的激活,进一步抑制HSFBs过度增殖。
综上所述,褪黑激素能够抑制HSFBs增殖,抑制细胞周期蛋白CyclinD1表达,促进细胞凋亡蛋白Caspase-3的表达,这一作用是通过上调PTEN表达抑制PI3k/AKt/mTOR信号通路的激活而实现。这为临床上采用褪黑激素治疗增生性瘢痕提供了理论依据。
[1]李战,农晓琳,李佳荃,等.青蒿琥酯对增生性瘢痕成纤维细胞的抑制作用及机制探讨[J].中国药理学通报,2014;30(7):947-51.
[2]李万同,柳大烈,刘晓燕,等.汉防己甲素对增生性瘢痕成纤维细胞基质金属蛋白酶I合成的影响[J].中国临床康复,2015,9(10): 106-107.
[3]吴登艳,邓娅,赫进,等.PI3K/AKT/mTOR信号通路介导黄芩苷抑制增生性瘢痕组织成纤维细胞的增殖[J].中国生物化学与分子生物学报,2014,30(1):60-67.
[4]杜高伟,谢有福,张俊成.褪黑素与增生性瘢痕的研究进展[J].医学综述,2012,18(1):16-18.
[5]Hill SM,Blask DE,Xiang S,et al.Melatonin and associated signaling pathways that control normal breast epithelium and breast cancer [J].J Mammary Gland Biol Neoplasia,2011,16(3):235-245.
[6]Messina G,Lissoni P,Marchiori P,et al.Enhancement of the efficacy of cancer chemotherapy by the pineal hormone melatonin and its relation with the psychospiritual status of cancer patients[J].J Res Med Sci,2010,15(4):225-228.
[7]Padillo FJ,Ruiz-Rabelo JF,Cruz A,et al.Melatonin and celecoxib improve the outcomes in hamsters with experimental pancreatic cancer[J].J Pineal Res,2010,49(3):264-270.
[8]Hu W,Ma Z Jiang S,et al.Melatonin:the dawning of a treatment for fibrosis?[J].J Pineal Res,2016,60(2):121-131.
[9]Zhang Y,Shan S,Wang J,et al.Galangin inhibits hypertrophic scar formation via ALK5/Smad2/3 signaling pathway[J].Mol Cell Biochem,2016,413(1-2):109-118.
[10]Lorden ER,Miller KJ,Ibrahim MM,et al.Biostable electrospun microfibrous scaffolds mitigate hypertrophic scar contraction in an immune-competent murine model[J].Acta Biomater,2016,32:100-109.
[11]Li B,Gao C,Diao JS,et al.Aberrant Notch signalling contributes to hypertrophic scar formation by modulating the phenotype of keratinocytes[J].Exp Dermatol,2016,25(2):137-142.
[12]Evely KM,Hudson RL,Dubocovich ML,et al.Melatonin receptor activation increases glutamatergic synaptic transmission in the rat medial lateral habenula[J].Synapse,2016,70(5):181-186.
[13]Erdemli HK,Akyol S,Armutcu F,et al.Melatonin and caffeic acid phenethyl ester in the regulation of mitochondrial function and apoptosis:The basis for future medical approaches[J].Life Sci,2016, 148:305-312.
[14]Pinato DJ,Stebbing J.Melatonin:resetting the clock of cancer progression?[J].Lancet Oncol,2016,17(1):23-24.
[15]Ziolko E,Kokot T,Skubis A,et al.The profile of melatonin receptors gene expression and genes associated with their activity in colorectal cancer:a preliminary report[J].J Biol Regul Homeost Agents,2015,29(4):823-828.
[16]Dauchy RT,Hoffman AE,Wren-Dail MA,et al.Daytime blue light enhances the nighttime circadian melatonin inhibition of human prostate cancer growth[J].Comp Med,2015,65(6):473-485.
[17]Lin Z,Mei H,Fan J,et al.Effect of the dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 against human Merkel cell carcinoma MKL-1 cell[J].Oncol Lett, 2015,10(6):3663-3667.
[18]Lu D,Qian J,Li W,et al.Beta-hydroxyisovaleryl-shikonin induces human cervical cancer cell apoptosis via PI3K/AKT/mTOR signaling [J].Oncol Lett,2015,10(6):3434-3442.
[19]Khan I,Ansari IA,Singh P,et al.Prediction of functionally significant single nucleotide polymorphisms[SNPs]in PTEN tumor suppressor gene:An in silico approach[J].Biotechnol Appl Biochem, 2016,doi:10.1002/bab.1483.
[20]Yu X,Li R,Shi W,et al.Silencing of MicroRNA-21 confers the sensitivity to tamoxifen and fulvestrant by enhancing autophagic cell death through inhibition of the PI3K-AKT-mTOR pathway in breast cancer cells[J].Biomed Pharmacother,2016,77:37-44.
Study on the effect and mechanism of melatonin on proliferation of fibroblasts in hypertrophic scar.
MU Sheng-zhi1,KANG Bei2,SUN Yao-wen1,WANG Guo-dong1,XU Zi-han1.Department of Burns and Plastic Surgery1,the Second Department of Neurology2,Shaanxi Provincial People's Hospital,Xi'an 710068,Shaanxi,CHINA
Objective To study the effect and mechanism of melatonin on proliferation of fibroblasts in human hypertronhic scar.MethodsThe human skin hypertrophic scar(HSFBs)specimens were collected.Fibroblasts from hypertrophic scar were isolated by tissue culturing method.HSFBs were divided into different groups:blank control group,low concentration melatonin group,middle concentration melatonin group,high concentration melatonin group, NVP-BEZ235 treatment group,NVP-BEZ235+melatonin group,melatonin+siRNA-PTEN group,melatonin+siRNA-scramble group.Cells proliferation was detected by MTT.The expression of phosphatase and tensin homolog (PTEN),CyclinD1,Caspase-3 as well as the protein levels of PI3k/AKt/mTOR pathway related protein p-Akt and p-mTOR were detected by quantitative real-time polymerase chain reaction(qRT-PCR)and western blot respectively.ResultsCompared with the blank control group,from the low to high concentrations of melatonin can significantly decrease the OD value of HSFBs cells at the same time,increase the expression of PTEN and Caspase-3,meanwhile inhibited the expression levels of Cyclind1,p-Akt and p-mTOR,with statistically significant differences between the four groups(P<0.05).Compared with the high concentration melatonin group,the cell proliferation was significantly inhibited in the NVP-BEZ235+melatonin group,and the difference was statistically significant(P<0.05).The inhibitory effect of melatonin+siRNA-PTEN group on HSFBs cell proliferation and PI3K/Akt/mTOR signaling pathway was observed, and the difference was statistically significant(P<0.05).ConclusionMelatonin could inhibit HSFB cells proliferation by upregulating the expression of PTEN and inhibiting the activation of PI3K/Akt/mTOR signaling pathways.
Melatonin;Phosphatase and tensin homolog(PTEN);PI3k/AKt/mTOR signaling pathways;Cell proliferation
R75
A
1003—6350(2016)18—2927—05
10.3969/j.issn.1003-6350.2016.18.002
2016-03-11)
孙要文。E-mail:shidasda@163.com

