脂多糖通过上调长正五聚蛋白3的表达参与钙化性主动脉瓣膜病的发生发展过程*
梅 黎, 汪 洋, 李 飞, 李 平, 苏 伟△, 张凯伦△, 刘晓斌
1华中科技大学同济医学院附属协和医院心血管外科,武汉 430022
2安徽省立医院心血管外科,合肥 230001
论著
脂多糖通过上调长正五聚蛋白3的表达参与钙化性主动脉瓣膜病的发生发展过程*
梅黎1#,汪洋1,2#,李飞1,李平1,苏伟1△,张凯伦1△,刘晓斌1
1华中科技大学同济医学院附属协和医院心血管外科,武汉430022
2安徽省立医院心血管外科,合肥230001
摘要:目的探讨脂多糖(LPS)上调主动脉瓣膜间质细胞(AVICs)表达长正五聚蛋白3(PTX3),在钙化性主动脉瓣膜病(CAVD)发生发展过程中的作用。方法体外培养AVICs,用不同浓度LPS(0、50、100、200 ng/mL)干预AVICs 48 h,蛋白免疫印迹法检测PTX3、骨形态发生蛋白2(BMP2)、骨桥蛋白(OPN)的表达;采用PTX3靶向小干扰RNA(PTX3 siRNA)转染AVICs沉默PTX3 72 h,蛋白免疫印迹法检测PTX3的表达;PTX3 siRNA转染AVICs 48 h后再给予LPS(200 ng/mL)干预AVICs,蛋白免疫印迹法检测BMP2、OPN的表达。结果①不同浓度LPS干预AVICs表达PTX3、BMP2、OPN均呈浓度依赖性增加,LPS浓度达200 ng/mL时,PTX3、BMP2、OPN的表达与对照组比较均显著增加(均P<0.01);②PTX3 siRNA组与对照组比较可有效沉默PTX3的表达(P<0.01);③与对照组比较,LPS+PTX3 siRNA组AVICs成骨因子的表达明显减少(P<0.05)。结论LPS可刺激AVICs表达PTX3,从而促进AVICs表达BMP2、OPN,PTX3参与了CAVD的发生发展过程。
关键词:钙化性主动脉瓣膜病;长正五聚蛋白3;脂多糖
主动脉瓣膜钙化及钙化导致的主动脉瓣膜狭窄在临床上均较常见。在西方国家,年龄大于65岁的成年人中,大约有2.5%的人呈现主动脉瓣膜不同程度的狭窄,其中一些人需要行主动脉瓣膜置换手术治疗[1]。近十年来,越来越多的研究证实主动脉瓣膜钙化并不是被动的退行性变,而是成骨样分化的主动调节过程,其病理生理过程包括脂质沉积、慢性炎症、瓣膜间质细胞向成骨样细胞转化等[2-3]。
长正五聚蛋白3(PTX3)属于正五聚蛋白家族成员,又称肿瘤坏死因子刺激基因14(tumor necrosis factor-stimulated gene14,TSG14),是一种典型的急性期蛋白[4]。PTX3作为唯一的可溶性模式识别受体,可以结合多种可溶性受体配体,参与免疫防御、炎症、细胞凋亡及多种心血管疾病[5]。研究表明,PTX3可比C反应蛋白(C-reactive protein,CRP)更迅速地反映组织局部的炎症及损伤,有望成为临床更为敏感的血清学标志而受到重视。2010年Naito等[6]首次报道了84例因主动脉狭窄或主动脉反流而接受手术的患者,并发现其组织和血浆中的PTX3水平呈正相关,推测PTX3可能参与了主动脉瓣狭窄的病理生理过程,研究表明,除年龄之外,PTX3是非主动脉瓣膜狭窄型钙化性主动脉瓣膜病的一个独立的预测因子。目前关于PTX3在钙化性主动脉瓣膜病(CAVD)中的研究仍相对较少,故本研究通过脂多糖(LPS)体外干预主动脉瓣膜间质细胞(AVICs),检测PTX3及骨形态发生蛋白(BMP2)、骨桥蛋白(Osteopontin,OPN)的表达变化。通过沉默PTX3,用LPS干预以观察PTX3对AVICs表达成骨因子的调节作用,探讨其信号通路。
1材料与方法
1.1主要药品与试剂
胎牛血清(Gibco公司);脂多糖(Sigma公司);PTX3抗体(Santa Cruz公司);BMP2、OPN抗体(Abcom公司);α-SMA、Vimentin抗体(武汉博士德生物工程有限公司);Ⅰ型胶原酶(Sigma公司);小干扰RNA(广州市锐博生物科技有限公司);Opti-MEM、Lipo2000(美国Invitrogen公司)。
1.2AVICs原代分离和培养
按照文献中的方法分离培养瓣膜间质细胞[7],取主动脉夹层术后或心脏移植术后主动脉瓣膜,用无菌PBS反复冲洗瓣膜。将冲洗后的主动脉瓣膜置于浓度为0.2%Ⅰ型胶原酶中,37℃培养箱中消化30 min,每10 min振荡1次,除去上清,将剩余的瓣膜组织仍然置于0.2%Ⅰ型胶原酶中,37℃培养箱中继续消化12~18 h后重悬于10%胎牛血清完全培养液中培养,待细胞贴壁生长后,适时传代培养,每2~3 d换液1次,取2~5代细胞用于实验。
1.3AVICs免疫荧光鉴定
消化AVICs接种于6孔板载玻片上,待细胞密度达60%~70%融合度时,终止细胞培养,取出爬片,4%多聚甲醛固定20 min,PBS漂洗3次;1%胎牛血清白蛋白(BSA)封闭30 min;分别滴加1%BSA稀释的一抗(Vimentin,α-SMA及vWF),4℃过夜,PBS漂洗3次。滴加1%BSA稀释的二抗,37℃避光孵育1 h后PBS漂洗3次。5 μg/mL DAPI染色2 min,封片后荧光显微镜下观察。
1.4目的蛋白Western blot检测
预冷的PBS清洗细胞2次,加入适量细胞裂解液,用细胞刮迅速刮下细胞,收集至EP管,振荡,离心,收集总蛋白。取30 μg总蛋白12%SDS-聚丙烯酰胺凝胶电泳,电转膜至PVDF膜,使用含5%脱脂奶粉的TBST浸泡PVDF膜,室温摇床封闭1 h。分别加入一抗4℃过夜。TBST洗膜3次,每次10 min。目的蛋白加入二抗,孵育1 h。TBST洗膜3次,每次10 min,ECL发光试剂显影,结果使用凝胶成像分析系统测定,各条带与β-actin的灰度值之比为目的蛋白表达相对含量。
1.5细胞转染
将细胞消化后接种于6孔板,待细胞融合度达30%~50%时行细胞转染。分别取250 μL Opti-MEM于2个EP管,其中一个EP管加入5 μL Lipo 2000(A液),另一个EP管加入10 μL siRNA(B液),吹打3~5次混匀,室温放置5 min。将A液与B液混合,吹打使其充分混匀,室温放置20 min。移除6孔板中培养液,加入1 500 μL Opti-MEM,并加入上述配制好的混合溶液500 μL,共计2 mL,使siRNA的终浓度为100 nmol/L,轻轻摇晃6孔板,混匀后放入培养箱进行培养。4~6 h后换液,72 h后提取总蛋白,Western blot检测沉默效果。
1.6统计学分析
2结果
2.1AVICs免疫荧光鉴定
AVICs是心脏瓣膜组织中主要的细胞类型,瓣膜表面尚有少量的瓣膜内皮细胞。按上述方法分离原代细胞后,贴壁细胞中几乎不含瓣膜内皮细胞,此外,在AVICs贴壁生长的过程中,AVICs生长迅速可抑制瓣膜内皮细胞的生长。瓣膜间质细胞呈现梭形或多边形,在特异性标记物上,瓣膜间质细胞表达Vimentin及α-SMA(图1),图1表明用上述方法提取的为瓣膜间质细胞。
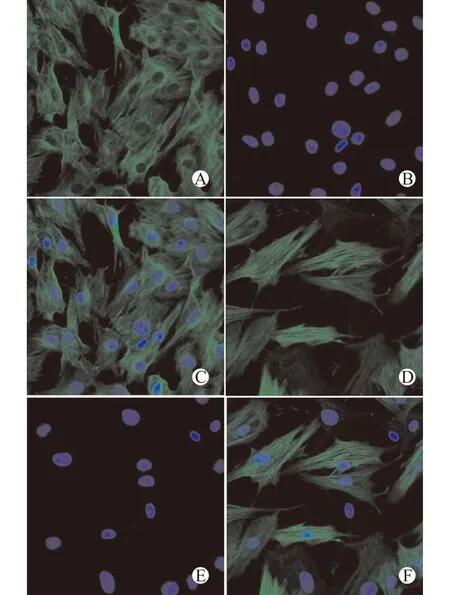
A:抗Vimentin免疫荧光染色,Vimentin表达(+);B:DAPI细胞核染色,呈现蓝色;C:A与B合成图;D:抗α-SMA免疫荧光染色,α-SMA表达(+);E:DAPI细胞核染色,呈现蓝色;F:D与E合成图图1 AVICs标记物Vimentin及α-SMA染色(×400)Fig.1 Staining of AVICs markers Vimentin and α-SMA (×400)
2.2不同浓度LPS刺激AVICs表达PTX3
Naito等[6]报道在瓣膜间质细胞中发现有PTX3的表达,但目前对于瓣膜间质细胞能否通过LPS的干预表达PTX3尚未见文献报道。采用第2~4代细胞接种于6孔板中,待细胞生长至80%~90%融合度时,用不同浓度LPS(0、50、100、200 ng/mL)刺激AVICs 48 h,每组设置3个复孔,实验经过3次验证,Western blot检测PTX3的表达情况,结果显示AVICs表达PTX3较正常培养组明显增多(P<0.05),并随LPS浓度增加呈现浓度依赖性增加,LPS(100 ng/mL、200 ng/mL)较正常培养组显著增多(均P<0.01),见图2。
2.3不同浓度LPS刺激AVICs表达成骨因子BMP2、OPN
正常瓣膜间质细胞表达少量成骨因子(BMP2、OPN),但当瓣膜间质细胞由静止状态转化为激活状态后,细胞表达BMP2、OPN明显增多,用不同浓度LPS(0、50、100、200 ng/mL)刺激VIC 48 h,每组设置3个复孔,实验经过3次验证,Western blot检测BMP2、OPN的表达情况,结果显示LPS浓度为50 ng/mL时,AVICs表达BMP2较正常培养组明显增多(P<0.05),LPS(100 ng/mL、200 ng/mL)干预AVICs时,BMP2、OPN较正常培养组均显著增多(均P<0.01),见图3。
2.4PTX3 siRNA转染AVICs后可有效沉默PTX3
采用第2~4代细胞接种于6孔板,使接种于6孔板中的细胞密度达到30%~50%融合度,并于细胞接种达24 h左右时进行细胞转染,按照上述方法进行细胞转染实验。设立空白对照组,Scramble siRNA转染组及PTX3 siRNA转染组,每组设置3个复孔,实验经过3次验证,转染完成后继续培养72 h,收集6孔板中蛋白,进行Western blot检测PTX3表达情况,检测PTX3 siRNA的沉默效果。与空白对照组及Scramble siRNA转染组比较,PTX3 siRNA转染组表达PTX3水平显著减少(P<0.01),见图4。

A:空白对照组;B:50 ng/mL LPS干预组;C:100 ng/mL LPS干预组;D:200 ng/mL LPS干预组;*P<0.05**P<0.01图2 不同浓度LPS干预后PTX3的表达呈剂量依赖性增加Fig.2 A dose-dependent increase of PTX3 stimulated by different concentrations of LPS
2.5LPS通过刺激AVICs表达PTX3并促进成骨因子BMP2、OPN的表达
实验设立Scramble siRNA转染组、100 ng/mL LPS干预组、Scramble siRNA+100 ng/mL LPS干预组、PTX3 siRNA+100 ng/mL LPS干预组,Scramble siRNA、PTX3 siRNA转染AVICs 48 h后,给予100 ng/mL LPS干预48 h,每组设置3个复孔,实验经过3次验证,收集6孔板中蛋白,进行Western blot检测BMP2、OPN的表达情况。结果显示(图5),100 ng/mL LPS干预组、Scramble siRNA+100 ng/mL LPS干预组均比Scramble siRNA转染组表达明显增高(均P<0.05),而PTX3 siRNA+100 ng/mL LPS干预组较Scramble siRNA+100 ng/mL LPS干预组表达明显减少(P<0.05)。

A、E:空白对照组;B、F:50 ng/mL LPS干预组;C、G:100 ng/mL LPS干预组;D、H:200 ng/mL LPS干预组;*P<0.05**P<0.01图3 不同浓度LPS干预后BMP2、OPN的表达呈剂量依赖性增加Fig.3 A dose-dependent increase of BMP2 and OPN expression after treatment with different concentrations of LPS

A:空白对照组;B:Scramble siRNA转染组;C:PTX3 siRNA转染组;**P<0.01图4 PTX3 siRNA可有效降低细胞内PTX3水平Fig.4 PTX3 siRNA effectively reduced cellular PTX3 levels
3讨论
主动脉瓣钙化可引起主动脉瓣狭窄、关闭不全等,从而导致血流动力学的改变,是导致老年退行性心瓣膜病的重要病理改变[8]。在生理条件下瓣膜间质细胞处于静息状态,当处于异常血流动力学环境或在其他病理条件刺激下,间质细胞可能向增殖、收缩甚至钙化等表型转化,导致瓣膜结缔组织过度增生、粘连、钙化等病理改变以及瓣膜细胞营养失衡等,进而引起心脏瓣膜狭窄、关闭不全等临床表现,严重危害人类健康。
脂多糖是革兰阴性杆菌细胞壁的主要成分,慢性牙周感染在钙化性主动脉瓣膜病的发生发展过程中有重要作用[9],研究表明,在病变的主动脉瓣膜中发现口腔细菌,以及用口腔细菌接种实验兔子,可诱导其产生主动脉瓣膜病变[10],慢性口腔感染可能是主动脉瓣钙化及狭窄发病的重要诱因之一。脂多糖可作用于细胞膜受体如Toll2受体或Toll4受体,并激活多种下游信号蛋白,通过多种信号通路最终上调瓣膜间质细胞成骨因子的表达,促使瓣膜间质细胞向成骨细胞表型转化,参与钙化性主动脉瓣膜病的发生发展过程[11-12]。

A、E:Scramble siRNA转染组;B、F:100 ng/mL LPS干预组;C、G:Scramble siRNA+100 ng/mL LPS干预组;D、H:PTX3 siRNA+100 ng/mL LPS干预组;*P<0.05图5 沉默PTX3后显著降低LPS诱导的细胞内BMP2、OPN水平Fig.5 Silencing PTX3 markedly reduced cellular BMP2 and OPN levels after treatment with LPS
PTX3在炎症剌激下,由多种细胞产生(主要包括DCs、巨噬细胞、成纤维细胞、活化的内皮细胞等)[13-14]。目前PTX3血浆水平异常己被证实与多种心血管及相关疾病有关[6,15-18]。有研究建立了PTX3-/-基因的小鼠模型与心脏特异性高表达PTX3的转基因小鼠模型,经过对其进行主动脉缩窄手术处理后发现,与对照组相应野生型同窝生小鼠比较,PTX3的转基因小鼠IL-6和结缔组织生长因子的产生增多,同时,不良心肌重塑、左心室功能障碍、心肌间质纤维化增强;而PTX3-/-小鼠反之。该研究结果表明,在后负荷增加后局部炎症介质PTX3直接诱导心肌肥厚、左心室功能障碍,促进心力衰竭的发生、发展过程[19]。另有研究认为,PTX3作为先天性免疫中可溶性模式识别受体,可能通过先天性免疫反应促进了动脉粥样斑块的进展,还可能减少单核细胞和内皮细胞表达组织因子而促进血栓形成[15]。
我们的研究通过LPS体外诱导瓣膜间质细胞,Western blot检测PTX3及成骨因子的表达,结果发现其表达呈现浓度依赖性增加。通过构建以PTX3基因为靶向的RNA干扰重组体,通过RNA干扰技术沉默瓣膜间质细胞中PTX3基因的表达,沉默效率检测显示,可有效沉默PTX3。沉默PTX3后,用LPS干预瓣膜间质细胞,Western blot检测成骨因子表达的变化。实验结果表明,沉默PTX3后,成骨因子表达明显减少。因此提示LPS通过上调瓣膜间质细胞中PTX3的表达,进而调节成骨因子表达,促使瓣膜间质细胞向成骨样表型转化,以此参与钙化性主动脉瓣膜病的发病机制。该研究表明,LPS诱导的主动脉瓣膜钙化可能与PTX3高表达存在相关性,PTX3可能促进了主动脉瓣膜的钙化。该研究为未来寻找新的药物预防及治疗该疾病提供了新的作用靶点及理论基础,对减少该疾病的发病率,提高治愈率有重要意义。但是,LPS如何调节PTX3的表达及PTX3如何导致瓣膜间质细胞表达成骨因子增多的信号通路还有待进一步研究。
参考文献
[1]Lloyd-Jones D,Adams R J,Brown T M ,et al.Heart disease and stroke statistics,2010 update:a report from the American Heart Association[J].Circulation ,2010 ,121(7):e46-e215.
[2]Rajamannan N M,Evans F J,Aikawa E,et al.Calcific aortic valve disease: not simply a degenerative process: a review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group.Executive summary: calcific aortic valve disease-2011 update[J].Circulation,2011,124(16):1783-1791.
[3]Miller J D,Weiss R M,Heistad D D,et al.Calcific aortic valve stenosis: methods,models,and mechanisms[J].Circ Res,2011,108(11):1392-1412.
[4]Garlanda C,Bottazzi B,Bastone A,et al.Pentraxins at the crossroads between innate immunity,inflammation,matrix deposition,and female fertility[J].Annu Rev Immunol,2005,23(1):337-366.
[5]Nauta A J,de Haij S,Bottazzi B,et al.Human renal epithelial cells produce the long pentraxin PTX3[J].Kidney Int,2005,67(2):543-553.
[6]Naito Y,Tsujino T,Akahofi H,et al.Increase in tissue and circulating pentraxin3 levels in patients with aortic valve stenosis[J].Am Heart J,2010,160(4):685-691.
[7]陈思,董念国,史嘉玮,等.主动脉瓣膜间质细胞体外诱导钙化的实验研究[J].中国胸心血管外科临床杂志,2010,17(5):385-389.
[8]Zigelman C Z,Edelstein P M.Aortic valve stenosis[J].Anesthesiol Clin,2009,27(3):519-532.
[9]Nakano K,Nemoto H,Nomura R,et al.Detection of oral bacteria in cardiovascular specimens[J].Oral Microbiol Immunol,2009,24(1):64-68.
[10]Cohen D J,Malave D,Ghidoni J J,et al.Role of oral bacterial flora in calcific aortic stenosis: an animal model[J].Ann Thorac Surg,2004,77(2):537-543.
[11]Zeng Q C,Song R,Ao L H,et al.Notch1 promotes the pro-osteogenic response of human aortic valve interstitial cells via modulation of ERK1/2 and nuclear factor-κB activation[J].Arterioscler Thromb Vasc Biol,2013,33(7):1580-1590.
[12]Deng X S,Meng X Z,Zeng Q C,et al.Adult aortic valve interstitial cells have greater responses to toll-like receptor 4 stimulation[J].Ann Thorac Surg,2015,99 (1):62-71.
[13]Klouche M,Peri G,Knabbe C,et al.Modified atherogenic liposproteins induce expression of pentraxin3 by human vascular smooth muscle cell[J].Atherosclerosis,2004,175(2):221-228.
[14]Dos Santos C C,Han B,Andrade C F,et a1.DNA microarray analysis of gene expression in alveolar epithelial cells in response to TNFalpha,LPS,and cyclic stretch[J].Physiol Genomics,2004,19(3):331-342.
[15]Norata G D,Marchesi P,Pulakazhi Venu V K,et al.Deficiency of the long pentraxin PTX3 promotes vascular inflammation and atherosclerosis[J].Circulation,2009,120(8): 699-708.
[16]Souza D G,Amaral F A,Fagundes C T,et al.The long pentraxin PTX3 is crucial for tissue inflammation after intestinal ischemia and reperfiision in mice[J].Am J Pathol,2009,174(4): 1309-1318.
[17]谢艳萍,辅桓钦,郭慧慧,等.MiR-155对LPS信号通路的调节及其机制[J].华中科技大学学报:医学版,2015,44(4):416-418,428.
[18]Matsubara J,Sugiyama S,Nozaki T, et al.Pentraxin 3 is a new inflammatory marker correlated with left ventricular diastolic dysfunction and heart failure with normal ejection fraction[J].J Am Coll Cardiol,2011,57(7): 861-869.
[19]Jenny N S,Arnold A M,Kuller L H,et al.Associations of pentraxin 3 with cardiovascular disease and all-cause death: the cardiovascular health study[J].Arterioscler Thromb Vase Biol,2009,29(4):594-599.
(2015-09-23收稿)
Lipopolysaccharide Participates in the Pathogenesis of Calcific Aortic Valve Disease by Upregulating the Expression of PTX3
Mei Li1#,Wang Yang1,2#,Li Fei1etal
1DepartmentofCardiovascularSurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China2DepartmentofCardiovascularSurgery,AnhuiProvincialHospital,Hefei230001,China
AbstractObjectiveTo examine the role of lipopolysaccharide(LPS)in the pathogenesis of calcific aortic valve disease(CAVD)and the possible mechanism involving the expression of long pentraxin PTX3.MethodsAortic valve interstitial cells(AVICs)were culturedinvitro,and treated with different concentrations of LPS(0,50,100,200 ng/mL)for 48 h.Western blot was used to detect the expression of PTX3,bone morphogenetic protein 2(BMP2)and osteopontin(OPN).Seventy-two h after transfection with PTX3 siRNA,PTX3 protein was detected in AVICs by Western blot.AVICs were cultured with PTX3 siRNA for 48 h before addition of LPS(200 ng/mL),and the levels of BMP2 and OPN were measured by immunoblotting.Results①Treatment with different concentrations of LPS caused an increased expression of PTX3,BMP2 and OPN in AVICs in a dose-dependent manner.There were significant differences in the expression of these proteins between 200 ng/mL LPS group and control group(P<0.01).②PTX3 siRNA transfection markedly decreased the level of PTX3 protein when compared with the control group(P<0.01).③BMP2 and OPN were significantly down-expressed in cells treated with LPS plus PTX3 siRNA when compared with the control group(P<0.05).ConclusionLPS stimulates AVICs to express PTX3,which promotes the expression of BMP2 and OPN.PTX3 is involved in the pathogenesis of CAVD.
Key wordscalcific aortic valve disease;long pentraxin PTX3;lipopolysaccharide
中图分类号:R542.5
DOI:10.3870/j.issn.1672-0741.2016.01.001
通讯作者△,Corresponding author,张凯伦,E-mail:prozkl@163.com;苏伟,E-mail:unionsuwei1998@163.com
*湖北省自然科学基金资助项目(No.2013CFB166)
#同为第一作者
梅黎,女,1989年生,硕士研究生,E-mail:1044127892@qq.com;汪洋,男,1989年生,医学硕士,E-mail:Jasonmasterwy@163.com

