微波催化剂MgFe2O4—Fe2O3微波
高令飞++蒋尊芳++周继承++殷诚++尹静雅��

摘 要:提出一种新型的、无需添加氧化剂处理结晶紫废水的方法.通过共沉淀晶化法制备微波催化剂MgFe2O4-Fe2O3,在微波辐照下降解结晶紫废水,考察了催化剂用量、微波功率、辐照时间对结晶紫去除率的影响.结果表明:在一定条件下,去除率随着催化剂用量的增加、微波功率的增大、微波辐照时间的延长而增加.当微波功率为800 W,辐照时间5 min,催化剂用量1 g/L时,处理200 mg/L的结晶紫废水,去除率可达99.3%.本文还对微波催化氧化机理进行了探究,通过添加不同氧化基团清除剂的实验发现,氧化基团清除剂的添加降低了结晶紫的去除率,并提出了该反应的微观机理:微波催化剂吸收电磁波发生光电效应, 产生电子和空穴对, 与水等作用产生·OH,·OH再氧化降解废水中的有机物.
关键词:微波催化; 微波催化剂; MgFe2O4-Fe2O3; 羟基自由基 (·OH); 结晶紫废水
中图分类号:TQ032 文献标识码:A
Degradation of Crystal Violet from Wastewater through
Microwave-Enhanced MgFe2O4-Fe2O3 Catalytic Oxidation
GAO Ling-fei, JIANG Zun-fang, ZHOU Ji-cheng, YIN Cheng, YIN Jing-ya
(Key Laboratory of Green Catalysis and Chemical Reaction Engineering in College of Hunan Province,
School of Chemical Engineering, Xiangtan Univ, Xiangtan, Hunan 411105,China)
Abstract: A new degradation method for crystal violet (CV) from wastewater was proposed without adding any oxidant. The microwave catalyst of MgFe2O4-Fe2O3 was obtained through co-precipitation crystallization method, and its degradation performance for the wastewater containing CV was systematically evaluated under microwave irradiation, including catalyst dosage, microwave power and irradiation time. The results indicated that microwave catalyst MgFe2O4-Fe2O3 displayes excellent catalytic activity, and degradation efficiency for CV from a 200 mg/L wastewater can be highly up to 99.3% with microwave power of 800 W, catalyst dosage of 1 g/L, and irradiation time of 5 min. In addition, the mechanism for the microwave catalytic oxidation degradation was preliminary discussed, and hydroxyl radical (·OH) generated during the catalytic reaction acted as the dominant oxidant for the degradation, demonstrating from the experiment of adding different oxides as removal agents. Under microwave irradiation, microwave catalyst can effectively absorb electromagnetic wave to produce photo-electric effects with generation of electron-hole pairs (e-cb+h+vb), which will react with H2O molecules to produce ·OH, and then the formed ·OH groups oxidation can degrade the organic compounds existing in wastewater. The proposed microwave catalytic oxidation degradation is a new method for highly efficient degradation of organic wastewater.
Key words:microwave catalytic; microwave catalyst; MgFe2O4-Fe2O3; hydroxyl radical (·OH); crystal violet (CV) from wastewate
结晶紫是一种芳香族化合物,其在染料、印刷及制药等领域运用广泛[ 1-3].结晶紫等染料工业废水具有色度深、可生化性差、难处理等特点,如果这些工业废水不加处理排入水体,将对水体产生严重的污染,并对人类的身体健康存在潜在的威胁[ 4].已报道处理结晶紫等染料废水的方法很多,比如吸附法[ 5],生物脱色法[ 6],声化学降解法[ 7],光催化降解法[ 8-9],电化学降解法[ 10],fenton氧化法[ 11]等,这些方法存在占地面积大、处理时间长和处理效果不理想等问题,因此开发高效快速、经济环保的结晶紫废水处理方法成为人们研究的目标.
微波是一种由电场和磁场组成的能量,与极性物质相互作用,能使极性分子高速旋转而产生热效应[ 12],能够降低反应的活化能和分子的化学键强度,进而加速化学反应.随着生态环境日益恶劣, 越来越多的研究人员将微波技术引入到废水、废气的处理中[ 13-14],在处理染料废水方面有微波诱导[ 15]、微波强化[ 16-17]等方法,认为是微波的诱导或强化作用氧化降解有机废水.我们[ 18-21]提出和建立了微波催化氧化降解方法,认为微波辐照在微波催化剂上的光电效应可产生电子和空穴对, 与水等作用产生·OH, ·OH再氧化降解反应液中的有机污染物. 并考察了以MgFe2O4-Fe2O3为催化剂的微波催化氧化降解过程中影响结晶紫废水去除率的主要因素, 得出最优化反应条件, 为工业结晶紫废水治理提供了新的方法.这一方法的应用选择与微波能很好匹配的微波催化剂是关键.
铁酸盐尖晶石是一类铁磁性物质,具有优良的吸收电磁波的能力,在微波处理有机废水方面有相关文献报道[22-23].Chen等[ 21]采用共沉淀法制备了CuFe2O4 催化剂,在微波辐照下处理低浓度结晶紫废水,取得了较好的去除效果.但铁酸盐(MgFe2O4)只在较高频率下( 1 GHz以上) 有较高的磁损耗,而Fe2O3在低频率下介电损耗较大[ 24], 因此,由MgFe2O4和Fe2O3 以适当比例适当形式复合而成的微波催化剂, 可望在微波频率范围内对电磁波具有更好的吸收性能及催化活性.本实验制备了比MgFe2O4或Fe2O3具有更高催化活性的MgFe2O4-Fe2O3,取得了很好地氧化降解结晶紫废水的效果.
1 实验部分
1.1 催化剂的制备与表征
将Fe(NO3)3·9H2O(分析纯,西陇化工有限公司)和Mg(NO3)3·6H2O(分析纯,天津科密欧有限公司)按2∶1的质量比加入到一定量水中,搅拌溶解后,滴加氨水(分析纯,西陇化工有限公司)直至pH值为10~11.高速搅拌2.5 h后,转移到聚四氟乙烯内衬的高压釜中于150 ℃下晶化15 h,抽滤洗涤,80 ℃干燥过夜,即得所需产品的前驱体,在300 ℃,500 ℃和700 ℃下煅烧.
XRD表征:采用日本理学Rigaku D/Max-2550型X射线衍射仪,CuKα射线源.扫描范围10°~90°,扫描步长0.01 min,管电压40 kV,管电流45 mA.
FT-IR红外表征:采用美国PE公司Spectrom One型傅里叶变换红外光谱仪测定样品的红外光谱,扫描范围:400~4 000 cm-1.制片中采用在中红外区没有吸收波的高纯KBr作稀释剂,待测样品的量与KBr的量之比约为1∶100.
1.2 实验过程
称取一定量的催化剂放入反应器中,加入100 mL 200 mg/L的结晶紫溶液,将反应器置于微波炉(Mars-5,美国CEM公司)中,微波辐照下反应液温度迅速升高至100 ℃保持不变,在不同条件下反应一定时间,离心分离,取上清液,用紫外可见光光度计在结晶紫最大吸收波长590 nm下测其吸光度.根据处理前后结晶紫的浓度计算去除率.
2 结果与讨论
2.1 催化剂的结构表征
2.1.1 XRD表征结果分析
MgFe2O4主要特征峰的2θ角为30.2°,35.5°,43.0°,53.5°,56.8°和62.5°.而Fe2O3的2θ角为24.3°,33.4°,41.0°,49.5°和64.3°.如图1所示,样a为300 ℃煅烧,图中所示主要是Fe2O3特征峰,并没有形成完整的MgFe2O4晶体结构;样b为500 ℃煅烧,同时出现了MgFe2O4和Fe2O3的特征峰;样c为 700 ℃煅烧,主要是MgFe2O4的特征峰,有极弱的Fe2O3的杂峰.因此,500 ℃煅烧样品记为MgFe2O4-Fe2O3.
2θ/(°)
图1 不同温度煅烧下样品的XRD图谱
Fig.1 XRD patterns of samples calcined
at different temperatures
2.1.2 MgFe2O4-Fe2O3红外表征结果分析
由图2可知,在571 cm-1处出现了Fe-O键的伸缩振动峰,1 640,3 440 cm-1处为·OH的振动峰.说明在MgFe2O4-Fe2O3的表面及晶格中有H2O及·OH基团,其能参与微波催化氧化反应过程,促进废水中有机物的氧化降解.
波数/cm-1
图2 MgFe2O4-Fe2O3的红外图谱
Fig.2 FT-IR spectrum of MgFe2O4-Fe2O3
2.2 不同反应工艺对结晶紫去除率的影响
设置微波功率为800 W,考察不同工艺条件下结晶紫的去除率及常温条件下结晶紫吸附率,结果如表1所示.单独微波辐照的条件下,结晶紫去除率仅为5.7%,说明单独微波辐照降解作用不明显,因为微波的能量不足以使化学键断裂.以MgFe2O4-Fe2O3为催化剂,常温条件下,吸附4 h的结晶紫去除率仅为28.8%;而微波辐照下反应5 min,结晶紫去除率即达99.3%,表明在微波辐照下反应数分钟,对结晶紫去除率起主要作用的不是吸附而是氧化降解;相同条件下,常规加热处理结晶紫废水的去除率远远低于微波辐照条件下的去除率,说明在微波辐照下降解结晶紫废水,不是单纯的热效应,而主要是微波的催化作用.微波发生催化作用,应筛选匹配的微波催化剂进行微波催化反应,此类催化剂应具有很强的吸波性能,具有较强的吸附水和有机物的特性.
2.3 微波催化反应的降解性能实验
2.3.1 微波催化剂用量对去除率的影响
设置微波功率为600 W,反应时间5 min,考察MgFe2O4-Fe2O3用量分别为0.4,0.6,0.8,1.0,1.5和2.0 g/L时,结晶紫的去除效果.如图3所示,一定条件下,结晶紫去除率随催化剂用量的增加而增加,当催化剂用量为1 g/L时,去除率达98.9%.因为微波与MgFe2O4-Fe2O3作用产生的·OH参与结晶紫氧化降解过程,即在确定的条件下,单位时间内微波催化作用产生的·OH数量是一定的,增加微波催化剂用量,就能使更多的催化剂参与微波催化作用,从而产生更多的·OH用于氧化降解结晶紫,因此结晶紫的降解效果就越好.
催化剂用量/(g·L-1)
2.3.2 微波功率、辐照时间对去除率的影响
催化剂用量为1 g/L,在微波功率分别为200 W,400 W,600 W和800 W下反应不同时间,其降解情况如图4所示.可知结晶紫的去除率随微波功率、反应时间的增大而增大.当微波功率从200 W增加至400 W时,去除率迅速增加;从600 W增至800 W时,去除率增加较缓.微波功率为800 W,反应时间为5 min时去除率达到了99.3%,因为微波功率越大,一定时间内,微波辐照产生的电磁波越多,从而微波与微波催化剂作用产生·OH数量就越多;而当微波功率、催化剂用量一定的情况下,单位时间内产生的·OH是一定的,因此辐照时间越长,产生的·OH越多,结晶紫的去除率就越大.
微波功率/W
2.3.3 废水初始浓度对去除率的影响
微波功率为800 W,催化剂用量为1 g/L,不同浓度的结晶紫溶液,在微波条件下反应5 min.降解情况如图5所示,可知结晶紫去除率随初始浓度的增加而有所降低.当结晶紫溶液的初始浓度为100 mg/L时,微波辐照5 min去除率为99.3%;浓度增至500 mg/L时,去除率降低至96%.因为在一定条件下,微波催化作用产生的·OH数量一定,浓度越高,溶液中结晶紫分子数量越多,氧化降解所需的·OH数量就越多,从而结晶紫去除率越低.
浓度/(mg·L-1)
图5 废水初始浓度对去除率的影响
Fig.5 Effect of the initial concentration
on the removal percentage
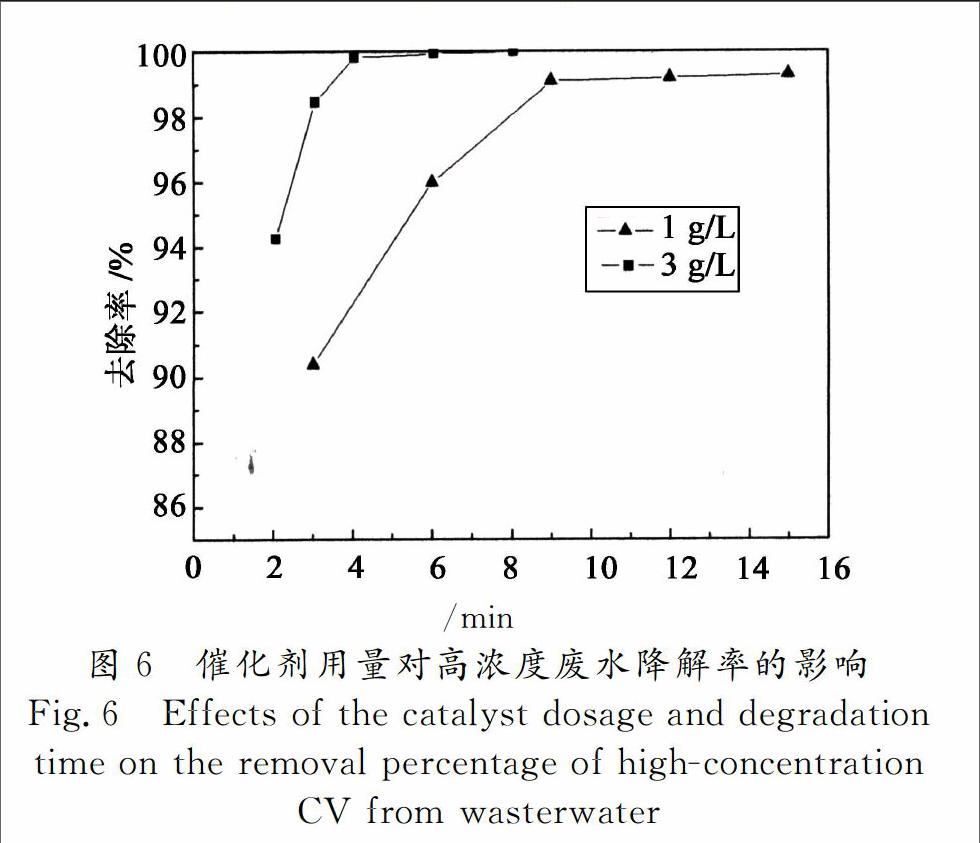
2.3.4 催化剂用量对高浓度废水降解率的影响
当微波功率为800 W,处理500 mg/L的高浓度结晶紫废水,取催化剂的用量分别为1 g/L和3 g/L时,对去除率的影响结果如图6所示.
/min
图6 催化剂用量对高浓度废水降解率的影响
Fig.6 Effects of the catalyst dosage and degradation
time on the removal percentage of high-concentration
CV from wasterwater
由图6可知,处理高浓度结晶紫废水,当催化剂用量为1 g/L时,微波辐照下反应15 min,去除率为99.3%;当催化剂的用量为3 g/L时,反应4 min,去除率即可达到99.6%.因为催化剂用量小时,微波催化作用产生的·OH少,氧化降解的速率低,延长反应时间才能达到很好的降解效果;当催化剂用量大时,微波催化作用产生的·OH多,氧化降解速率快,在较短时间内就能达到很好的去除效果.因此对高浓度结晶紫废水,可通过增加催化剂的用量,减少反应时间,即可达到较好的去除效果.
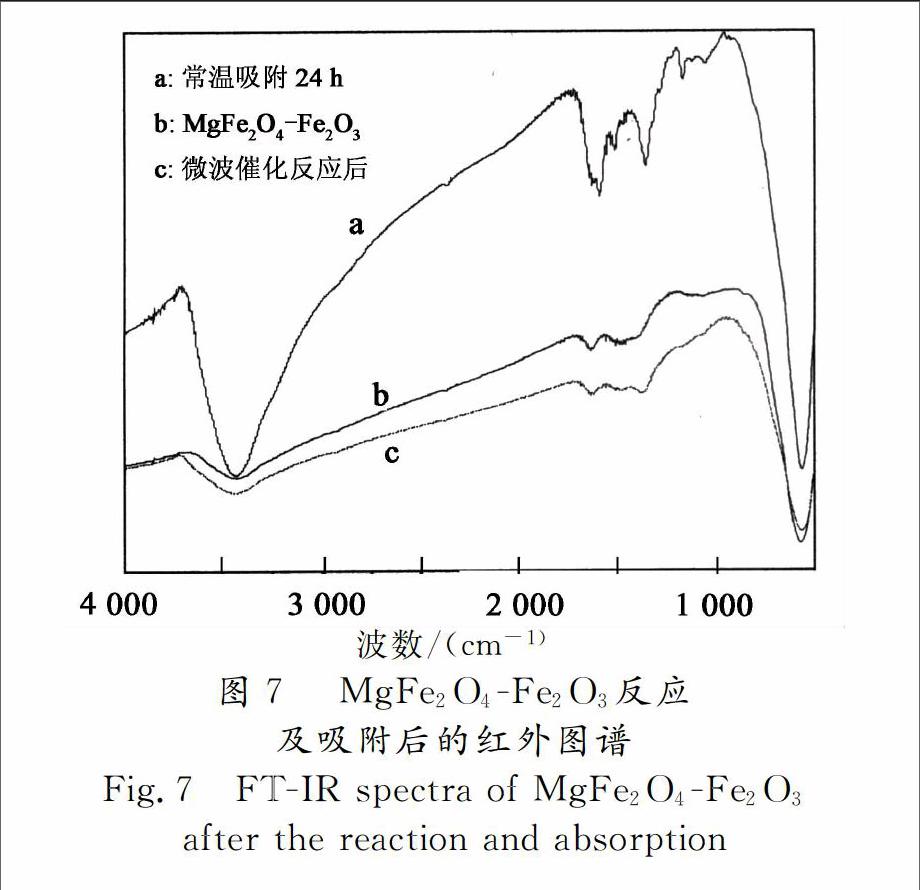
2.3.5 反应前后催化剂的红外分析
将微波催化反应前后及吸附后的催化剂进行红外分析,如图7所示.MgFe2O4-Fe2O3吸附结晶紫废水后,在750~2 000 cm-1处有明显的结晶紫官能团特征峰.而经微波辐照催化反应后,催化剂的红外图谱没有明显变化,也没有出现结晶紫有机分子的特征吸收峰,这也说明在微波催化条件下结晶紫的被去除主要是由于微波催化氧化的作用而不是吸附的作用.
波数/(cm-1)
3 微波催化氧化机理探究
3.1 氧化性基团清除剂对去除率的影响
由于·OH的活性极高,存在的时间极短,大约为10-9s,其氧化还原电位仅次于F2,达到2.8 eV[ 25],且反应速度快,与大多数有机污染物反应的速率常数在106~1010 mol-1·L·s-1[ 26],很难通过物理方法对其进行分离和鉴定.因此,为了检验在微波催化反应中产生了·OH,在反应液中加入不同氧化性基团清除剂,检验其对去除率的影响.维生素C(VC)是所有氧化性基团的清除剂,L-组氨酸(His)能清除O2-,硫脲(TU) 和二甲亚砜(DMSO)则可以清除·OH[ 27].实验在结晶紫反应液中分别加入20 mL,0.05 mol/L的上述氧化性基团清除剂,催化剂用量0.1 g,在微波功率800 W下反应5 min,所得实验结果如表2所示.可知,加入VC后结晶紫去除率显著降低,由99.3%降低至53.6%,加入·OH清除剂 TU和DMSO后去除率降低20%左右,而加入His降低了24%.说明VC在较大程度上清除了反应过程中产生的氧化性基团,TU,DMSO和His也在一定程度上清除了反应中产生的 ·OH和O2-,从而抑制了结晶紫的氧化降解,而反应过程产生的O2-最终也会通过反应转变为·OH.这一实验结果直接证明了微波催化反应过程中产生的·OH是氧化降解废水中结晶紫有机物的氧化剂.Quan等[ 28]报道以活性炭为催化剂用微波能辅照通过实验测定有·OH的产生,也佐证了实验过程中·OH的产生.
53.6
3.2 微波催化氧化降解反应微观机理
上述实验结果表明·OH是氧化降解结晶紫的强氧化剂, 那么微波与催化剂作用如何产生·OH? 其作用机理是什么? 依据上述实验结果,推测微波辐照在微波催化剂上具有微波“光电效应”, 并首次提出微波“光电效应”作用产生·OH的机理.微波是一种电磁波, 微波辐照即是电磁波辐照, 根据量子理论原理, 微波电磁波辐照必定有光子辐照在微波催化剂上,即必有光电效应的作用, 在水或空气存在的情况下微波直接作用于微波催化剂MgFe2O4-Fe2O3上, MgFe2O4-Fe2O3吸收微波电磁波也吸收光子, 由于光电效应作用, 会产生游离的电子(e-cb), 并在催化剂表面产生电子-空穴对(e-cb + h+vb). 空穴具有强氧化性, 与吸附在微波催化剂表面的H2O和OH-作用可产生·OH式 (2)和式(3); e-cb与O2作用经过途径式(4)~式(9)也可产生·OH. 其中式(2)和式(3)是主要途径,式(4)~式(9)是次要途径, 因为反应液中溶解氧有限, 实验没有通入氧气, 仍可高效去除水溶液中的结晶紫.微波与微波催化剂作用产生·OH的机理路径如式(1)~式(10)所示.
为了进一步证实·OH氧化降解结晶紫,实验在100 mL 200 mg/L废水中加入催化剂0.2 g,在微波功率800 W下处理结晶紫废水,反应8 min,并将尾气通入饱和澄清石灰水.尾气进入澄清石灰水后即刻变浑浊,直接证明了氧化降解反应的尾气中有CO2的存在,同时测定得到结晶紫废水中TOC去除率达到92.7%.表明微波催化反应阶段生成的·OH直接氧化降解水中结晶紫及反应的中间产物, 最终生成CO2和H2O等无机物.
但微波催化反应过程产生·OH的机理及具体路径仍在进一步的探究中.
4 结 论
1)建立的微波催化氧化降解技术是一种可高效处理难降解有机物废水的新方法.选择能与微波很好匹配的微波催化剂是关键.制备的MgFe2O4-Fe2O3是理想的微波催化剂,在微波辐照下,对结晶紫有很好的氧化降解效果.当微波功率为800 W,催化剂用量为1 g/L时,结晶紫浓度为100 ~500 mg/L,微波辐照6 min,结晶紫去除率为96%~99.3%.且随着催化剂用量的增加,微波功率的加大,辐照时间的延长,结晶紫降解率均增加.
2)实验证实利用微波与微波催化剂作用产生的强氧化性·OH是微波催化氧化降解过程中的强氧化剂,反应过程中不需要额外添加氧化剂就能达到理想效果, 相比于微波强化、微波诱导及微波辅助方法有明显的优势.
3)微波催化氧化降解机理为: 微波催化剂吸收电磁波发生光电效应, 产生电子和空穴对, 与水等作用产生·OH,·OH再氧化降解废水中的有机物, 并将其矿化为CO2和水.
参考文献
[1] OLUKANNI O D, OSUNTOKI A A, GBENLE G O. Textile effluent biodegradation potentials of textile effluent-adapted and non-adapted bacteria[J]. Afr J Biotechnol, 2006,5(20): 1980-1984.
[ 2] KAMBOH M A,SOLANGI I B, SHERAZI S T H,et al. A highly efficient calyx arene based resin for the removal of azo dyes[J].Desalination, 2011, 268 (1/3) : 83-89.
[ 3] GOLKA K, KOPPS S, MYSLAK Z W. Carcinogenicity of azo colorants: Influence of solubility and bioavailability[J].Toxicol Lett, 2004, 151 (1) : 203-210.
[ 4] NASSAR M M, MAGDY Y H. Removal of different basic dyes from aqueous solutions by adsorption on palm-fruit bunch particles[J].Chem Eng J, 1997, 66 (3) : 223-226.
[ 5] CHAKRABORTY S, CHOWDHURY S, DAS P S. Adsorption of crystal violet from aqueous solution onto NaOH-modified rice husk[J].Carbohydr Polym, 2011, 86 (4) : 1533-1541.
[ 6] PARSHETTI G K, PARSHETTI S G, TELKE A A,et al. Biodegradation of crystal violet by agrobacterium radiobacter[J]. Environ Sci, 2011, 23 (8) : 1384-1393.
[ 7] FERNANDO G D, CHRISTIAN P, CESAR P, et al. Torres-palma. effects of sonochemical parameters and inorganic ions during the sonochemical degradation of crystal violet in water[J]. Ultrason Sonochem, 2011, 18 (1) : 440-446.
[ 8] 张文治, 张秀丽, 李莉, 等. CTAB作用下纳米复合材料ZnO-TiO2制备与多模式光催化降解罗丹明B[J]. 分子催化, 2013, 27 (5) : 474-482.
ZHANG Wen-zhe, ZHANG Xiu-li, LI li,et al.The preparation of nanocomposite ZnO-TiO2 by CTAB-sssisted synthesis and multi-mode photo-catalytic degradation of rhodamine B[J]. J Molecular Catalysis,2013, 27 (5): 474-482.(In Chinese)
[ 9] 因博, 龙东辉, 徐伟,等. 板式纳米碳纤维负载二氧化钛光催化复合材料的制备及降解甲基橙的研究[J].分子催化, 2012, 26 (5) : 442-448.
YIN Bo, LONG Dong-hui, XU Wei,et al. Preparation of TiO2/Platelet carbon nanofiber nanocomposites and their photo-catalytic performance for degradation of methyl orange[J]. J Molecular Catalysis,2012, 26 (5): 442-448.(In Chinese)
[ 10]RICARDO E, GOYES P, FERNANDO L,et al. Electrochemical degradation of crystal violet with BDD electrodes: Effect of electrochemical parameters and identification of organic by-products[J]. Chemosphere, 2010, 81 (1) : 26-32.
[ 11]JANA S, PURKAIT M K, MOHANTY K. Removal of crystal violet by advanced oxidation and microfiltration[J]. Applied Clay Science, 2010, 50 (3) : 337-341.
[ 12]SZYMAN′SKI G S. Catalytic destruction of methyl tertiary butyl ether (MTBE) using oxidized carbon[J]. Catal Today, 2008, 137(2):460-465.
[ 13]LIN L, YUAN S H, CHEN J,et al. Removal of ammonia nitrogen in wastewater by microwave radiation[J]. J Hazard Mater, 2009, 161:(s2/3)1063-1068.
[ 14]ZHANG Z H, XU Y, MA X P,et al. Microwave degradation of methyl orange dye in aqueous solution in the presence of nano-TiO2-supported activated carbon (supported-TiO2/AC/MW)[J]. J Hazard Mater, 2012,209/210: 271-277.
[ 15]HE H, YANG S, YU K,et al. Microwave induced catalytic degradation of crystal violet in nano-nickel dioxide suspensions[J]. J Hazard Mater, 2010, 173 (1/3) : 393-400.
[ 16]BI X, WANG P, JIAO C, et al. Degradation of remazol golden yellow dye wastewater in microwave enhanced ClO2 catalytic oxidation process[J]. J Hazard Mater, 2009, 168 (2/3):895-900.
[ 17]LIU S T, ZHANG A B, YAN K K, et al. Microwave-enhanced catalytic degradation of methylene blue by porous MFe2O4 (M = Mn, Co) nanocomposites: Pathways and mechanisms[J].Sep Purif Technol, 2014, 135 : 35-41.
[ 18]周继承, 王哲, 蒋尊芳,等.一种微波催化剂及应用方法:中国,102407113A [ P].2012-04-11.
ZHOU Ji-cheng,WANG Zhe, JIANG Zun-fang,et al.A microwave catalyst and its application method. Chinese,102407113A [P]. 2012-04-11 .(In Chinese)
[ 19]周继承, 蒋尊芳, 高令飞,等. 一种采用活性炭基微波催化剂降解有机废水的方法:中国,102992444A [P]. 2013-03-27 .
ZHOU Ji-cheng, JIANG Zun-fang,GAO Ling-fei,et al. A method for the degradation of organic wastewater by activated carbon microwave catalyst: Chinese,102992444A [P]. 2013-03-27.(In Chinese)
[ 20]周继承, 蒋尊芳, 高令飞, 等. 一种采用铁酸盐类微波催化剂降解有机废水的方法:中国, 103011333A [P]. 2013-04-03 .
ZHOU Ji-cheng, JIANG Zun-fang,GAO Ling-fei,et al. A method for the degradation of organic wastewater by ferrite microwave catalyst: Chinese,103011333A [P]. 2013-04-03.(In Chinese)
[ 21]周继承,蒋尊芳, 谌敏飞, 等. 一种降解有机废水的微波催化剂及其催化氧化降解方法:中国,103084216A [P].2013-05-08.
ZHOU Ji-cheng,JIANG Zun-fang,ZHAN Mei-fei,et al. A microwave catalyst for the degradation of organic wastewater and its catalytic oxidation degradation: Chinese, 103084216A [P]. 2013-05-08.(In Chinese)
[ 22]ZHANG L, LIU X Y, GUO X J, et al. Investigation on the degradation of brilliant green induced oxidation by NiFe2O4 under microwave irradiation[J].Chem Eng J, 2011, 173 (3) : 737-742.
[ 23]HONG Z C, SHAO G Y, JIAO C, et al. Efficient degradation of crystal violet in magnetic CuFe2O4 aqueous solution coupled with microwave radiation[J].Chemosphere, 2012, 89 (2) : 185-189.
[ 24]吁霁,庄稼,迟燕华,等.纳米ZnFe2O4的低温固相合成及其电磁损耗特性[ J]. 材料科学与工程学报, 2004, 22 (1) : 110-112.
YU Ji,ZHUANG Jia,CHI Yan-hua, et al. Low temperature solid state synthesis of nano ZnFe2O4 and characterization of its electromagnetic loss[J]. J Mater Sci and Eng, 2004, 22 (1): 110-112.(In Chinese)
[ 25]GARGANTINI I. Further applications of circular arithmatic Schroedercike algorithms with error bovends for finding zeros of polynomials[J]. SIAMJ, 1998, 15 : 497-510.
[ 26]ZHENG W X, MAYRIN M, A TARR M. Enhancement of sonochemical degradation of phenol using hydrogen atom scavengers[J]. Ultrason Sonochem, 2005, 12 (4) : 313-317.
[ 27]GUO Yu-wei, CHENG Chun-ping, WANG Jun,et al. Detection of reactive oxygen species (ROS) generated by TiO2(R), TiO2(R/A) and TiO2 (A) under ultrasonic and solar light irradiation and application indegradation of organic dyes [ J]. Journal of Hazardous Materials, 2011, 192: 786-793.
[ 28]QUAN X, ZHANG Y B, CHEN S,et al. Generation of hydroxyl radical in aqueous solution by microwave energy using activated carbon as catalyst and its potential in removal of persistent organic substances[ J]. J Mol Catal A: Chem, 2007, 263(1/2): 216-222.

