不同人工真皮支架对Ⅲ度烧伤创面修复中组织TGF-β1和细胞凋亡的影响
田代雄
(湖北省恩施州中心医院烧伤整形科,湖北 恩施 445000)
不同人工真皮支架对Ⅲ度烧伤创面修复中组织TGF-β1和细胞凋亡的影响
田代雄
(湖北省恩施州中心医院烧伤整形科,湖北 恩施445000)
摘要:目的探讨不同人工真皮支架对Ⅲ度烧伤创面修复中组织TGF-β1和细胞凋亡的影响。方法随机将12只实验动物分成2组每组6只,A组为胶原—磺化羧甲基壳聚糖人工真皮支架组;B组为负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架组。C组为在A、B两组中各取3只猪,在背部制备同2组相同的烧伤创面,只植入硅橡胶膜。比较3组间创面修复情况,创面中表达α-SMA、TGF-β1的情况以及细胞凋亡数。结果B组负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架与创面的整合和恢复均较好于A、C组。1~3周3组创面α-SMA表达阳性的血管逐渐增多。C组在1~4周内α-SMA表达阳性的血管数均显著少于A、B组(P<0.05)。B组在1~3周内α-SMA表达阳性的血管数均显著多于A组(P<0.05)。第2周3组创面TGF-β1阳性信号数比第1周显著增多。植皮后A、B组创面TGF-β1阳性信号数均有降低。A、B两组创面TGF-β1阳性信号数均成先上升后下降的趋势,其中2周TGF-β1阳性信号数表达最高。C组3、4周创面TGF-β1阳性信号数均显著多于A、B组(P<0.05)。1~4周,3组创面的细胞凋亡数逐渐增加。在不同时一间点,A组与B组的细胞凋亡数经统计学比较,均无统计学意义(P>0.05)。在不同时一间点,C组的细胞凋亡数均显著少于A、B组(P<0.05)。结论负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架在Ⅲ度烧伤创中可促进血管生成,有效抑制创面收缩同时促进细胞凋亡,减少瘢痕的增生。
关键词:人工真皮支架;创面修复;TGF-β1;细胞凋亡
烧伤造成大面积组织暴露于外部环境,易造成肢体感染甚至功能丧失[1]。每年我国有100余万人因烧伤需进行皮肤缺损的救治[2]。自体皮肤移植目前仍然是治疗皮肤缺损的首选方法[3]。然而对于大面积烧伤患者存在供皮不足的问题。随着材料学、再生医学的发展,已有模拟人体皮肤的人工真皮支架[4]。本研究考察负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架和胶原—磺化羧甲基壳聚糖人工真皮支架在Ⅲ度烧伤创面修复中的应用效果。现报道如下。
1材料与方法
1.1材料实验动物:广西巴马小香猪12只,雌性,体质量(10±2)kg。主要材料:胶原—磺化羧甲基壳聚糖/硅橡胶双层人工皮肤(三维多孔结构,孔径80~500 μm,厚度2 mm,直径3.2 cm,孔隙率>90%)。VEGF DNA质粒(购自第四军医大学),医用级硅橡胶薄膜;α-SMA(α-平滑肌肌动蛋白)单克隆抗体;TGF-β1(细胞表达转化生长因子)单克隆抗体;SP免疫组化检测试剂盒。
1.2方法分组:随机将12只猪分成2组每组6只,A组为胶原—磺化羧甲基壳聚糖人工真皮支架组;B组为负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架组。每只猪于背部行Ⅲ度烧伤创面模型制作[5-8](速眠新Ⅱ肌肉注射和3%戊巴比妥腹腔注射复合麻醉。将温度为100℃、直径2.5 cm的铜块在猪背部两侧距离后正中线3~ 4 cm处恒温恒压持续70 s,造成Ⅲ度烧伤。每次制备2~4个创面,每次常规清创后聚维酮碘包扎。每日换药一次)。C组:在A、B两组中各取3只猪,在背部制备同2组相同的烧伤创面,只植入硅橡胶膜。
取材:对3组在不同支架移植术后1、2、3周打开内层敷料,揭下硅橡胶膜,观察创面,在创面中间切取大小为0.5 cm×0.5 cm深至肌层的组织块,每组每个时间点12孔。
表皮移植:剪大小为(0.5~0.6)cm ×(0.5~0.6)cm的猪刃厚皮,置于0.2%胰酶缓冲液中,37℃下消化1.2 h,将表皮从组织剥离下来。在植入支架2周后,揭下硅橡胶膜,植入分离的表皮,常规加压固定。2周后进行创面组织学研究。
免疫组织化学检验:对不同时间点,3组每12个标本其中6个进行α-SMA阳性检测(SP法,一抗浓度为1∶200,PBS为阴性对照。阳性信号为棕色或黄色);另6个标本进行TGF-β1检测(TGF-β1一抗浓度为1∶200,二甲氨偶氮苯(DAB) 显色,阳性信号为棕黄色)。均在400×光镜下随机观察10个视野,阳性主要在血管和创面肌成纤维细胞浆表达,对表达阳性信号进行计数。
TUNEL检测(组织细胞凋亡检测):按检测试剂盒步骤操作(反应液中不加TdT酶为阴性对照,阳性信号为棕色或黄色,在细胞核表达)。标本观察同免疫组织化学检验光镜观察。
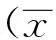
2结果
2.1创面观察1~3周,B组创面由黄白色未血管化基本转为红润色;A组创面由黄白色未血管化转为红润色,但仍有部分未血管化的黄白色真皮支架;C组烧伤面由较多分泌物转为少量分泌,创面粗糙。总之,在不同时间点,B组负载VEGF DNA质粒的胶原—磺化梭甲基壳聚糖人工真皮支架与创面的整合和恢复均较好于A、C组。
2.23组创面α-SMA阳性信号表达情况3组创面的α-SMA阳性信号表达见图1。在不同人工支架植入2周后,A组可见血管和肌成纤维细胞的生成;B组血管表达量多于A组,肌成纤维细胞表达少于A组;C组血管表达量较A、B组少,肌成纤维细胞表达多于A和B组。
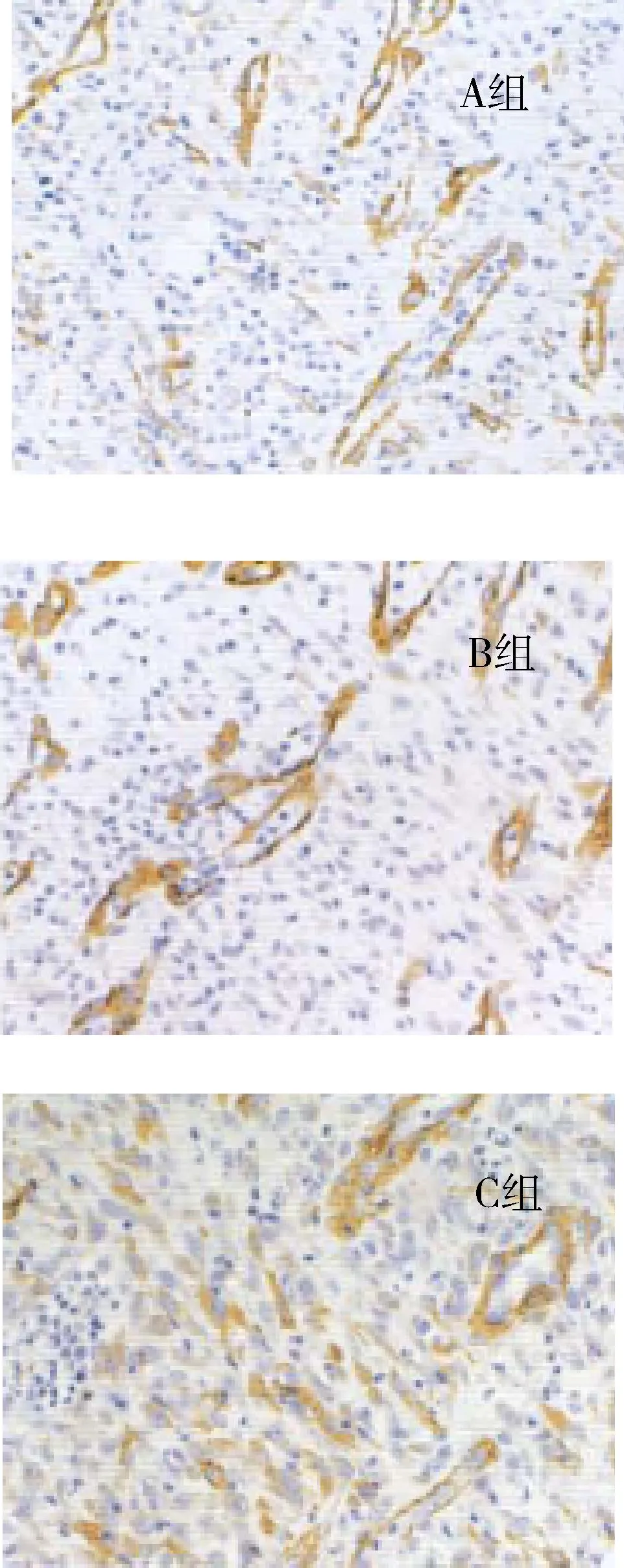
图1 3组创面2周后α-SMA阳性信号
由表1、图2可知,1~3周3组创面α-SMA表达阳性的血管逐渐增多。C组在1~4周内α-SMA表达阳性的血管数均显著少于A、B组(P<0.05)。第4周B组α-SMA表达阳性的血管数与A组无显著差异(P>0.05)。B组在1~3周内α-SMA表达阳性的血管数均显著多于A组(P<0.05)。
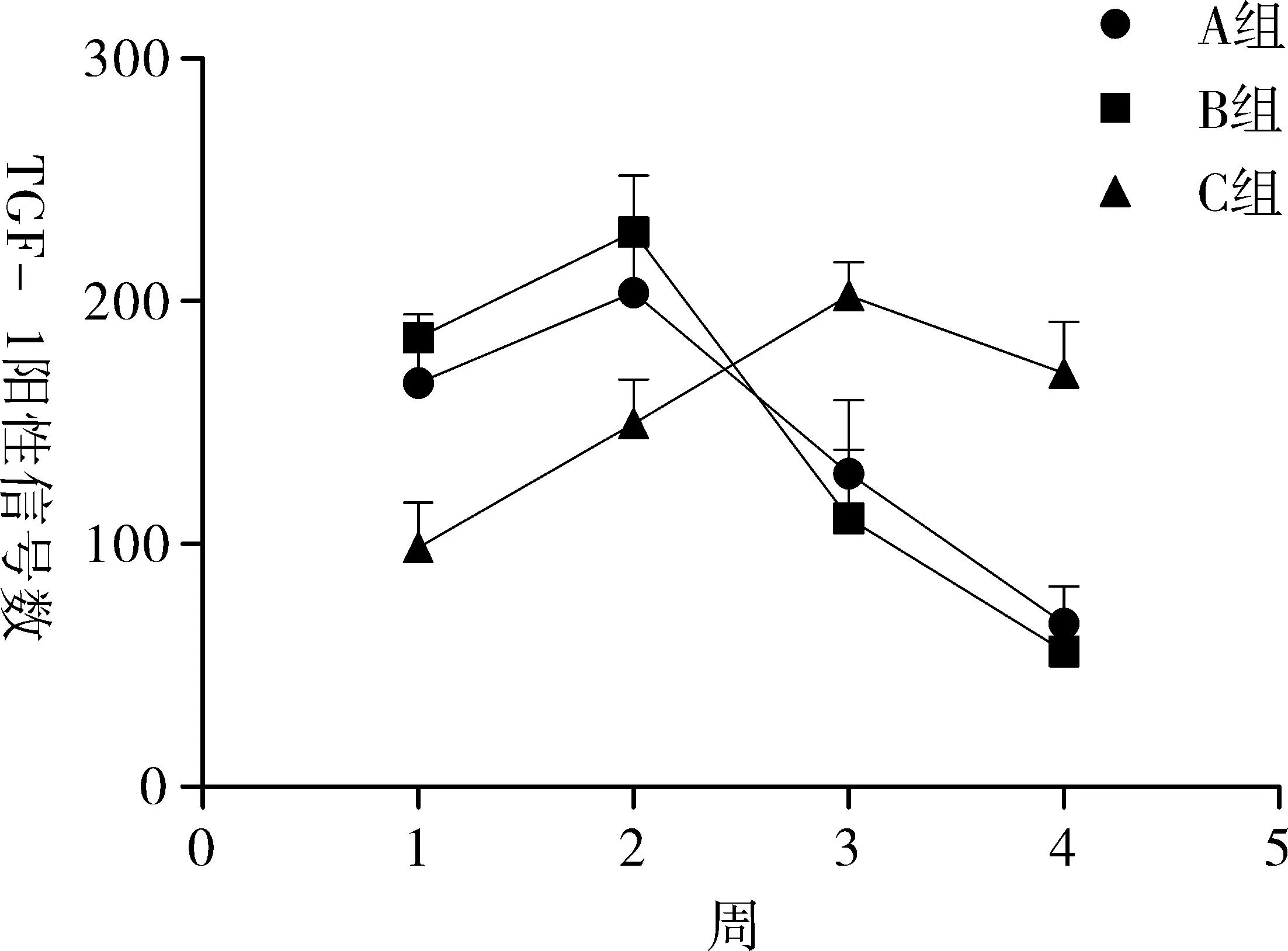
2.33组创面TGF-β1阳性信号表达情况比较由表2、图3可知,第2周3组创面TGF-β1阳性信号表达数比第1周显著增多。植皮后A、B组创面TGF-β1阳性信号表达数均有降低。A、B两组创面TGF-β1阳性信号表达数均成先上升后下降的趋势,其中2周TGF-β1阳性信号表达数最高。两组各周时间点下,创面TGF-β1阳性信号表达数无显著差异(P>0.05)。C组3、4周创面TGF-β1阳性信号表达数均显著多于A、B组(P<0.05)。
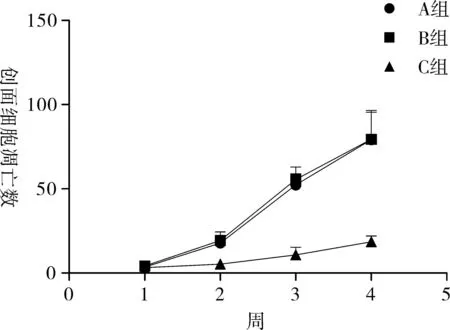
2.43组创面细胞凋亡比较由表3、图4可知,1~4周,3组创面的细胞凋亡数逐渐增加。在不同时间点,A组与B组的细胞凋亡数经统计学比较,均无统计学意义(P>0.05)。在不同时间点,C组的细胞凋亡数均显著少于A、B组(P<0.05)。


组别1周2周3周4周A组14.6±2.7#22.4±2.8#37.5±3.1#26.4±2.6#B组24.3±3.1*35.2±4.1*40.2±4.6*26.3±2.4C组4.7±2.111.6±3.318.6±2.815.8±3.5
注:*与A、C组相比,P<0.05;#与C组相比,P<0.05。

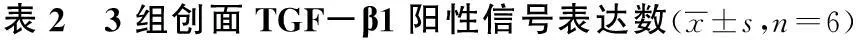
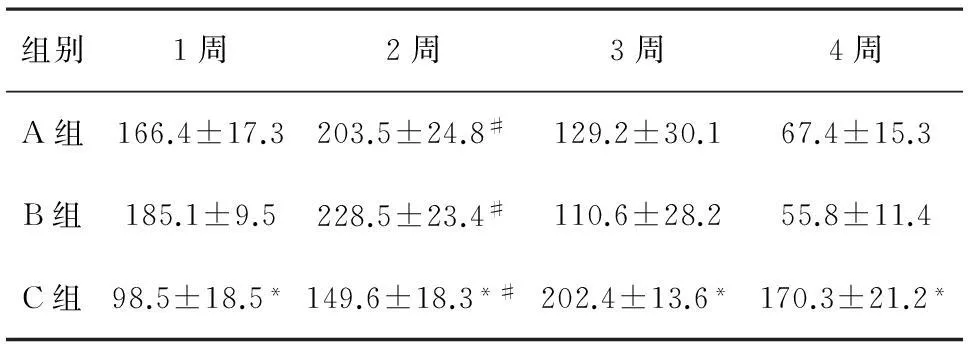
组别1周2周3周4周A组166.4±17.3203.5±24.8#129.2±30.167.4±15.3B组185.1±9.5228.5±23.4#110.6±28.255.8±11.4C组98.5±18.5*149.6±18.3*#202.4±13.6*170.3±21.2*
注:*与A、B组相比,P<0.05;#与1周相比,P<0.05。

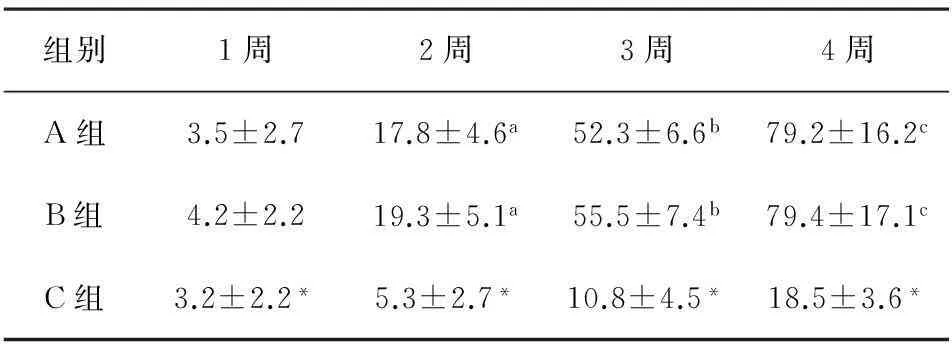
组别1周2周3周4周A组3.5±2.717.8±4.6a52.3±6.6b79.2±16.2cB组4.2±2.219.3±5.1a55.5±7.4b79.4±17.1cC组3.2±2.2*5.3±2.7*10.8±4.5*18.5±3.6*
注:*与A、B组相比,P<0.05;a与1周相比,P<0.05;b与1周相比,P<0.05;c与1周相比,P<0.05。

3讨论
每年有很多人因为烧伤造成皮肤缺损。皮肤缺损对患者的生活甚至生命健康带来很大的影响[8]。目前,自体皮肤移植仍然是治疗皮肤缺损的首选方法。临床治疗过程中往往存在供体不足的情况。近年来材料学、再生医学的进步,已有模拟人体皮肤的人工真皮支架[9]。然而,人工真皮支架能否与创伤面的完美整合一直是研究的热点。VEGF可促进血管内皮细胞增殖和新血管的生成。据报道[10-11],负载VEGF的人工真皮支架能催进血管的形成,有利于与创面的整合。本研究考察负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架和胶原—磺化羧甲基壳聚糖人工真皮支架在Ⅲ度烧伤创面修复中的应用效果。
通过检测α-SMA阳性表达可判断新生血管的成熟水平。因为α-SMA是新生血管的标志物,主要在血管和创面肌成纤维细胞浆中表达。研究发现,1~3周3组创面α-SMA表达阳性的血管逐渐增多。C组在1~4周内α-SMA表达阳性的血管数均显著少于A、B组(P<0.05)。第4周B组α-SMA表达阳性的血管数与A组无显著差异(P>0.05)。B组在1~3周内α-SMA表达阳性的血管数均显著多于A组(P<0.05)。结合创面状态观察,B组创面由黄白色未血管化基本转为红润色;A组创面由黄白色未血管化转为红润色,但仍有部分未血管化的黄白色真皮支架;C组烧伤面由较多分泌物转为少量分泌,创面粗糙。说明负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架诱导血管的生成,催进了胶原的产生,与创面整合度较高,可维持3周。
实验中植入2周3组创面TGF-β1阳性信号数比第1周显著增多。植皮后A、B组创面TGF-β1阳性信号数均有降低。A、B两组创面TGF-β1阳性信号数均成先上升后下降的趋势,其中2周TGF-β1阳性信号数表达最高。两组各周时间点下,创面TGF-β1阳性信号数无显著差异(P>0.05)。C组3、4周创面TGF-β1阳性信号数均显著多于A、B组(P<0.05)。VEGF诱导血管化促进了TGF-β1的表达。然而,TGF-β1与创面修复和瘢痕的增生密切相关的细胞因子。既可促进成纤维细胞合成胶原,有利于创面的修复,同时也可以通过调控胶原、蛋白多糖等细胞外基质沉积,促使瘢痕生成[12-13]。1~2周表达较高,催进了纤维细胞的合成,创面的恢复。3~4周表达降低,降低了胶原的沉积,减少了瘢痕的增生。
通过TUNEL检测发现,1~4周3组创面的细胞凋亡数逐渐增加。在不同时间点,A组与B组的细胞凋亡数经统计学比较,均无统计学意义(P>0.05)。在不同时间点,C组的细胞凋亡数均显著少于A、B组(P<0.05)。有报道称[14-15],细胞的凋亡同样是抑制瘢痕增生和收缩的主要原因。说明支架组早期伴随着细胞的增殖,同时出现了大批血管内皮细胞的凋亡,从而减少了瘢痕的增生。
综上所述,负载VEGF DNA质粒的胶原—磺化羧甲基壳聚糖人工真皮支架在Ⅲ度烧伤创中可促进血管生成,有效抑制创面收缩同时促进细胞凋亡,减少瘢痕的增生。
参考文献:
[1]胡以信,袁杰,刘兵,等.五味消毒饮制剂治疗烧伤残余创面的疗效分析[J]. 安徽医药,2014,18(8): 1564-1565.
[2]徐少骏,黄爱宾,马列,等.生物合成与细胞凋亡在胶原-壳聚糖真皮支架修复创面中的作用和机制[J].中华整形外科杂志,2009,25(3):208-212.
[3]周娅蕾.微粒载体复合脂肪来源间充质干细胞修复软组织及骨组织缺损的实验研究[D].西安:第四军医大学,2011.
[4]周名兵,胡盼,龚梅,等.双交联明胶-壳聚糖复合人工真皮支架的制备及其性能研究[J].功能材料,2012,43(11):1465-1468,1471.
[5]滕建英,郭瑞,谢菁,等.移植不同人工真皮支架对猪Ⅲ度烧伤创面血管化及瘢痕形成的影响[J].中华烧伤杂志,2012,28(1):13-18.
[6]徐少骏,马列,滕建英,等.不同材料人工真皮支架修复猪Ⅲ度烧伤创面比较[J].中华整形外科杂志,2010,26(5):360-364.
[7]滕建英,任园园,徐少骏,等.血竭负载人工真皮支架对猪Ⅲ°烧伤创面修复中VEGF表达及创面收缩的影响[J].健康研究,2013,33(6):415-418.
[8]张兵,李魏,李峥,等.早期薄层削痂联合负压封闭引流技术修复深Ⅱ度烧伤创面临床观察[J].中华烧伤杂志,2011,27(5):384-385.
[9]吴琛,杜永贵,邹同荣,等.人工真皮支架联合刃厚皮移植在瘢痕整复中的应用[J].医学信息,2014(9):505.
[10] 石海飞,韩春茂,胡学庆,等.兔耳背植入人工真皮支架模型的应用评价[J].浙江医学,2005,27(5):334-336.
[11] 许若山,王永光,杨旭峰,等.人工真皮支架修复猪Ⅲ度烧伤动物模型的构建[J].健康研究,2010,30(3):171-174.
[12] 吴佳佳,滕建英,庞心念,等.负载VEGF DNA质粒人工真皮修复烧伤创面中对创面收缩与细胞凋亡的影响[J].健康研究,2012,32(2):89-93.
[13] 王永光,姚晓花,徐少骏,等.人工真皮结合角质形成细胞修复猪皮肤缺损[J].浙江创伤外科,2011,16(2):151-154.
[14] 滕建英,郭瑞,谢菁,等.血管内皮生长因子DNA质粒对真皮支架修复猪Ⅲ度烧伤创面中血管化的影响[J].中华医学杂志,2011,91(36):2568-2572.
[15] 徐少骏,黄爱宾,马列,等.胶原-壳聚糖真皮支架原位诱导修复猪全层皮肤缺损的研究[J].中华外科杂志,2009,47(4):305-308.
Effect of different artificial dermal stents on the TGF- beta 1
and apoptosis in the tissue of third degree burn wounds
TIAN Dai-xiong
(DepartmentofBurnsandPlasticSurgery,EnshiCentralHospital,Enshi,Hubei445000,China)
Abstract:Objective To investigate the effect of different artificial dermal stents on the TGF- beta 1 and apoptosis in the tissue of third degree burn wounds.Methods Twelve pigs were randamized into 2 groups with 6 in each group, group A for collagen sulfonated carboxymethyl chitosan artificial dermal stent group and group B for artificial dermal stent of collagen sulfonated carboxymethyl chitosan encoded with VEGF DNA plasmid group. Three pigs from group A and group B respectively were assigned in group C with the same burn wounds on the back as in group A and B, implanted with only silicone rubber membranes. We compared the wound healing among the 3 groups, including the expression of α-SMA, TGF-β1 and apoptosis. Results The artificial dermal stent and wound healing in group B were better than those in group A and group C.During week 1 and 3, α-SMA positive vessels gradually increased in all three groups. The number of blood vessels in group C was significantly fewer than that in group A and B in 1~4 weeks, and the number of blood vessels in group B was significantly more than that in group A in 1~3 weeks (P<0.05).The number of TGF- beta 1 positive signal in the 3rd week was significantly increased more than that in the first week. TGF- beta 1 positive signals were reduced in both group A and B after skin grafting. The number of TGF- beta 1 positive signal in both group A and B tended to decrease after its increase, which reached the highest in the second week.The number of positive signals of TGF- beta 1 in group C at 3 and 4 weeks was significantly more than that in group A and B (P<0.05). During 1~4 week, the number of apoptotic cells in the 3 groups increased gradually. There was no significant difference in apoptosis at different time between group A and group B (P>0.05), while the number of apoptotic cells in group C was significantly lower than that in group A or group B(P<0.05). Conclusions Artificial dermal stent of collagen sulfonated carboxymethyl chitosan encoded with VEGF DNA plasmid for III degree burn wound can promote angiogenesis, inhibit wound contraction, promote cell apoptosis and reduce scar hyperplasia.
Key words:artificial dermal stent;wound repair;TGF- beta 1;apoptosis
收稿日期:(2015-08-17,修回日期:2015-10-23)
doi:10.3969/j.issn.1009-6469.2016.01.024

