丙酮酸转运抑制剂对荔枝酿酒酵母代谢醋酸的影响
曾英杰, 商玉荟, 钟秋平
(海南大学食品学院, 海南 海口, 570228)
丙酮酸转运抑制剂对荔枝酿酒酵母代谢醋酸的影响
曾英杰, 商玉荟, 钟秋平*
(海南大学食品学院, 海南 海口, 570228)
为降低荔枝酒中挥发酸含量,以同时利用可发酵性糖和乙酸的酿酒酵母为出发菌株,研究丙酮酸转运抑制剂对酿酒酵母代谢醋酸的影响。结果表明:在荔枝酒酿造过程中,添加0.5~0.75 mmol/L的α-氰基-4-羟基肉桂酸(α-CCA)对酿酒酵母代谢醋酸具有显著影响,促使酿酒酵母表达较高的乙醇脱氢酶(ADH)、乙酰辅酶A合成酶(ACS)、异柠檬酸裂解酶(ICL)和苹果酸合成酶(MS)的酶活性,提高酿酒酵母代谢醋酸的能力。添加0.5 mmol/L的α-CCA,酿酒酵母代谢醋酸的量比对照提高150 mg/L。
酿酒酵母; 荔枝汁; 丙酮酸转运抑制剂;α-氰基-4-羟基肉桂酸
荔枝是果酒加工的适宜原料,已引起众多研究者的兴趣[1]。因地处热带亚热带,利用荔枝原料酿酒时容易出现挥发酸(主要是醋酸)含量偏高的问题,其主要原因是果实生长过程中存在的醋酸菌在发酵前的果汁制备过程中大量繁殖,导致果汁中的醋酸含量在发酵前可达1.0 g/L以上,这部分醋酸最终会残留在果酒中。当果酒中的挥发醋酸含量达0.9 g/L以上时,会产生尖酸及苦味[2],进而降低果酒的品质。因此,降低果酒中挥发酸的含量,提高果酒的品质已成为当今研究的热点[3]。与对酸酒进行再发酵、反渗透、电渗析及中和处理来降低果酒中挥发酸含量等手段相比,采用能同时利用可发酵性糖和醋酸的酿酒酵母进行果酒的发酵生产以控制挥发酸含量是可行的方法,具有工艺简单、不破坏酒质等优点。Vasserot等[4]利用筛选到的3株商业酿酒酵母DV10、IOC和CHP处理含一定浓度醋酸的新鲜葡萄汁发现,3株酵母都能较好地代谢醋酸。郝文娟等[5]筛选到1株可用于荔枝酒酿造中代谢挥发醋酸的酿酒酵母。曾英杰等[6]以此酿酒酵母为出发菌株,研究荔枝高温酿酒过程中同步代谢挥发醋酸的效果时发现,当初始醋酸浓度为1.5 g/L时,酿酒酵母对醋酸的代谢率最大(达48.0%),发酵结束时醋酸含量符合产品标准要求。
丙酮酸是糖酵解过程中的枢纽产物,连接许多代谢途径。酵母生长过程中,丙酮酸在转运蛋白作用下由细胞质进入线粒体后氧化脱羧形成乙酰辅酶A,乙酰辅酶A进入TCA循环而获得酵母生长所需的能量并产生各种中间代谢产物。α-CCA是有效的丙酮酸转运抑制剂,能抑制丙酮酸进入线粒体,从而降低酿酒酵母生长所需的能量。为了弥补能量的不足,利用醋酸作为碳源的酿酒酵母在乙酰辅酶A合成酶的作用下将乙酸转化成乙酰辅酶A,回补由丙酮酸形成乙酰辅酶A的不足,从而实现进一步代谢醋酸的目的。但这方面的研究未见相关文献报道。因此,笔者以丙酮酸转运抑制剂为研究对象,探讨其对酿酒酵母代谢醋酸的影响,为荔枝酒的降酸提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母Ydcs101:由海南大学食品学院微生物实验室提供;荔枝(品种:金澄荔A4):购于陆桥农业发展有限公司。
试剂:果胶酶(上海杰兔工贸有限公司),醋酸、乙醇、乙醛、甘油测定试剂盒R-biopharm AG,D-64297 Darmstadt Germany;丙酮酸测定试剂盒(南京建成生物科技有限公司),L-苹果酸、琥珀酸标准品,SIGMA;α-氰基-4-羟基肉桂酸,阿拉丁。
仪器:LRH-250A型生化培养箱(韶关泰宏医疗器械有限公司),美的榨汁机(BCD-190KHM),海尔冰箱(青岛海尔),安捷伦1200液相色谱仪(美国安捷伦公司),超声细胞破碎仪(上海之信仪器公司)TG16-WS高速离心机(长沙平凡仪器仪表厂),Evolution300紫外-可见分光光度计(Thermo Fisher)。
1.2 荔枝果汁的制备
挑选新鲜健康的荔枝果实,用自来水冲洗干净,去皮、核后取果肉打浆,加入0.2%的果胶酶在45℃处理2 h。过滤后的汁液于12 000 r/min室温离心15 min。收集上清液供发酵用。经分析,果汁的组成为pH 3.5,葡萄糖58.2 g/L,蔗糖161.3 g/L(含添加蔗糖40 g/L),果糖2.3 g/L,总二氧化硫120 mg/L,游离二氧化硫14 mg/L。
1.3α-CCA的添加及接种发酵
在澄清的荔枝汁中分别添加0 mmol/L、0.25 mmol/L、0.5 mmol/L、0.75 mmol/L和1.0 mmol/L的α-CCA,100℃杀菌15 min以消除天然存在的醋酸菌及乳酸菌等微生物的影响。在前期的研究中发现,当起始醋酸浓度为1.5 g/L时酵母对醋酸代谢的百分率最大。因此,杀菌后用冰醋酸将醋酸浓度调节至1.5 g/L以探讨添加α-CCA对醋酸代谢的影响。接入在25℃培养24 h的酵母种子106CFU/mL。每100 mL三角瓶装至其容积的70%,三角瓶口用PTFE膜封口,于20℃的恒温条件下进行发酵。以抑制剂0添加的试样作对照。发酵至恒重时发酵完成。
1.4 酵母生长曲线的绘制
通过比浊法用分光光度计在600 nm处测定发酵液的吸光度,然后分别绘制酵母细胞在不同α-CCA浓度下的生长曲线。
1.5 粗酶液的提取
取指数期的发酵液在6 000 r/min条件下离心10 min,收集菌体细胞,然后用含有10 mmol/L Na3PO4和2 mmol/L EDTA,pH 7.5的磷酸钾缓冲液冲洗2次。接着超声波破碎细胞,破碎条件:0°C条件下300 W破碎5 min,超声3 s,间歇2 s;然后重悬在含有100 mmol/L K3PO4、2 mmol/L MgCl2、1 mmol/L DTT pH 7.5的磷酸钾缓冲液中,在12 000 r/min条件下离心20 min,上清液即为粗酶提取液。
1.6 酶活性的测定
PDC(丙酮酸羧化酶)、ADH(乙醇脱氢酶)、ALDH(乙醛脱氢酶)、ACS(乙酰辅酶A合成酶)活性的测定参照参考文献[6]的方法进行,ICL(异柠檬酸裂解酶)和MS(苹果酸合成酶)分别采用文献[7]和[8]的方法进行,比酶活性以U/mg蛋白表示。
1.7 生理生化指标的测定
1.7.1 蛋白质含量 参考Bradford法测定,以牛血清蛋白为标准蛋白,于595 nm处测定吸光度值,做标准曲线,样品蛋白质含量可依据标准曲线计算。
1.7.2 醋酸、乙醛、乙醇、甘油和丙酮酸 分别取不同起始浓度OAA在指数生长期的发酵样品,6 000 r/min离心10 min,取上清液,稀释适当倍数后,按照试剂盒说明书测定醋酸、乙醛、乙醇和甘油含量,以Y(mg/g菌重)表示产量,Q(mg/g·h)表示比产率。丙酮酸的测定按试剂盒说明书进行,丙酮酸的量以μmol/mg蛋白表示。
1.7.3 琥珀酸、苹果酸的测定 参照文献[9]的方法进行测定。色谱柱:Agilent ZORBAX SB-Aq 250 mm×4.6 mm,5 μm;流动相:以0.05 mol/L NH4H2PO4(用H3PO4调至pH2.6)为流动相,检测器紫外检测波长215 nm,进样量20 μL;流动相流速1.0 mL/min,柱温30℃。
1.8 数据统计与分析
每组数据取3次重复测量的平均值,数据统计分析采用SPSS 13.0 ANOVA方法。
2 结果与分析
2.1 抑制剂浓度对果汁中醋酸及酒精浓度的影响
从表1可以看出,随着抑制剂α-CCA浓度的升高,发酵结束时醋酸含量先降低后升高。在抑制剂浓度为0.5 mmol/L时,发酵液醋酸含量最低,为0.38 g/L,与未添加抑制剂的对照相比,醋酸含量降低0.15 g/L,两者差异显著。与对照相比,添加0.25~1.0 mmol/Lα-CCA抑制剂的酒精含量显著升高,说明添加抑制剂后,进入线粒体的丙酮酸减少,流向酒精生成支路的流量增加,因而酒精度增加。
表1 添加抑制剂α-CCA发酵结束的醋酸和酒精含量
Table 1 Contents of acetic acid and alcohol after fermentation supplemented with inhibitor
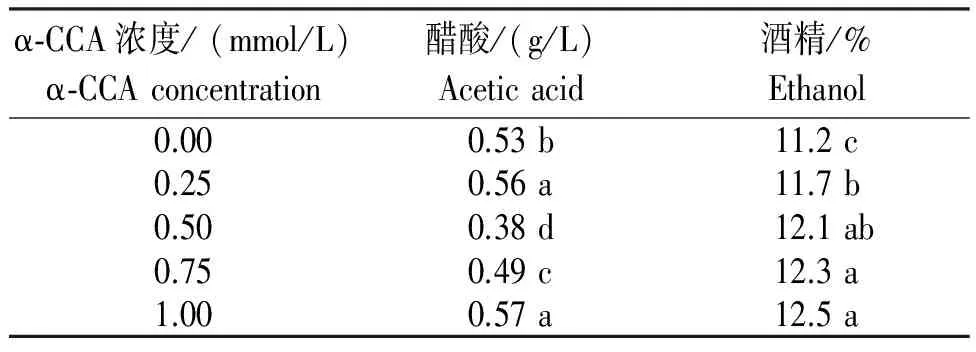
α⁃CCA浓度/(mmol/L)α⁃CCAconcentration醋酸/(g/L)Aceticacid酒精/%Ethanol0.000.53b11.2c0.250.56a11.7b0.500.38d12.1ab0.750.49c12.3a1.000.57a12.5a
注:同列不同字母表示差异显著(P<0.05)(下同)。
Note:Different lowercase letters in the same column indicated significant difference atP<0.05. The same below.
2.2 抑制剂对果汁中酵母生长的影响
由图1可知,α-CCA抑制了酵母细胞的生长。与未添加抑制剂的对照相比,细胞生长的迟滞期延长、指数期最大生长速率降低、稳定期缩短,菌体数量减少。表明进入细胞线粒体内的丙酮酸减少,合成菌体生长代谢所必需的一些基础物质相应减少,致使酵母生长速度明显减慢,细胞数量降低。
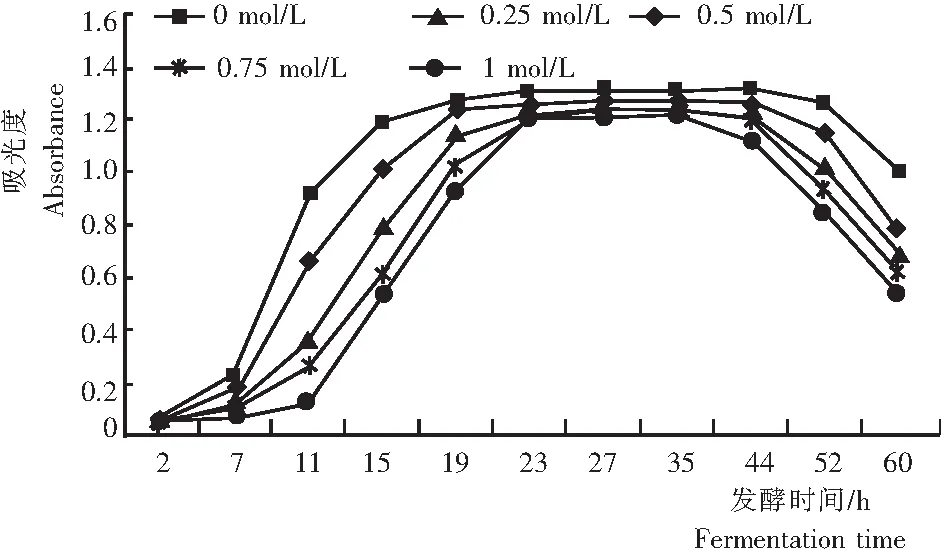
图1 不同α-CCA浓度的酿酒酵母生长曲线
Fig.1 The growth of yeast at differentα-CCA concentration
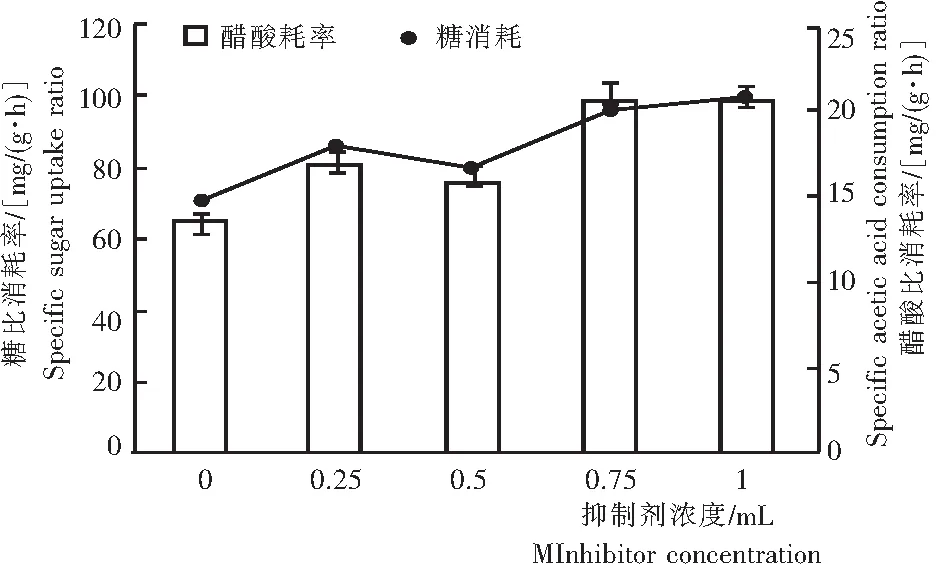
图2 不同α-CCA浓度的指数期酵母细胞糖 比消耗率和醋酸比消耗率
Fig.2 Specific sugar uptake ratio and specific acetic acid consumption ratio at exponential phase of yeast growth with various concentrations ofα-CCA
2.3 添加抑制剂对果汁中底物消耗的影响
由图2可知,添加抑制剂增强了酵母细胞的糖比和醋酸比消耗率,其变化趋势相同,随着抑制剂浓度的增加呈先升后降再升高的趋势。当抑制剂浓度为0.75 mmol/L和1.0 mmol/L时具有最大的糖比和醋酸比消耗率,但两者差异不显著。对照细胞生长曲线,抑制剂虽然对细胞生长有抑制作用,却提高了细胞对底物的比消耗率,这可能与降低的细胞生物量有关。
表2 添加α-CCA后丙酮酸的含量
Table 2 Content of pyruvate during fermentation supplemented withα-CCA
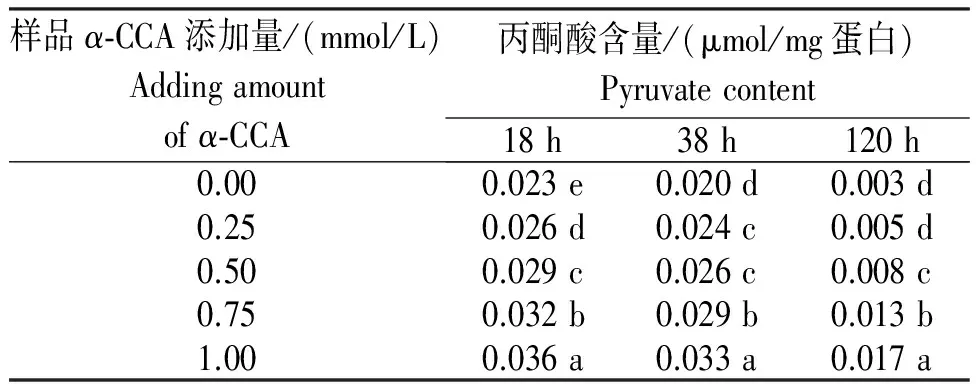
样品α⁃CCA添加量/(mmol/L)Addingamountofα⁃CCA丙酮酸含量/(μmol/mg蛋白)Pyruvatecontent18h38h120h0.000.023e0.020d0.003d0.250.026d0.024c0.005d0.500.029c0.026c0.008c0.750.032b0.029b0.013b1.000.036a0.033a0.017a
2.4 添加抑制剂对果汁中丙酮酸代谢的影响
从表2可见,酵母细胞内丙酮酸含量在不同发酵时间随抑制剂浓度的增加而增加,在同一抑制剂浓度下随发酵时间的延长而降低。与对照相比,各浓度抑制剂下胞内丙酮酸累积显著提高。说明抑制了丙酮酸转运蛋白的转运作用,丙酮酸进入线粒体进一步氧化代谢的量减少,胞内累积丙酮酸的量增加。
2.5 其他中间代谢产物的变化
酵母生长过程中利用糖和醋酸形成各种代谢产物,并产生还原力NAD(P)H。由表3可见,乙醛产量随着抑制剂浓度的提高而提高,各浓度抑制剂与对照相比差异显著;添加0.25~1.0 mmol/L抑制剂时乙醇的比产率显著高于对照;添加抑制剂降低了甘油的产量、比产率及胞内辅酶率,与不添加抑制剂的对照相比差异显著。琥珀酸和苹果酸是TCA环和DCA环的中间产物,添加0.5 mmol/L及0.75 mmol/L的抑制剂增加了琥珀酸和苹果酸的产量,与对照相比差异显著。
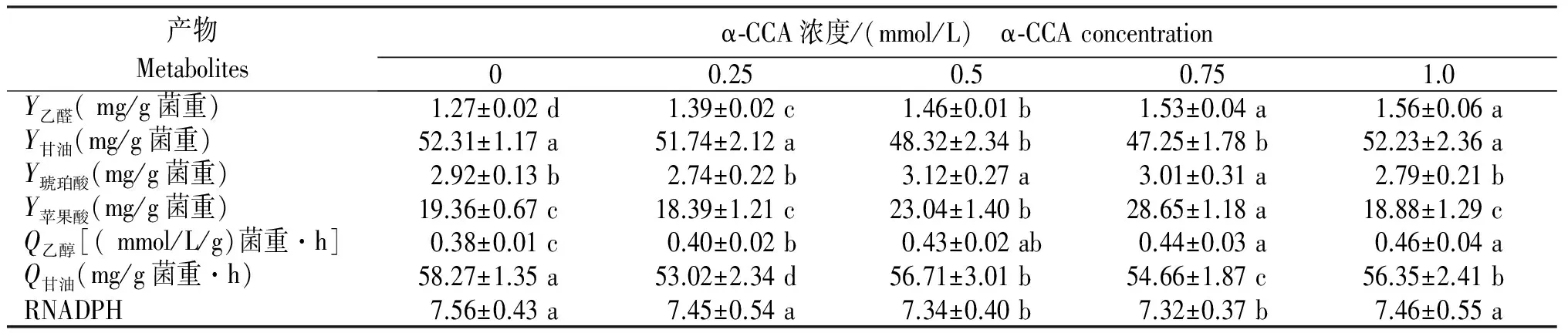
表3 不同α-CCA浓度中间代谢产物的含量
注:同行不同字母表示差异显著(P<0.05)(下同)。
Note: Different lowercase letters in the same line indicated significant difference atP<0.05. The same below.
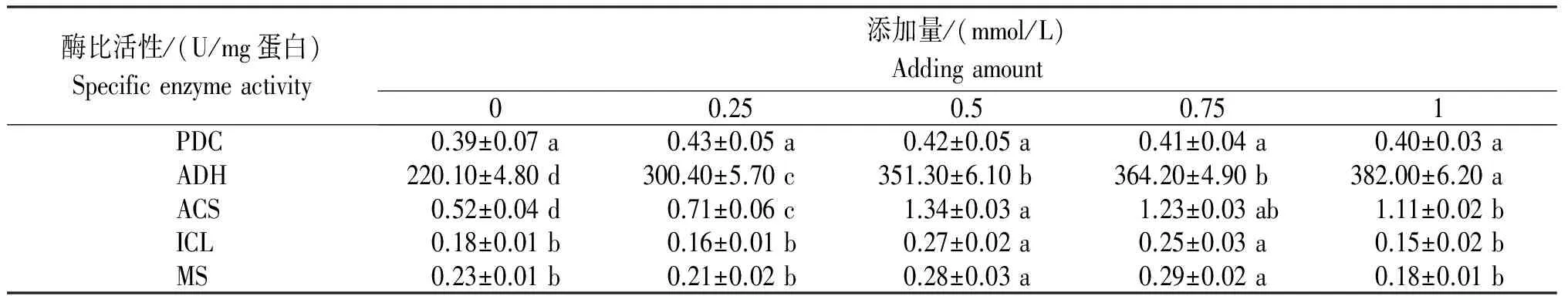
表4 不同α-CCA浓度的酵母酶比活性
2.6 酶比活性变化
由表4可见,PDC比活性随着抑制剂浓度的提高略有升高,但各浓度抑制剂与对照间差异不显著;ADH比活性的变化趋势与PDC比活性的变化趋势完全相反,ADH比活性随着抑制剂浓度的提高线性增强,添加1.0 mmol/L的抑制剂其ADH酶比活性比对照提高了约120 U/mg蛋白,两者差异显著。而ACS比活性随着抑制剂浓度的提高呈先升后降的变化趋势,0.5 mmol/L和0.75 mmol/L浓度下的抑制剂有较高的酶比活性,比对照分别提高0.82 U/mg蛋白及0.71 U/mg蛋白。ICL和MS比活性的变化趋势相似,高浓度(1.0 mmol/L)和低浓度(0.25 mmol/L)抑制剂有较低的酶比活性,与对照相比差异不显著。但在中间浓度即0.5 mmol/L和0.75 mmol/L时,酶比活性最大,比对照分别提高了0.05 U/mg及0.06 U/mg蛋白,差异显著。
3 结论与讨论
试验结果表明,添加0.5~0.75 mmol/L的α-氰基-4-羟基肉桂酸(α-CCA)对荔枝酿酒酵母代谢醋酸具有显著影响,促使酿酒酵母表达较高的ADH、ACS、ICL和MS的酶活性,提高了酿酒酵母代谢醋酸的能力。添加0.5 mmol/L的α-CCA,酿酒酵母代谢醋酸的量比对照提高150 mg/L。
1) 丙酮酸转运抑制剂抑制了酵母细胞的生长,提高了酵母细胞糖和醋酸的比消耗率。抑制剂激活的酵母糖酵解和醋酸代谢可能通过降低酵母生物量对ATP的需求而实现[10-11]。
2) 酵母代谢糖和醋酸的过程中,丙酮酸转运抑制剂同样对中间代谢产物的形成具有重要影响。添加抑制剂后胞内积累了较多的丙酮酸,产生了较多的乙醛、苹果酸和琥珀酸,较少的甘油和胞内辅酶率。丙酮酸作为酒精发酵过程的中间产物,并且是许多代谢物质的前体,既处于糖酵解(EMP)途径的末端,又是连接EMP途径和TCA循环及其他代谢途径的关键产物,因此其所处的位置极为特殊。丙酮酸进入线粒体要经过转运蛋白的转运,而非竞争性抑制剂α-CCA可以阻止或减少丙酮酸进入线粒体[12]。试验结果表明,添加转运蛋白抑制剂抑制了转运蛋白的转运能力,减少丙酮酸向线粒体的转移,较多的流向丙酮酸脱羧酶旁路途径,添加0.5 mmol/L的抑制剂,产乙醛能力和酒精产量比对照分别提高0.19 mg/g菌重和0.9%(v/v)。甘油的主要作用是维持酵母细胞内的氧化-还原再平衡[13],由于胞内辅酶率的降低,需要较少的甘油来氧化维持胞内平衡,因而表现出甘油产量降低。
3) 丙酮酸转运抑制剂激活了酿酒酵母上调表达酒精形成及醋酸代谢相关酶的活性。在厌氧发酵条件下,当发酵液中可发酵性糖量消耗近一半时,丙酮酸浓度达到最大值,随后丙酮酸经PDC催化生成乙醛,乙醛在ADH的作用下还原生成乙醇。乙醛和乙醇产量的变化基本与PDC和ADH酶活性变化一致。ACS、ICL和MS在醋酸代谢过程中起到关键作用。ACS将辅酶A和乙酸转化成乙酰CoA,乙酰CoA进入线粒体与草酰乙酸在柠檬酸合成酶作用下形成柠檬酸,柠檬酸在顺乌头酸酶作用下转化成异柠檬酸,异柠檬酸通过ICL的裂解产生琥珀酸酸和乙醛酸,随后乙醛酸在MS作用下形成苹果酸。添加0.5~0.75 mmol/L抑制剂减弱丙酮酸进入TCA环通路的情况下,增强了酿酒酵母利用醋酸作为2C碳源的利用能力,提高了乙醛酸循环流量,进而表现出琥珀酸和苹果酸产量的增加。
利用具有一定醋酸代谢能力的酿酒酵母进行醋酸代谢,通过研究添加丙酮酸转运蛋白抑制剂促进对醋酸的代谢,揭示醋酸的代谢机制,为调控荔枝酒挥发酸含量提供必要的理论支撑。试验虽然基于荔枝汁为发酵基质,但可为其他热带果酒挥发酸的调控提供借鉴。
[1] Jagtap U B, Bapat V A. Wines from fruits other than grapes: Current status and future prospectus[J].Food Bioscience,2015,9:80-96.
[2] Rib reau-Gayon P, Glories Y, Maujean A et al. Alcohols and other volatile compounds. The chemistry of wine stabilization and treatments[J].Handbook of enology, 2006,2:51-64.
[3] 王 进,赵德阳,陈 勇.降低荔枝酒挥发酸的方法[J].酿酒科技,2007(7):34-37.
[4] Vasserot Y, Mornet F, Jeandet P. Acetic acid removal by Saccharomyces cerevisiae during fermentation in oenological conditions Metabolic consequences[J]. Food Chemistry,2010,119(3):1220-1223.
[5] 郝文娟,韦 娜,方 佳,等.酿酒酵母DCCS101脱除荔枝酒挥发醋酸的效果研究[J].热带农业科学,2010,30(11)40-43.
[6] 曾英杰,方 佳,钟秋平,等.荔枝酒酿造中酿酒酵母同步代谢醋酸的研究[J].热带作物学报,2015,36(5):981-986.
[7] Dixon G H, Kornberg H L. Assay methods for key enzymes of the glyoxylate[J].Biochem J,1959,72:3.
[8] Ornston LN, Ornston MK. Regulation of glyoxylate metabolism in Escherichia coli K-12[J].J Bact,1969,98:1098-1108.
[9] 高年发,张 军,韩英素.高效液相色谱法测定葡萄酒中的有机酸[J].酿酒,2004,31(1):67-69.
[10] Pampulha M E, Loureiro-Dias M C. Energetics of the effect of acetic acid on growth of Saccharomyces cerevisiae[J].FEMS Microbiology Letters,2000,184(1):69-72.
[11] Taherzadeh M J,Niklasson C, Liden G. Acetic acid-friend or foe in anaerobic batch conversion of glucose to ethanol by Saccharomyces cerevisiae[J].Chemical Engineering Science,1997,52(15):2653-2659.
[12] Briquet M. Transport of pyruvate and lactate in yeast mitochondria[J].Biochim.Biophys. Acta,1977,459:290-299.
[13] 薛军侠,徐艳文,裴颖芳,等.葡萄酒中酵母菌高产甘油的研究进展[J].微生物学杂志,2008,28(5):77-82.
(责任编辑: 孙小岚)
Effects of Pyruvate Transporter Inhibitor on the Acetic Acid Metabolism ofSaccharomycescerevisiae
ZENG Yingjie, SHANG Yuhui, ZHONG Qiuping*
(CollegeofFood,HainanUniversity,Haikou,Hainan570228,China)
In order to reduce the acetic acid in lychee wine,S.cerevisiae, which could simultaneously use the fermentative sugar and acetic acid as its carbon resources, was used to investigate the effects of supplemented withα-Cyano-4-hydroxycinnamic acid (α-CCA) on acetic metabolism during lychee wine fermentation. The results indicated that supplemented with 0.5-0.75 mmol/L ofα-CCA had significantly influenced the acetic acid metabolism, since higher enzymatic activity of ADH, ACS, ICL and MS were expressed. When supplemented with 0.5 mmol/L ofα-CCA, compared with control, the amount of acetic acid metabolized was increased by 150 mg/L.
Saccharomycescerevisiae; lychee juice; pyruvic acid transport inhibitor;α-Cyano-4-hydroxycinnamic acid
2015-09-07; 2016-03-05修回
国家自然科学基金项目“荔枝酒酿酒过程中酿酒酵母代谢醋酸的调控机制”(31260398);海南省自然科学基金项目“热带果酒挥发酸的调控研究”(313044.00)
曾英杰(1989-),男,在读硕士,研究方向:热带果酒酿制。E-mail: phhzyj@126.com
*通讯作者:钟秋平(1966-),男,教授,博士,从事食品发酵研究。E-mail:hainufood88@163.com
1001-3601(2016)03-0135-0148-04
TS 201.3
A
加工贮藏·农产品质量
Processing and Storage·Agricultural Product Quality

