野生卷丹不定芽诱导及再生体系的建立
蒋 瑶, 陈文波, 周增丽
(凯里学院 环境与生命科学学院, 贵州 凯里 556011)
野生卷丹不定芽诱导及再生体系的建立
蒋 瑶, 陈文波, 周增丽
(凯里学院 环境与生命科学学院, 贵州 凯里 556011)
为野生卷丹种质资源的繁殖、保存与利用提供依据,采用随机区组试验方法探究NAA、6-BA和2,4-D不同配比对野生卷丹鳞茎不定芽诱导及再生植株形成的影响。结果表明:相同6-BA 浓度下,生长素对野生卷丹鳞茎不定芽的诱导作用依次为NAA>NNA+2,4-D>2,4-D,最佳不定芽诱导培养基为MS+6-BA 1.5 mg/L+NAA 0.3 mg/L,平均产芽6.21个;最佳增殖培养基为MS+NAA 0.5 mg/L+6-BA 1.0 mg/L,其增殖系数3.46;最佳生根培养基为1/2 MS+NAA 1.0 mg/L,平均生根6.20个。
野生卷丹; 不定芽诱导; 再生植株; 组织培养
百合属(Lilium)是多年生草本鳞茎花卉植物,其栽培历史悠久,是绿化美化及切花生产的重要花卉之一[1]。但我国野生百合的利用率较低,大多数未得到应有的关注与保护,仍有很多优良的野生百合资源有待开发[2]。卷丹(Linliumlancifolium)又名虎皮百合、倒垂莲,为百合科(Liliaceae)百合属多年生草本花卉,花下垂呈橙红色,内面有紫色斑点,具较高的观赏、药用和食用价值[3-4]。其分布广泛,主要存在于我国河北、陕西、辽宁、吉林和贵州等17个省,在贵州黔东南州主要分布于黄平、施秉和雷山等地。卷丹的繁殖主要依靠常规的鳞片包埋、鳞片扦插、分株芽和分球等,长期的无性繁殖导致其品种退化,如病害严重、产量降低及品质下降等[5]。此外,由于市场的需求量增大,人为的滥采滥挖,野生卷丹群体受到严重的破坏,保护和扩大野生卷丹资源迫在眉睫。利用组培诱导不定芽建立再生体系可缩短生长周期,快速培育植株,有效解决其退化问题,保护其野生资源,满足市场需求[6]。
卷丹组织培养始于20世纪80年代[7],以鳞片的研究最早且最易成功,为国内卷丹组织培养研究奠定了基础。目前,有关卷丹研究主要集中在遗传多样性[8]、核型分析[9]、功能基因克隆[10]、组织培养[11-17]、育种[5]以及种质资源保存[18]等方面。雷家军等[8]利用AFLP技术对卷丹遗传性状标记,并成功构建遗传图谱,为其分子育种奠定了基础。唐彪等[9]采用常规压片法对5个不同种源产地卷丹进行染色体观察发现,不同产地卷丹的染色体数目不同,为其有效保护和育种提供了背景资料。有研究[10]表明,利用RACE技术克隆的卷丹CCS基因已在其花瓣组织中表达。根据外植体的种类、采集季节和部位,其消毒试剂的选择及时间略有不同[19],陈贵华等[20-21]分别进行了卷丹消毒试剂的相关研究。张传海等[22]研究发现,不同部位鳞片分化不定芽的效果总体上呈中层>外层>内层。苏箐华等[23-24]研究发现,卷丹再生体系形成途径主要有器官型、器官发生型和体细胞胚胎发生型等3种,器官发生型常用且形成再生植株的成功率较高。张鹏等[13]研究发现,以鳞片为外植体诱导不定芽形成再生植株的最适培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L。谢杰等[25]用0.01~0.10 mg/L 2,4-D诱导宜兴百合小鳞茎产生愈伤组织并获得再生植株。体细胞胚胎发生型途径较其他2种途径复杂。翟彦[26]采用体细胞胚胎发生型途径成功获得“黄天霸”和“西伯利亚”花丝的胚性愈伤组织。沈琛[18]认为,玻璃化法超低温保存的最佳材料为继代2代卷丹组培苗茎尖,其液氮保存后存活率达93.3%,显著高于其他继代处理,达到保存种质资源的目的。
目前卷丹的组培研究主要以栽培种鳞茎为主,未见贵州省野生种的相关报道。为此,笔者以黔东南野生卷丹鳞片为材料,以MS为基础培养基,采用随机区组试验方法探究NAA、6-BA和2,4-D不同配比对不定芽诱导及再生植株形成的影响,以期筛选出各阶段最佳培养基配方,进一步缩短生长周期,为野生卷丹种质资源的繁殖、保存与利用提供依据。
1 材料与方法
1.1 供试材料
1.1.1 植物 野生卷丹,采自凯里学院后山。选用无病虫害,直径8~10 cm的鳞茎避光存放备用。
1.1.2 试剂 70%乙醇(AR,重庆川东化工),0.1% HgCl2,6-BA、NAA、2,4-D,MS基础培养基(固体培养基,含蔗糖3.0%,琼脂0.7%,pH5.8),试剂均为分析纯(AR),其产地为天津科密欧(乙醇除外)。
1.1.3 仪器与设备 BSA124S电子天平(赛多利斯),XQ-LS-75SⅡ高压蒸汽灭菌锅(上海博讯),JH-1S超净工作台(北京科伟)。
1.2 试验方法
1.2.1 外植体消毒 将野生卷丹鳞茎最外2层去除,然后取较外层无病斑、较厚实且颜色均匀的鳞片用流水冲洗1~2 h,洗净并控干水分后放入超净工作台消毒:乙醇消毒30 s→无菌水清洗2~3次→HgCl2+1~2滴吐温-80消毒10 min→无菌水清洗4~5次后备用。
1.2.2 试验设计 该试验均以MS为基础培养基,并根据试验设计(表1)要求分别添加不同浓度配比的6-BA、NAA以及2,4-D。培养条件:光照时间16 h/d,温度25℃,相对湿度70%~75%。1)不定芽诱导培养。将已消毒的鳞茎切成0.8 cm×0.8 cm的小方块,接种到诱导不定芽培养基中。试验设9个处理,每个处理接种10瓶,每瓶接种外植体3个,3次重复。2)不定芽增殖培养。将初代培养诱导分化较健壮且无污染的丛生芽(芽高2~3 cm)分离成单株,接入不定芽增殖培养基中继代增殖培养。试验设9个处理,每个处理接种5瓶,每瓶接种不定芽3~5个。3)不定芽生根培养。将增殖培养的株高2 cm左右较强壮的丛生芽分离成单株,转接入不同的生根培养基中。采用1/2 MS作为基础培养基,试验设9个处理,每个处理接种5瓶,3次重复。
表1 野生卷丹外植体不定芽诱导、增殖和生根培养基添加激素的组成与浓度

Table 1 Hormone composition and concentration of different media for induction, multiplication and rooting of L.lancifolium adventitious buds mg/L
注:-表示未添加。
Note:-no addition.
1.2.3 观测指标 接种完成培养一段时间后,进行不定期观察、拍照。 1) 不定芽诱导培养。待其生长60 d后统计外植体诱导率及单颗外植体诱导不定芽的个数,计算平均产芽数和不定芽诱导率。2) 不定芽增殖培养。待其生长30 d后观察不定芽的增殖情况,观察不定芽长势并统计不定芽数量,计算不定芽增殖系数。3) 不定芽生根培养。待其生长40 d后统计其生根率、生根总数及单个鳞茎的生根数。




1.3 数据统计分析
数据采用Excel 2007软件进行统计分析。
2 结果与分析
2.1 不同浓度激素配比对卷丹鳞茎不定芽诱导的影响
2.1.1 不定芽的形成 从图1可见:将卷丹鳞茎接种在不同激素配比培养基中,4~5 d后小鳞茎由乳白色(图1A)变为青褐色(图1B),6~8 d后鳞茎的内面出现浅黄色的小凸起,不定芽即将形成(图1C);10~12 d后小凸起拔高形成不定芽,进一步形成丛生芽,且颜色转变为青绿色,而在小鳞茎的切口处出现不同程度的木质化(图1D);20 d后不定芽抽生叶片,且芽的长势良好(图1E)。

注:A,乳白色鳞茎;B,青褐色鳞茎;C,鳞茎内表面出现小凸起;D,鳞茎切口处木质化;E,不定芽形成。
Note: A, ivory bulbs; B, greenish brown bulbs; C, small uplift on bulbs; D, lignification on the incision of bulb; E, formation of adventitious buds.
图 1 不同浓度激素配比处理卷丹鳞茎不定芽的形成过程
Fig.1 Formation process of adventitious buds cultured on media with different concentration and ratio of hormones
2.1.2 产芽数及诱导率 从图2可见: 1) 不同处理对鳞茎的诱导产芽数不同,除处理7~9外,其余处理产芽数均高于3个。其中:浓度一定,不同低浓度2,4-D和NAA能够促进不定芽诱导;处理7~9的诱导效果最差,处理4的诱导产芽数最多,为6.21个,且芽粗壮,长势良好,分布集中;其次为处理1,产生不定芽4.21个,数目相对较多且分布较稀疏。表明,相同NAA浓度下,6-BA浓度为1.0~1.5 mg/L均有利于诱导不定芽。处理2、处理3、处理5和处理6平均产芽3.38个,产芽数较少,长势一般。表明,6-BA表明,高浓度6-BA(2.0 mg/L)对不定芽的诱导有一定的抑制作用,导致出芽率低,且鳞茎褐化严重。2) 不同处理对鳞茎的诱导率不同,各处理诱导率均高于26%,平均达47.04%。其中,处理6的诱导率最高,达63.33%,处理8最低,为26.67%,处理1、处理2、处理4和处理5均高于45.00%,其余处理低于41.00%。表明,较低浓度NAA或2,4-D(0.5 mg/L)可促进卷丹鳞茎产芽;6-BA浓度为1.0~1.5 mg/L时可促进不定芽的诱导,6-BA浓度继续升高则导致诱导率降低,表明,高浓度6-BA抑制不定芽的生长,诱导效果不佳。从不定芽出芽数及生长状况看,处理4(MS+6-BA 1.5 mg/L+NAA 0.3 mg/L)培养基为最佳诱导不定芽培养基。
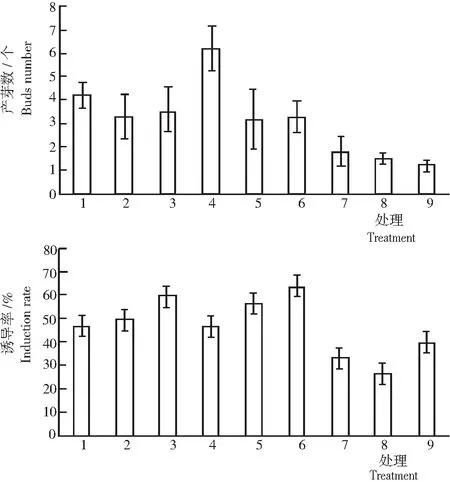
图 2 不同浓度激素配比处理卷丹鳞茎的产芽数与诱导率
Fig.2 Inducted buds number and induction rate ofL.lancifoliumbuibs cultured on media with different concentration and ratio of hormones
2.1.3 6-BA对不定芽的诱导 当NAA浓度为0.5 mg/L时,随6-BA浓度的升高,鳞片产生的不定芽数量增多且芽壮、葱绿。其中,6-BA浓度为1.0 mg/L时,不定芽长势较好,但数量相对较少,生长较慢(图3A);当6-BA浓度达1.5 mg/L时,不定芽生长密集且长势良好(图3B);当6-BA浓度达2.0 mg/L时,不定芽数量增多且粗壮,但分化芽的能力较慢(图3C)。表明,同一NAA浓度下,低浓度6-BA可促进不定芽的诱导,但超过一定浓度后,其诱导效果降低,分化能力减弱。
经方差分析,相同6-BA浓度下,不同生长素(NAA、2,4-D和NAA+2,4-D)均能诱导形成不定芽,其诱导效果依次为NAA>NAA+2,4-D>2,4-D。说明,低浓度生长素诱导不定芽具有促进作用,尤其是NAA效果最佳。

注:A~C中NAA浓度为0.5 mg/L,6-BA浓度依次为1.0 mg/L、1.5 mg/L和2.0 mg/L。
Note: A, Medium with 0.5 mg/L NAA + 1.0 mg/L 6-BA; B, Medium with 0.5 mg/L NAA + 1.5 mg/L 6-BA; C, Medium with 0.5 mg/L NAA + 2.0 mg/L 6-BA.
图 3 不同浓度6-BA 处理卷丹鳞茎的不定芽生长
Fig.3 Growth of adventitious buds cultured on media with different 6-BA concentration
2.2 不同浓度激素配比对卷丹不定芽增殖培养的影响
2.2.1 增殖生长 从图4可知,将生长健壮的不定芽转接入增殖培养基中,20 d后单芽大部分出现膨大,颜色转绿的现象;培养30 d左右,丛生芽的数目明显增多,大部分单芽能够分化出多个不定芽,且芽体更为粗壮。

注:A,不定芽开始增殖;B,不定芽膨大。
Note: A, Multiplication of adventitious buds; B, Expansion of adventitious buds.
图 4 不同浓度激素配比处理卷丹不定芽的增殖生长
Fig.4 Multiplication of adventitious buds cultured on media with different concentration and ratio of hormones
2.2.2 增殖系数和增殖率 从图5可知: 1) 增殖系数。处理4~6的增殖芽数最多,鳞茎粗壮且分化能力强,增殖系数>3,最大达3.46。其中,当6-BA浓度为1.0 mg/L时,随NAA浓度的增加,增殖系数呈先升后降的趋势。NAA浓度以0.3~0.5 mg/L较为适宜,高浓度NAA(1.0 mg/L)对鳞茎增殖无明显促进作用。当6-BA浓度为0.5 mg/L时,处理1~3的增殖芽数较多,3个处理以处理2的增殖系数最高,为2.88。当6-BA浓度达2.0 mg/L(处理7~9)时,增殖芽数相对减少,其鳞茎较为粗壮,但对不定芽的增殖作用较小。表明,较高浓度的6-BA对不定芽壮苗有一定的促进作用,但对丛生芽分化的促进效果较差,其增殖系数较低。2) 增殖率。各处理的增殖率均高于49.00%,且处理间存在差异。其中,处理1和处理4的增殖率达56.67%,且其不定芽的长势良好;其余处理的增殖率均低于54%,且其不定芽数量相对较少,长势较弱。表明,6-BA浓度为0.5~1.0 mg/L时,随6-BA浓度的增加,分化芽的数量依次增加,6-BA浓度继续升高,出芽个数则相对减少。
经方差分析,相同浓度6-BA条件下,不同浓度NAA对不定芽增殖的促进作用依次为0.5 mg/L>0.2 mg/L>1.0 mg/L,但处理间影响效果的差异不显著。其中,NAA 0.5 mg/L为不定芽增殖最佳浓度,较低浓度NAA对不定芽增殖效果相对较差,高浓度NAA对不定芽增殖有抑制作用。同时,在NAA浓度相同条件下,随6-BA浓度的升高,各处理之间诱导不定芽增殖的差异显著。其中,0.5~2.0 mg/L 6-BA对不定芽增殖生长具有促进作用。根据丛生芽的质量、增殖系数及长势等判断,处理5丛生芽的增殖系数最大,丛生芽较粗壮,长势良好,不定芽增殖的最佳培养基为MS+NAA 0.5 mg/L+6-BA 1.0 mg/L。

图5 不同培养基处理卷丹不定芽的增殖系数与增殖率
Fig.5 Multiplication coefficient and rate of adventitious buds cultured on different media
2.3 不同浓度激素配比对卷丹不定芽生根培养的影响
2.3.1 生根生长 从图6可知,经增殖后的茁壮不定芽移入1/2 MS基础培养基培养30 d后分化出褐色不定根,上有细小白色根毛,根系发达且粗壮;某些不定芽的芽体膨大,但根为白色且细小,无明显根毛。
2.3.2 生根量与生根率 由图7可知: 1) 生根量。无论是不定根的数量还是根系的发达程度,处理7(1/2 MS+NAA 1.0 mg/L)均优于其他处理,其平均生根数最高,达6.20个,根系相对发达且粗壮;其次为处理4,平均生根4.2个,根系发达程度一般;处理3、处理6和处理9在观察期内未发现不定根。由此表明,随NAA浓度升高,平均生根数逐渐减少;添加低浓度的6-BA对生根有抑制作用,6-BA浓度为0.1 mg/L时,处理3、处理6和处理9未产生不定根;不同浓度NAA对生根有促进作用。2)生根率。处理4、处理5和处理7的生根率均高于75%,其中,处理7的生根率最高,达93.75%;处理1、处理2和处理8的生根率为58%~75%,且生根较慢,不定根细小而少,生长一般;处理3、处理6和处理9的生根率为0,无不定根的生成。由此表明,随NAA浓度的升高,生根率呈下降趋势;6-BA浓度过高对生根不利。
经方差分析:相同浓度 NAA条件下,不同浓度6-BA对不定芽生根的促进作用依次为0 mg/L>0.05 mg/L>0.1 mg/L,且处理间差异显著。同时,相同浓度6-BA条件下,不同浓度NAA浓度对不定芽生根的促进作用依次为0.1 mg/L>0.5 mg/L>1.0 mg/L,且处理间差异明显。说明,不同浓度的NAA与6-BA配比对不定芽的生根有较大影响。根据丛生芽生根数及生根状况初步判定,处理7丛生芽的生根数最多,不定根粗壮,1/2 MS+NAA 1.0 mg/L为最佳不定芽生根培养基。

注:A,粗壮不定根;B,细小不定根。
Note: A, sturdy adventitious roots; B, tiny adventitious roots
图6 卷丹不定芽在1/2 MS基础培养基上的不定根生长
Fig.6 Growth of adventitious roots of adventitious buds cultured on 1/2 MS
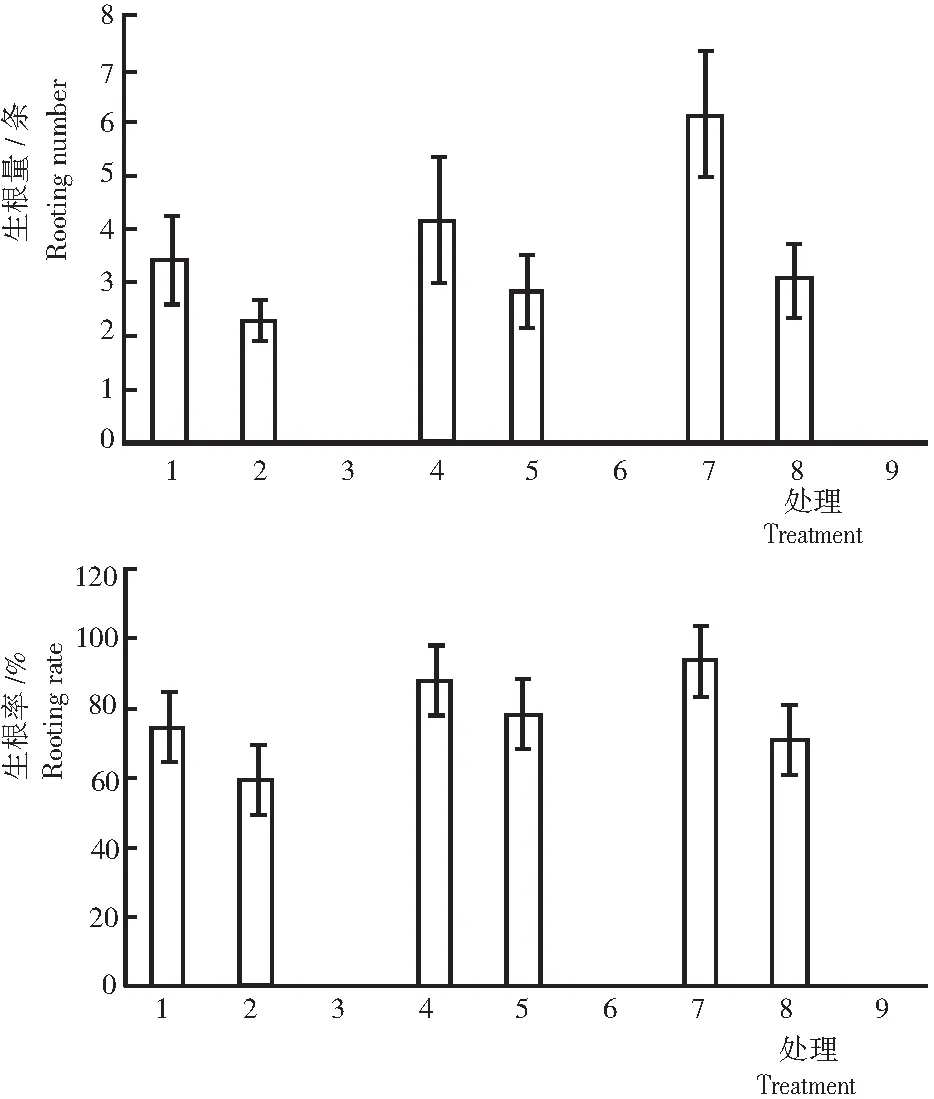
图7 不同浓度激素配比处理卷丹的生根量和生根率
Fig.7 Rooting number and rate of adventitious buds cultured on different concentraticn of hormone
3 结论与讨论
1) 在6-BA浓度一定的情况下,NAA对野生卷丹鳞茎不定芽的诱导效果明显高于2,4-D和NAA+6-BA组合;最佳不定芽诱导培养基为MS+6-BA 1.5 mg/L+NAA 0.3 mg/L。与潘理云等[13,22,27]的结论一致。说明,该试验筛选的诱导培养基适合诱导贵州野生卷丹。
2) 野生卷丹鳞片诱导不定芽的最佳6-BA浓度为1.5 mg/L,其平均芽个数最多且不定芽生长情况良好,与石印等[15-16]的研究结论一致,但与钟灿等[17]的结果不同,可能与后者pH的调节及培养条件不同有关。
3) 6-BA浓度为0.2~1.5 mg/L时,适当的高浓度可以有效地提高卷丹继代增殖培养的增殖系数,但浓度过高则可能出现抑制作用。该试验继代增殖培养最适6-BA和NAA浓度分别为1.0 mg/L和0.2~0.5 mg/L,最佳生根培养基为6-BA 1.0 mg/L+NAA 0.5 mg/L,与郭海滨等[4, 28-29]的结果一致;不定芽增殖培养最适6-BA浓度为0.5~2.0 mg/L。
4) NAA在一定浓度下能够促进生根,且生根效果较好。该试验最适不定芽生根培养基为1/2 MS+NAA 1.0 mg/L,与何薇等[3,11,30]的研究结果一致。但路森[31]研究发现,最佳生根培养基为1/2 MS+NAA 0.3 mg/L,生根率为94%,较低浓度的NAA更有利于不定根的产生,与该试验的结果不一致,可能与百合品种有关。
5) 有关野生百合组培外植体的选择与消毒方法、激素的选择与配比、再生途径等方面的研究均已有相关文献报道[14],但存在差异。该试验使用70%乙醇消毒30 s,再用0.1% HgCl2+1~2滴吐温-80消毒10 min的处理方法能够大幅度地降低初代不定芽诱导时的污染,这与王昱淇[32]的结果一致。黄敏等[33]研究发现,外层鳞片用75%乙醇处理30 s,再用0.1% HgCl2浸泡18~20 min最佳;中层和内层鳞片用75%乙醇处理30 s,再用0.1% HgCl2浸泡14~16 min最佳。该试验仅选用中外层鳞茎进行研究,存在一定的局限性,今后将在外植体选择等方面进一步进行试验。
[1] 路 艳.大百合组织培养植株再生技术研究[D].雅安:四川农业大学,2005.
[2] 杨利平,杨青杰.百合研究综述[J].韶关学院学报:自然科学版,2003,24(9):87-89.
[3] 何 微,景丹龙,陈 强,等.卷丹的原球茎诱导及植株再生[J].湖北农业科学,2012,51(2):396-399.
[4] 郭海滨,雷家军.卷丹百合鳞片及珠芽组织培养研究[J].中国农学通报,2006,22(2):72-74.
[5] 潘佑找,林 强,陈香丽,等.鳞片不同放置方式对卷丹快速繁殖的影响[J].湖北农业科学,2009,48(10):2500-2501.
[6] 潘理云,张海洋.宜兴百合组培快繁技术的研究[J].安徽农业科学,2012,40(10):5748-5750.
[7] 陈为民,宋为民.卷丹和青岛百合的组织培养及分化[J].植物生理学通讯,1982(2):35-42.
[8] 雷家军,于海涛,王志刚,等.卷丹百合AFLP反应体系的建立与优化[J].东北农业大学学报,2013,40(10):122-127.
[9] 唐 彪,杨利平,侯 霏.不同种源卷丹染色体数目变异[J].东北林业大学学报,2014,42(11):158-160.
[10] 王志刚,印东生,张惠华,等.卷丹百合遗传育种研究进展[J].园艺与种苗,2014(1):1-3.
[11] 傅伊倩,孔 滢,刘 燕.大花卷丹的组织培养及限量生长保存[J].植物生理学报,2012,48(3):277-281.
[12] 代建丽,吴兴超,刘梦婷,等.宜兴百合鳞茎不定芽的诱导及增殖[J].湖北农业科学,2014,53(21):5283-5284.
[13] 张 鹏,巩延苹,段祖安.卷丹百合组培快繁技术研究[J].山东林业科技,2009(4):73-74.
[14] 王洁琼.中国野生百合资源调查及遗传多样性分析[D].北京:北京林业大学,2006.
[15] 石 印,向圆媛,孙 明.大花卷丹离体培养快速繁殖体系的建立[J].河南农业科学,2013,41(1):98-101.
[16] Liu H M, Ling K Y, Zhang X B.The study on induction and proliferation of tube bulbs in Lilium brownii[J].Agricultural Science and Technology,2008,9(1):18-20.
[17] 钟 灿,王 蕾,刘 浩,等.卷丹百合鳞茎高效离体再生体系的研究[J].中国现代中药,2015,17(2):137-140.
[18] 沈 琛.卷丹茎尖继代培养对玻璃化法超低温保存效果的影响[D].北京:北京林业大学,2014.
[19] 巩振辉,申书兴.植物组织培养[M].北京:化学工业出版社,2013.
[20] 陈贵华,石 岭,吴玉峰.卷丹百合鳞片组织培养研究[J].内蒙古农业大学学报:自然科学版,2009,30(4):61-64.
[21] 李翠花,吴 震,杨 芸,等.‘宜兴百合’珠芽不定芽的诱导和增殖条件的研究[J].上海农业学报,2008,24(1):27-31.
[22] 张传海,葛自兵,白雪峰,等.食用百合卷丹离体培养再生体系的建立[J].皖西学院学报,2012,28(2):1-3.
[23] 苏箐华.渥丹与川百合组培快繁体系的研究[D].武汉:华中农业大学,2014.
[24] 陈 龙.百合鳞茎薄层胚性愈伤组织诱导及再生植株遗传稳定性鉴定[D].杨凌:西北农林科技大学,2013.
[25] 谢 杰,余沛涛,王全喜.宜兴百合通过愈伤组织诱导再生鳞茎的研究[J].上海农业学报,2007,23(3):96-100.
[26] 翟 彦.切花百合新品种体细胞胚胎发生研究[D].杨凌:西北农林科技大学,2010.
[27] Pan Y Z,Zhan J P,Zeng X M,et al.Study on tissue culture and rapid propagation of wild lilium lancifolium[J]. Medicinal Plant,2011,2(7):69-71.
[28] 张彦妮,边红琳.6-BA和NAA对亚洲百合杂种系后代组培苗鳞片不定芽诱导的影响[J].江苏农业科学,2012,40(7):52-54.
[29] 雷家军,徐 莹.垂花百合鳞片离体培养研究[J].东北农业大学学报,2013,44(1):96-100.
[30] Bo W,Zhu Y P,Qiu X J,et al.Study on seed germination conditions and in vitro tissue culture of Linlium lancifolium[J].Agricultural Biotechnology,2012,1(3):7-11.
[31] 路 森.亚洲百合“红色警报”组培快繁研究[J].现代农村科技,2013(6):52-54.
[32] 王昱淇.植物组织培养中存在的问题及其预防措施[J].南方农业,2014,8(12):136-139.
[33] 黄 敏,梁春辉,岳海林,等.东方百合‘Sorbonne’鳞片离体培养研究[J].现代农业科技,2014(22):136-137.
(责任编辑: 王 海)
Adventitious Buds Induction and Plantlet Regeneration of WildLiliumlancifolium
JIANG Yao, CHEN Wenbo, ZHOU Zengli
(CollegeofEnvironmentandLifeScience,KailiUniversity,Kaili,Guizhou556011,China)
The induction and plantlet regeneration of wildL.lancifoliumadventitious buds cultured on media with different concentration and ratio of NAA, 6-BA and 2,4D were studied by a randomized block test to provide the scientific basis for reproduction, conservation and utilization of wildL.lancifoliumresources. Results:under the same 6-BA concentration,the induction ofL.lancifoliumadventitious buds is NAA >NNA+2,4-D>2,4-D.The optimum medium for induction ofL.lancifoliumadventitious buds is MS+6-BA 1.5 mg/L+NAA 0.3 mg/L and average 6.21 buds can be inducted. The optimum medium for multiplication ofL.lancifoliumadventitious buds is MS+NAA 0.5 mg/L+6-BA 1.0 mg/L and its multiplication coefficient is up to 3.46. The optimum medium for rooting ofL.lancifoliumadventitious buds is 1/2 MS+NAA 1.0 mg/L and average 6.20 roots are produced.
WildLiliumlancifolium; adventitious buds Induction; regeneration plantlet; tissue culture
2015-09-11; 2016-05-05修回
贵州省科技厅自然科学研究项目“黔东南州野生百合耐热基因的克隆及其耐热性研究” [黔科合J字 (2014) 2153];凯里学院博士专项基金项目“黔东南州野生百合高效离体培养及理化分析”(BS201332)
蒋 瑶(1982-),女,副教授,博士,从事植物生物技术研究。E-mail: jiangyao0221@163.com
1001-3601(2016)05-0212-0097-06
S682.2
A
园艺·中药材
Horticulture·CHinese Herbal Medicimes

