肌肉因子Irisin与运动
林文弢,鞠丽丽,吴菊花,翁锡全
(1.广州体育学院,广东 广州 510500;2.上海体育学院,上海 200438)
肌肉因子Irisin与运动
林文弢1,鞠丽丽1,吴菊花2,翁锡全1
(1.广州体育学院,广东 广州510500;2.上海体育学院,上海200438)
摘要:Irisin是新近在骨骼肌中发现的肌肉因子,可促进白色脂肪细胞'棕色化',增加能量消耗、降低体重。运动通过影响Irisin、UCP1的表达来调控脂代谢进而改善肥胖、糖尿病等代谢性疾病,但不同运动方式和运动强度对Irisin表达的影响规律并不相同。将深入探讨运动调控Irisin表达变化的作用机制,旨为防治肥胖等代谢性疾病提供新视角。
关键词:Irisin;肥胖;白色脂肪‘棕色化’;运动
研究方向:运动生物化学
骨骼肌是机体的动力器官,也是内分泌器官,具有强大的内分泌功能,可通过自/旁分泌方式调节能量代谢和运动功能。Pedersen[1]认为,缺乏运动可导致骨骼肌内分泌功能紊乱,也是引起肥胖、2型糖尿病等疾病的独立风险因子。但是,目前仍缺乏安全有效防治肥胖等代谢性疾病的新策略。新肌肉因子—Irisin(鸢尾素)是Spiegelman教授及其研究团队首次发现并于2012年在《Nature》杂志发表论文,他们声称运动可引起骨骼肌Irisin分泌增加,促进细胞从“白脂肪”变成“棕脂肪”并氧化产热。此外,该研究还发现血液中小剂量Irisin浓度升高即可增加能量消耗、降低体重[2]。
鉴于Irisin在产热减肥和能量消耗等方面的潜在意义,众多学者在多领域对Irisin进行了深入拓展性研究。这为进一步揭示运动健身的原理提供可能,同时也为防治肥胖等代谢性疾病的研究提供新视角。然而,在不同运动方式和运动强度对Irisin表达影响方面,却出现纷乱不一的研究结果。本文试图总结三年来这方面的研究结果,尝试找出不同运动方式和运动强度对Irisin表达的影响规律,深入探索运动调控Irisin表达的作用机制,寻求防治肥胖代谢性疾病的生物学靶点,对其运动康复具有重要的理论价值和应用前景。
1Irisin 的概述
1.1Irisin的结构及分布
Irisin是2012年Bostrom[2]等发现的一种可促进白色脂肪向棕色脂肪转化的肌肉因子,是由Ⅲ型纤连蛋白组件包含蛋白5(FNDC5)经剪切、修饰后形成的一段约110个氨基酸、分子量为12KDa的多肽片段。研究发现,Irisin肽段主要是FNDC5蛋白中的N末端纤连蛋白Ⅲ结构域,FNDC5的N-端有一个信号序列(sp),中间是Ⅲ型纤连蛋白结构域(FND),紧接着为疏水氨基酸区(H)和羧基酸C末端(C)。研究者对Irisin采用基因序列分析发现,人体和小鼠Irisin氨基酸序列同源性为100%[2]。
Irisin几乎分布于机体所有的组织和器官。Suleyman Aydin[3]等研究发现:骨骼肌产生的Irisin只有一部分释放到血液中,而心脏、肾脏、皮肤结缔组织等亦可释放Irisin,可见Irisin并不纯粹来源骨骼肌。此外,有研究证实[4],唾液中亦检测到Irisin,其浓度高于血液,并且运动后唾液Irisin水平显著升高,由此说明外分泌腺体也可分泌Irisin。
1.2Irisin的生物学功能
Irisin可增加能量消耗和促进细胞从“白脂肪”变成“棕脂肪”并氧化产热。研究显示,人体和小鼠在运动后其体内irisin浓度都显著增加,这意味着irisin携带的信息可能是从肌肉组织传到脂肪组织引起的[5]。棕色脂肪组织(brown adipose tissue, BAT)和白色脂肪组织(white adipose tissue, WAT)是哺乳动物体内脂肪的两种存在形式,其中白色脂肪主要分布在皮下,并以三酰甘油形式把多余能量储存体内;而棕色脂肪组织含有大量线粒体,主要以产热形式消耗体内多余能量[6]。解偶联蛋白1(uncoupling protein1, UCP1)是BAT细胞中唯一调节适应性非寒战产热的关键基因,也是BAT的特异性表达基因,其可跨越线粒体内膜转运质子,氧化脂肪酸,使其与ATP发生解耦联,减少ATP合成并以热能的形式散发能量进而降低体重[7]。研究表明,Irisin可引起脂肪组织中 UCP1mRNA和蛋白质表达升高,增加能量消耗,导致机体产热增加,并呈剂量-反应关系[2]。小鼠经病毒介导后,其肝脏过表达FNDC5并诱导血浆Irisin表达水平升高,从而导致皮下白色脂肪UCP1mRNA浓度显著升高,能量消耗增加。这说明Irisin作用于白色脂肪细胞后可刺激机体UCP1表达,并导致能量消耗升高。
另外,WAT中棕色脂肪样细胞经过Irisin处理后可诱导其发生棕色化,这可能是由于脂肪分解代谢加快才降低了体重[8]。研究发现,Irisin处理皮下脂肪来源的脂肪细胞后,UCP1mRNA表达上调,UCP1阳性脂肪细胞增多,线粒体密度增加,细胞呈现棕色脂肪样表型[9],说明Irisin可促进白色脂肪细胞向棕色脂肪细胞表型转化,提高了线粒体代谢能力,增加了细胞氧耗和能耗,从而满足人体运动所需的能量。此外,大量研究也表明Irisin还可能与胰岛素抵抗、神经系统生长发育有关,但尚需更多的确证研究[10]。
2不同运动方式对Irisin表达的影响
运动是防治肥胖的关键,规律的体育运动有助于维持脂代谢平衡。肌细胞因子Irisin被认为是运动效应分子机制的核心,故众多学者在多领域对Irisin方面的研究进行了深入探讨。研究表明,运动对骨骼肌及血中Irisin表达有促进作用,而采用不同运动方式对Irisin表达及对机体的影响规律不一致(表1)。Bostrom[2]等对健康成人进行10周耐力训练后发现,骨骼肌中FNDC5表达升高,血浆Irisin水平升高2倍。同样,Timmons和Lopez-Legarrea P[11,12]等对60岁以上的肥胖人群进行类似的研究也得出了同样的结果。另外,Ayesha[13]等对高脂饮食肥胖小鼠进行8周耐力运动(15m/min,60min/次,5天/d)后发现,小鼠血中Irisin表达升高,其体重和腹股沟脂肪含量下降,而肌肉质量增加,糖耐量改善。表明Irisn可以增加能量消耗,降低体重,显著改善饮食诱导的胰岛素抵抗。长期运动可增加小鼠体内Irisin表达,但不同受试群体在运动后,骨骼肌Irisin的变化不尽相同。研究证实,小鼠3周自主跑轮运动后,其骨骼肌FNDC5表达升高,血浆Irisin水平也显著增加。但有研究者发现健康受试者在2~3组的急性冲刺跑后,其体内Irisin浓度显著增加,而8周无氧运动或21周耐力运动后,Irisin水平无发生变化,故推测可能出现运动性适应[14,15]。Kim[16]等以28名肥胖者为研究对象,探讨有氧运动、抗阻运动与循环irisin水平、BMI及代谢相关参数之间的关系,结果显示抗阻运动组的循环Irisin水平显著性增加,而有氧运动组循环Irisin水平并未出现显著性变化,此外研究结果还显示,循环irisin水平与肌肉质量呈正相关,而与脂肪含量呈负相关。另外,在Hecksteden等[17]的研究中也发现,有氧运动和力量训练两组的血清Irisin水平与对照组相比,不但没有升高相反出现下降趋势。提示不同的运动方式可能对运动后Irisin表达反应有所差异。
冷暴露、外源Irisin给予、急、慢性运动等外源性应激刺激可通过上调Irisin表达,显著促进白色脂肪产生棕色脂肪样产热效应,降低体重,改善胰岛素抵抗。Huh[23]等测定了健康女性循环Irisin水平,分析了Irisin与代谢参数、体质之间的关系,发现Irisin与血糖、BMI等成正相关,而与胆固醇、脂联素和胰岛素成负相关。然而Moreno-Navarrete等以高加索人为研究对象,发现循环中Irisin与BMI、空腹血糖和TC呈负相关[18]。研究还发现,一次急性运动后即刻,血液Irisin水平升高或呈升高趋势,但也有不同研究结果。Czarkowska[19]观察到,大鼠经过急性短暂运动后,血清Irisin水平未发生显著性变化,腓肠肌红肌中Irisin蛋白水平表达升高,而腓肠肌白肌中却表达减少。而12名年轻健康受试者在进行90min的跑台训练时发现,血浆Irisin水平在开始运动的1h内大幅升高,而运动结束后及休息20min后,均未检测到Irisin水平升高[20]。研究证实,一次性急性运动后Irisin水平呈现一过性升高,随后又恢复到基础水平。
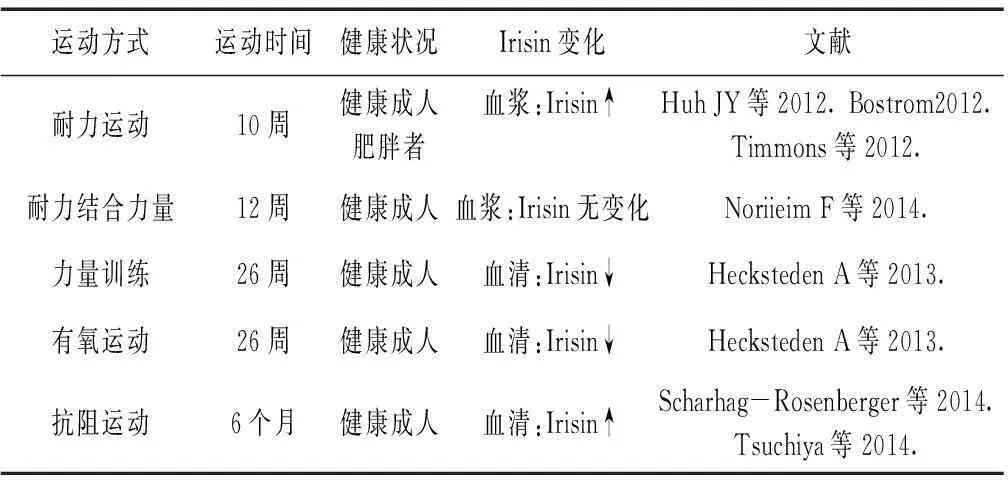
表1 不同运动方式对血液Irisin的影响
综上可知,无论是急性还是慢性运动训练、间断亦或是持续运动训练,肌肉或循环Irisin水平均有不同程度的升高,但目前仍存在争议,出现这种矛盾结果的原因可能与种族差异、实验采用的运动方式、运动强度、检测方法、样本量大小、研究对象性别、年龄及肥胖程度等因素有关。另外,Irisin亦可能是一种应激因子,可根据不同运动方式产生适应性和反向调节性。而经过较长时间的耐力运动,机体Irisin变化不大,这可能是Irisin对运动的应激反应趋向轻缓的原因。因此,随后的研究可从这些方面展开深入探索,可能为寻找并阐明运动防治肥胖等代谢性疾病提供有效途径。
3不同运动强度对Irisin表达的影响
诸多研究已证实,运动强度也是促进骨骼肌和循环血液中Irisin表达的因素之一,但具体影响规律不一致。文献报道,低强度有氧运动和中等强度运动均可引起血中Irisin表达显著升高,高强度运动可使正常体重健康者血中Irisin表达有升高趋势,但另外一些实验中,研究结果并不一致。研究表明,一次性大强度运动30min后,受试者血浆Irisin浓度明显升高,2h后又回落到基础值水平[21]。健康成人进行10周功率自行车锻炼(4~5次/d,20~35min/次,平均强度65%VO2)后发现,其骨骼肌中FNDC5、PGC1αmRNA水平显著增加,血浆Irisin浓度明显升高[2]。而7名中年男性一次性45min户外中速跑步(7.3km/h)后唾液Irisin水平显著升高,血清Irisin呈升高趋势,但无统计学意义[4]。另有研究证实,21周长期耐力运动后未发现骨骼肌FNDC5和血清中Irisin表达升高,健康年轻人进行高强度抗阻运动后可检测到FNDC5mRNA表达升高,血清Irisin未发生显著性变化[22]。而年轻健康成人进行中等强度运动后血清Irisin与对照组相比升高2.8~3.1倍,最大强度运动后血清Irisin呈升高趋势,但无统计学意义[23]。
目前对于长时间耐力运动对Irisin的表达影响研究较多,运动方案相对成熟,而对于不同运动强度、不同时间特别是动物实验关于这方面的研究较少,得出的结论不一,尤其是对于肥胖人群的研究更少,且存在不同的观点与方案。今后的研究可从不同运动强度和运动时间来设计运动方案,能够针对性的开展动物实验和人体实验研究,将有助于探寻运动减肥的作用机理。
4运动调控Irisin表达的作用机制
过氧化物酶体增殖物激活受体γ共激活因子α(PGC1-α)参与能量代谢、肌纤维类型转化和线粒体生成等,对WAT向BAT转化及UCP1基因的表达起着至关重要的作用[24,25]。最新研究报道:运动诱导骨骼肌表达PGC1-α,而PGC1-α对膜蛋白FNDC5表达有促进作用,FNDC5断裂转变为Irisin[2]。Pontus等[26]通过对PGC1-α转基因小鼠的备选基因筛选后发现,骨骼肌中包含FNDC5在内的5种依赖PGC1-α的分泌蛋白质被上调,而对骨骼肌特异敲出PGC1-α基因的小鼠研究证实,小鼠骨骼肌中FNDC5mRNA表达显著下调,Irisin水平下降72%,提示PGC1-α参与FNDC5和Irisin的表达调控过程。另有研究显示,人体和鼠在快速剧烈运动后PGC1-α和Irisin表达会出现一过性升高,随后即可恢复到运动前水平。故推测运动诱导Irisin表达调控肥胖,可能通过PGC1-α/Irisin/UCP1信号途径实现。
诸多研究发现,Irisin诱导白色脂肪棕色化,增加机体产热,降低体重,促使UCP1表达的机理可能是通过p38MAPK/ERK信号通路发挥作用[27],据此运动健康效应信号通路可能是:运动可通过提高活性氧水平从而诱导PGC1-α过表达,激活丝裂原活化蛋白激酶p38MAPK(38mitogen-activated protein kinase,p38MAPK)信号通路进而调控肌细胞PGC1-α的表达,而PGC1-α表达水平升高又可诱导FNDC5和Irisin表达增加。当用Irisin处理WAT后,可促进UCP1表达,进而增加促胰岛生长素(Betatrophin)和胰岛β细胞再生,即可通过运动增加ROS/p38MAPK/PGC1-α/Irisin/betatrophin和胰岛β细胞再生[28]。
Irisin的作用及运动诱导其表达机理的进一步阐明,将为揭示运动健身的原理提供可能,并有望成为人类防治肥胖等代谢性疾病的蛋白治疗手段。
5小结与展望
科学运动目前已成为健康的生活方式,规律的体育运动有助于维持糖脂代谢平衡。肌肉因子Irisin可促进白色脂肪棕色化,调节血糖和血脂,增加能耗和氧耗,已受到国内外专家的广泛关注,将有望成为防治肥胖等代谢性疾病的新靶点。最初研究报道,外源性的给与Irisin可显著减轻高脂饮食诱导的小鼠肥胖,改善机体胰岛素抵抗。因此,众多专家提出是否可通过外源性给予Irisin诱导白色脂肪细胞‘棕色化’或通过生物技术方法开发模拟具有Irisin生物活性的“锻炼药片”,从而防治肥胖、糖尿病等代谢性疾病,但研究仍尚未清楚。另外,关于Irisin的病理生理学功能、血液中Irisin的存在形式、半衰期以及运动影响Irisin表达的分子应答机制等目前研究尚浅。因而,进一步深入了解Irisin的各种功能,探讨其与运动和体重之间的关系等还存在需要解决的一些问题,如:Irisin在不同物种之间表达量的多少、运动时长、运动强度的大小和运动方式等对机体不同组织Irisin的作用影响尚未完全阐明,仍需要进一步探讨。
参考文献:
[1] Pedersen BK. The diseasome of physical inactivity-and the role of myokines in muscle-fat cross talk[J]. J Phsiol,2009,(587):5559-5568
[2] Bostrom P, Wu J, Jedrychowski MP, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature, 2012(481):463-468
[3] Suna Aydin,Tuncay Kuloglu, Suleyman Aydin, et al. Cardiac and Skeletal Muscle Serum Irisin Responses to with Or Without Water Exercise in Yough and Old Male Rats: Cardiac Muscle Produces More Irisin Taan Skeletal Muscle [J]. Peptides,2013,52(2):68
[4] Adyin S, Kuloglu T, Yilmaz M, et al. Alterations of irisin concentrtions in saliva and serum of obse and normal-weight subjects, before and after 45min of a Turkish bath or running[J].Peptides, 2013(50):13-18
[5] 武琼.大强度间歇运动与中等强度持续运动对青年肥胖女性血Irisin的影响[D].河北师范大学,2015
[6] Haiming Cao. Adipocytokines in Obesity and Metabolic Disease. J Endocrinol[J].2014,220(2):47-59
[7] Virtanen KA,Lidell ME,Orava J,et al.Functional brown adipose tissue in healthy adults[J].NEngle J Med,2009,360(15):1518-1525
[8] Wu Jun,Bostrom P, Sparks Lauren M et al. Beige Adipocytes Are a Distinct Type of Thermogenic Fat Cell in Mouse and Human [J]. Cell, 2012,150:366-376
[9] Sanchis-Gomar F,Perez-Quilis C.The p38-PGC-1alpha-irisin-betatrophin axis:Exploring new pathways in insulin resistance[J]. Adipocyte,2014,3(1):67-68
[10] Lopez-Legarrea P,de la Iglesia R,Crujeiras AB,Pardo M;Casanueva FF,Zulet MA,Martinez JA. Higher baseline irisin concentrations are associated with greater reductions in glycemia and insulinemia after weight loss in obese subjects[J].Nutr Diabetes 2014(4):110
[11] Sharma N, Castorena CM, Cartee GD. Greater insulin sensitivity in calorie restricted rats occurs with unaltered circulating levels of several important myokines and cytokines[J].Nutr Metab (Lond),2012,9(1):90
[12] Timmons JA, Baar K, Davidsen PK, et al. Is irisin a human exercise gene[J]. Nature,2012, 488 (7413):9-10
[13] Ayesha Saleem, Adeel Safdar, Maria Haikalis et al. Exercise-Induced Amelioration of Diet-Induced Obesity and Diabetes is Not Regulated by Irisin
[14] Huh JY. Panagiotou G, Mougios V, et al. FNDC5 and irisin in human:Ⅰ.Predictors of circulating concentrations in serum and plasmaand Ⅱ. mRNA expression and circulating concentrations in response to weight loss and exercise[J].Metabolism,2012(61):1725-1738
[15] 贺强,漆正堂,丁树哲.骨骼肌的内分泌功能与运动代谢适应[J].中国运动医学杂志,2015,34(2):201-207
[16] Kim H, Lee HJ, So B et al.Effect of aerobic training and resistance training on circulating irisin level and their association with change of body composition in overweight/obese adults: a pilot study.[J]. Physiol Res, 2015(8).[Epub ahead of print]
[17] Hecksteden A,Wegraann M,Steffen A,et al. Irisin andexercise training in humans - Results from a randomized controlled training trial. BMC Med,2013(11):235
[18] Moreno-Navarrete JM, Ortega F, Serrano M, et al. Irisin is expressed and produced by human muscle and adipose tissue in association with obesity and insulin resistance[J]. J Clin Endocrinol Metab,2013,98(4) :E769-E778
[19] Czarkowska-Paczek,Zendzian-Piotrowska,K.Gala et al. one session of exercise or endurance training does not influence serumlevels of irisin in rats[J].journal of physiology and pharmacology,2014,65(3):449-454
[20] Kraemer RR,Shockett P,Webb ND,et al.A transient elevated irisin blood concentration in response to prolonged, moderate aerobic exercise in young men and women[J].Honn Metab Res,2014,46(2):150-154
[21] Noriieim F, Langleite TM, Hjorth M, et al. The effects of acute and chronic exercise on PGC-la, irisin and browning of subcutaneous adipose tissue in humans[J].FEBS J,2014,281(3) :739-749
[22] Seo DY;Kwak HB;Lee SR;Cho YS;Song IS;Kim N;Bang HS;Rhee BD;Ko KS;Park BJ;Han J..Effects of aged garlic extract and endurance exercise on skeletal muscle FNDC-5 and circulating irisin in high-fat-diet rat models.[J].Nutr Res Pract.2014(No.2)
[23] Lee P, Linderman JD, Smith S, et al. Irisin and FGF21 are cold-induced endocrine activators of brown fat function in human[J].cell Metabolism,2014,19(2):302-309
[24] 林文弢,吴菊花,鞠丽丽.转录共激活分子PGC-α与肥胖者减体重研究现状的探讨[J].广州体育学院学报,2015,35(1):91-105
[25] Wrann CD, White JP, Salogiannnis J, et al. Exercise Induces Hippocampal BDNF through a PGC-1α/FNDC5 Pathway[J]. Cell Metab, 2013. [Epub ahead of print]
[26] Pontus B et al.A PGC1-α-dependent myokine that drives brown-fat -like development of white fat thermogenesis[J].Nsture, 2012(481):463-468
[27] Sanchis-Gomar F, Perez-Qulis C. The p38-PGC-1alpha-irisin-betatrophin axis: Exploring new pathways in insulin resistance[J]. Adipocyte, 2014,3(1):67-68
[28] Lidell ME, Betz MJ, Dahlqvist Leinhard O, et al. Evidence for two types of brown adipose tissue in humans[J].Nat Med, 2013,19(5):631-634
A new myokine-Irisin and Exercise
LIN Wen-tao1, JU Li-li2, WU Ju-hua2, WENG Xi-quan1
(1.Guangzhou Sport University, Guangzhou 510500;2.Shanghai University of Sport, Shanghai 200438,China)
Abstract:Irisin is a new myokine,which can drive brown-fat-like development of white fat , increase thermogenesis and lose weight. Exercise improves obesity, type 2 diabetes and so on by influence the expression of Irisin and UCP1, however,different mode of exercise and exercise intensity affect the expression of Irisin differently. Here we explore the mechanism of exercise regulating the Irisin to prevent metabolic disease which contains obesity and so on.
Key words:Irisin; obesity; brown-fat-like development of white fat; exercise
作者简介:林文弢(1957-),男,广东省惠来县人,教授、博士生导师
收稿日期:2015-12-30
中图分类号:G804.2
文献标识码:A
文章编号:1007-323X(2016)01-0087-04

