不同固定液对大鼠耳蜗一氧化氮合酶表达及透射电镜观察的影响△
陈小婉 江英 仇志强 张小兵
不同固定液对大鼠耳蜗一氧化氮合酶表达及透射电镜观察的影响△
陈小婉1江英2仇志强1张小兵1
【摘要】目的探寻用于观察大鼠耳蜗诱生型一氧化氮合酶(induced nitric oxide synthase,iNOS)表达及透射电镜检查最适合的固定液配比,简化实验手段。方法将正常大鼠6只(12耳,正常组)和庆大霉素耳中毒模型大鼠6只(12耳,模型组)各分为A、B两组(每组各3只,6耳),A组给予2.5%多聚甲醛-2.5%戊二醛、B组给予4%多聚甲醛-0.5%戊二醛混合液心内灌注耳蜗固定处死,然后进行耳蜗免疫组化染色及透射电镜观察,比较两组耳蜗的染色和电镜固定效果。结果正常组与模型组大鼠的耳蜗外毛细胞、螺旋神经节等均有iNOS阳性表达;但正常组及模型组的A组耳蜗组织免疫组化染色有轻度溶解,背景染色不佳,B组耳蜗组织细胞染色清晰,对比度及透明度好,背景无明显着色。正常组及模型组中A、B两组电镜下耳蜗细胞器等微结构清晰。结论4%多聚甲醛-0.5%戊二醛混合液心内灌注的方法既能较好地固定大鼠耳蜗细胞器的结构,也能较好的保留iNOS抗原。
【关键词】大鼠;诱生型一氧化氮合酶;透射电镜;固定液;庆大霉素
网络出版时间:2015-12-299:23
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20151229.0923.004.html
△兰州大学第一医院青年基金资助(ldyyynqn201005)
1兰州大学第一医院耳鼻咽喉-头颈外科(兰州730000);2兰州大学
NO的过量表达在庆大霉素耳毒性的机制中起到了重要的作用。诱生型一氧化氮合成酶(induced nitric oxide synthase,iNOS)的检测被广泛应用于庆大霉素类药物耳毒性的相关研究中,且常同时联合电子显微镜观察耳蜗细胞器的形态变化,已有研究分别采用4.0%甲醛和2.5%戊二醛固定耳蜗的方法[1,2],但是处理耳蜗耗费时间较多、对实验技术的要求较高,易影响实验结果。近年的报道多采用多聚甲醛-戊二醛混合液心内灌注的固定方法[3~6],本研究拟通过采用2.5%多聚甲醛-2.5%戊二醛混合液及4%多聚甲醛-0.5%戊二醛混合液对大鼠进行心内灌注,比较两种固定液处理后大鼠耳蜗iNOS表达及电镜观察结果,以期探寻适合同时进行耳蜗iNOS检测和电镜观察的固定液配比。
1材料与方法
1.1实验动物及分组实验动物为Wistar大鼠12只(24耳),雄性,体重200~250 g(兰州大学动物实验中心提供),ABR反应阈均正常;将实验大鼠随机分为两组:正常组6只(12耳)、庆大霉素耳中毒模型组(模型组)6只(12耳)。
1.2实验试剂及仪器iNOS试剂盒(武汉博士德公司),多克隆二抗(武汉博士德公司)。透射电镜(日本JEOL-1230型,日本电子公司)。
1.3庆大霉素模型组造模模型组大鼠每天腹腔注射庆大霉素150 mg/kg,连续10天;正常组每天腹腔注射等量生理盐水,连续10天;完成注射后两组分别检测ABR。
1.4耳蜗取材固定方法模型组及正常组完成腹腔注射及ABR测试后,将每组大鼠再分为A、B两组,每组3只(6耳),腹腔注射10%水合氯醛麻醉后A组给予2.5%多聚甲醛-2.5%戊二醛混合液、B组给予4%多聚甲醛-0.5%戊二醛心内灌注处死,至灌注侧对侧股静脉流出清亮固定液后继续推注固定液约50 ml,取出耳蜗,4 ℃相应固定液中过夜。
1.5各组耳蜗及肾脏组织iNOS表达检测所有大鼠左耳以10%甲酸脱钙后石蜡包埋,连续切片,柠檬酸修复,检测耳蜗组织中iNOS的表达;iNOS免疫组化SABc法步骤:切片经常规脱蜡,梯度水化,抗原修复,正常山羊血清封闭,滴加兔抗鼠iNOS抗体(购自武汉博士德试剂公司),4 ℃冰箱过夜,PBS洗,加二抗(生物素化羊抗兔IgG),37 ℃放置30 min,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片;阴性对照用PBS代替一抗,其余步骤相同;取正常组大鼠肾脏4 ℃相应固定液中过夜,作为阳性对照。耳蜗毛细胞、螺旋神经节等部位的细胞核、胞浆中出现棕黄色颗粒为iNOS表达阳性;肾小管细胞的胞浆中出现棕黄色颗粒为表达阳性,颜色越深表达越强。
每侧耳蜗连续切片5张,每张肾脏切片随机抽取10个高倍视野,染色后依据以下标准评分:①切片完整、贴片恰当10分;②切片较薄和均匀20分; ③无皱折10分;④无刀痕10分;⑤染色清晰、对比度、透明度好30分;⑥目标细胞是否完整、溶解 10分;⑦靶点是否正确10分;⑧有无背景着色5分;总分越高,切片质量越好。
1.6透射电镜观察各组耳蜗细胞超微结构各组大鼠的右耳耳蜗以10%EDTA脱钙后树脂包埋,切片,透射电镜观察耳蜗毛细胞的超微结构,观察线粒体、高尔基体等结构是否清晰、组织对比度是否良好。
2结果
2.1各组给药前后ABR阈值正常组给药前后ABR阈值无明显变化,模型组动物给药后ABR阈值较给药前明显增高(表1)。
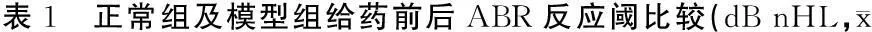
±s)
注:*与同组给药前比较,P<0.05
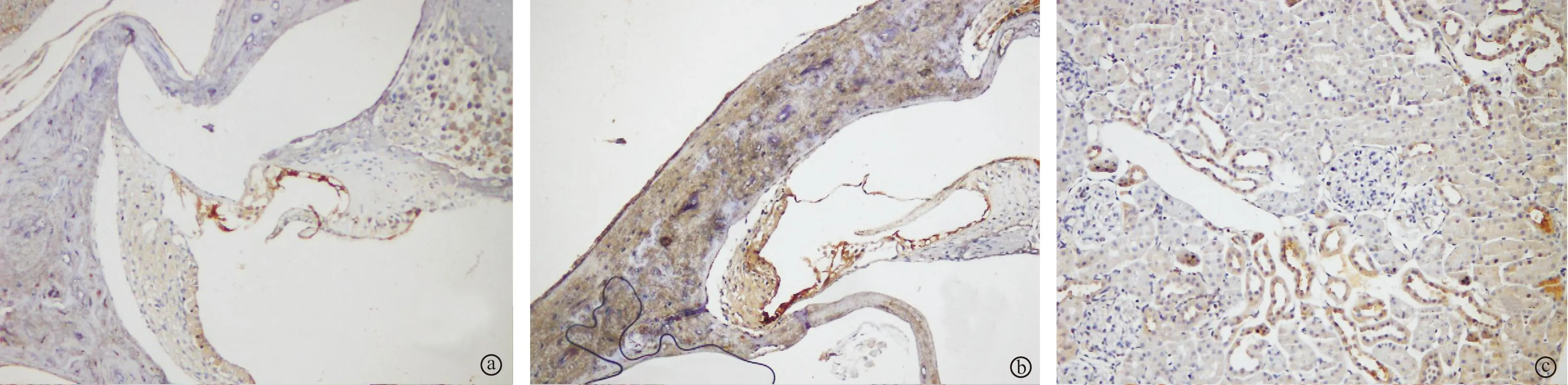
2.2不同固定液处理后各组耳蜗iNOS表达比较A、B两组动物的耳蜗毛细胞、螺旋神经节、血管纹内均有iNOS棕黄色颗粒沉着,其中正常组大鼠显色强度较模型组大鼠弱。正常组及模型组的A组细胞有轻度溶解、背景染色不佳(图1a、b)。正常组及模型组的B组组织固定效果较好,耳蜗切片较薄、均匀,细胞染色清晰、对比度、透明度好,背景无明显着色(图1d、e)。正常组及模型组中A、B亚组切片质量评分见表2,B组评分均高于A组。正常大鼠肾脏两种固定液组(A、B组)的iNOS均在肾小管表达(图1c、f)。
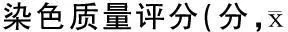
表2 正常组及模型组中A、B两组耳蜗切片
注:*与B组比较,P<0.05
2.3正常组及模型组耳蜗电镜观察电子显微镜下观察,两组内耳毛细胞内的线粒体、高尔基体等均结构清晰,无明显差别(图2)。
3讨论
庆大霉素的耳毒性机制被证实和氧化损伤有关,NO在其中起重要作用;近来研究的热点集中在抗氧化剂、iNOS抑制剂等对其耳毒性的保护作用,如丹参、牛磺酸等药物可以通过降低iNOS的表达保护耳蜗的功能[2,7~9]。由于NO气体分子的特性,现常采用免疫组织化学方法检测NOS 的水平以评估NO的水平,需同时观察组织的形态学变化时,多联合电子显微镜观察组织细胞的超微结构。免疫组化方法要求最大限度破坏细胞膜, 增加抗体的穿透性来标记抗原,多采用4%的多聚甲醛固定组织,而电子显微镜要求保留细胞的膜性结构,使显微结构清晰,多用2.5%戊二醛固定组织。因此,以往的实验大多采用将实验动物快速断头取出听泡,两耳分别给予4.0%多聚甲醛和2.5%戊二醛进行前庭窗灌注的方法来固定[1,2];这种方法对实验操作的技术要求较高,而且易引起毛细胞的自溶而影响试验结果。近年来的实验中逐渐采用不同浓度配比的戊二醛-甲醛混合液固定组织,并且采用心内灌注的方法。故本研究采用2.5%多聚甲醛-2.5%戊二醛混合液及文献有报道的4%多聚甲醛-0.5%戊二醛混合液[3~6],以心内灌注的方法分别处死固定大鼠耳蜗,比较两种方法处理后大鼠耳蜗iNOS的表达和透射电镜观察效果。这种固定液心内灌注的方法能够让固定液在脉管系统内快速到达内耳组织进行固定,缩短了将实验动物断头、取出听泡、开放前庭腔注入固定液固定的时间,从而减少组织离体至开始固定的时间对免疫组化结果的影响,也能达到电镜标本快速固定的要求。
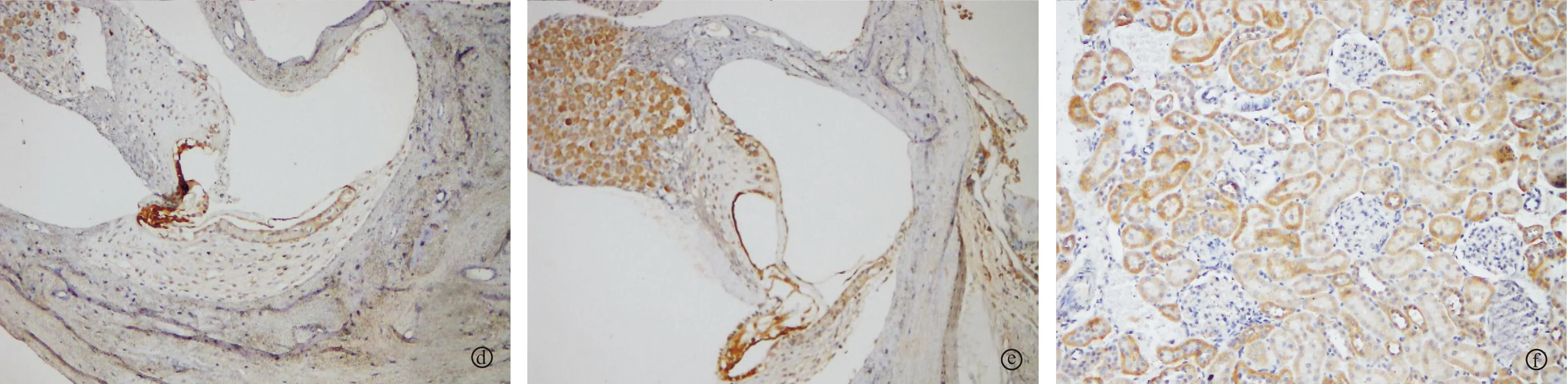
图1 各组不同固定液固定后耳蜗、肾脏切片(HE×200)
a 正常组大鼠A组耳蜗;b 模型组大鼠A组耳蜗;c 正常组大鼠A组肾小管;d 正常组大鼠B组耳蜗;e 模型组大鼠B组耳蜗;f 正常组大鼠B组肾小管
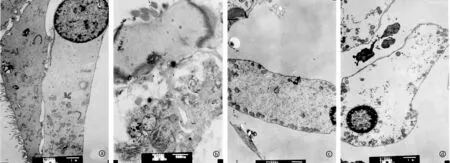
图2 各组耳蜗透射电镜结果
a. 正常组大鼠A组耳蜗外毛细胞;b. 模型组大鼠A组耳蜗外毛细胞;c. 正常组大鼠B组耳蜗外毛细胞;d. 模型组大鼠B组耳蜗外毛细胞
iNOS表达在正常大鼠肾脏的肾小管,A、B两组大鼠肾脏的肾小管均有iNOS表达,表明本实验结果可靠,混合固定液可以保存iNOS抗原。有作者采取分子杂交的方法发现正常耳蜗有iNOS RNA条带及蛋白条带的显色;有报道运用免疫荧光的方法发现正常耳蜗也有iNOS荧光显示;这些结果从RNA和蛋白水平均证明正常大鼠耳蜗组织有iNOS的弱表达,表达位置有毛细胞、血管纹、螺旋神经节[9~13]。从文中结果看,正常组及模型组大鼠耳蜗外毛细胞、血管纹、螺旋神经节等部位的细胞胞核棕色深染,正常组大鼠表达强度明显较模型组弱,与Shi等[1]结果相似;Shi等在试验中是采用断头处死动物、蜗尖钻孔后注入多聚甲醛的固定方法,而本研究是使用多聚甲醛-戊二醛配比固定液心内灌注的固定方法,说明本研究方法也可以较好地保存iNOS抗原,结果可靠。文中结果显示,A、B两组电子显微镜下内耳毛细胞的纤毛等超微结构清晰,胞内的细胞器等结构无明显差异,说明两种固定液对于耳蜗细胞超微结构的观察无明显差异。但是正常组大鼠及模型组大鼠中A组的HE染色质量评分均低于B组,与A组固定液中多聚甲醛浓度偏低,戊二醛浓度偏高有关;戊二醛穿透性强,它能快速而不可逆地与蛋白质的氨基反应,使蛋白凝固从而固定组织,也可以固定和蛋白质有关的或含有氨基和亚氨基的脂类;但无法阻止后面的脱水、渗透和包埋过程对样品脂类的抽提,因而对细胞膜的固定效果不理想;同时与氨基的不可逆反应导致部分抗原封闭进而影响免疫组化的结果,从而导致A组的免疫组化染色不佳,组织有溶解现象;而B组所用的固定液提高多聚甲醛的浓度后很好地解决了这些问题,故B组免疫组化染色质量优于A组。
文中结果表明,采用4%多聚甲醛-0.5%戊二醛混合液心内灌注固定即能够较好地保存iNOS抗原,又能够较好地固定细胞器,从而达到较好的电镜观察标本的固定效果,也能达到较满意的免疫组化染色效果。实验操作不需要断头取出耳蜗分别处理,缩短了取出标本固定的时间,技术操作简单易行,值得推广。
参考文献4
1Shi L, An Y, Wang A, et al.The protective effect of Salvia miltiorrhiza on gentamicin-induced ototoxicity[J].Am J Otolaryngol,2014,35:171.
2Liu HY, Chi FL, Gao WY.Taurine attenuates aminoglycoside ototoxicity by inhibiting inducible nitric oxide synthase expression in the cochlea[J]. Neuroreport,2008,19:117.
3张文丽,李倩,郭静,等.未脱钙耳蜗组织树脂包埋与切片方法[J].临床与实验病理学杂志,2013,29:1142.
4胡吟燕,孙建和,汪学勇,等.耳蜗组织低温包埋切片技术[J].听力学及言语疾病杂志,2005, 13:378.
5张亚,邹静,Pyykko I,等.线粒体毒素诱导伴有眩晕的突发性耳聋模型的建立[J].上海交通大学学报,2007,27:14.
6谢鼎华,郭运凯,伍伟景,等. 庆大霉素对内侧橄榄耳蜗传出神经毒性作用的形态学观察[J].中华耳鼻咽喉科杂志,1999,34:157.
7穆恩,姜学钧,杨宁,等.ATP对细菌内毒素引起的大鼠耳蜗iNOS表达的影响[J].中国医科大学学报,2004, 33:314.
8周晶,戴春富.一氧化氮合酶抑制剂对大鼠耳蜗诱生型一氧化氮合酶mRNA表达的影响[J].中国眼耳鼻喉科杂志,2008,8:151.
9王爱梅,汤浩,沈静,等.丹参注射液对庆大霉素耳中毒豚鼠耳蜗血管纹NOS活性的影响[J].中国应用生理学杂,2001, 30:85.
10石丽娟,官捷,汤浩,等. 链霉素耳中毒豚鼠耳蜗螺旋神经节iNOS、Ache表达及丹参的保护作用[J].中国应用生理学杂志,2009,25:264.
11沈静,汤浩,章晓芳,等.诱生型一氧化氮合酶在正常豚鼠耳蜗内的分布[J].中国医科大学学报,2000,29:180.
12Yamamoto H, Omelchenko I, Shi X, et al.The influence of NF-kappaB signal-transduction pathways on the murine inner ear by acoustic overstimulation[J]. J Neurosci Res,2009,87:1832.
13付兴华,邓艳丽,卢鹤翔,等.弥漫性脑损伤后SD大鼠内耳HO-1、iNOS蛋白与mRNA的表达[J].中国煤炭工业医学杂志,2012,15:1407.
(2015-04-22收稿)
(本文编辑雷培香)
·实验研究·
The Effects of Different Fixative on Transmission Electron Microscopy Examination
and Induced Nitric Oxide Synthase Expression in Rat
Chen Xiaowan*, Jiang Ying, Chou Zhiqiang, Zhang Xiaobing
(*Department of Otolaryngology Head and Neck Srugery, The Frist Hospital
of Lanzhou University, Lanzhou, 730000,China)
【Abstract】ObjectiveTo find a more suitable fixative for examining transmission electron microscopy (TEM) and induced nitric oxide synthase(iNOS) measure.MethodsA total of 12 adult male rats (24 ears)with normal hearing were used in this study and randomly divided into control group(6 rats,12 ears) and gentamicin group (6 rats,12 ears). Three rats in each group was fixed with 4%paraform-0.5% glutaraldehyde mixture, the another 3 rats were fixed with 2.5%paraform-2.5% glutaraldehyde mixture. The cochleae were examined by transmission electron microscopy(TEM) to observe ultrastructural changes. In addition, iNOS expression was measured. ResultsThe positive staining of iNOS was observed in the cochlea in all groups. The control groups were weakly positive, while the gentamicin groups were strongly positive. Those tissue sections showed cell dissolved ,uneven dyeing, poor background staining which were fixed with 2.5% paraform-2.5% glutaraldehyde mixture. While there were no significant differences between different fixed groups in TEM results.ConclusionOur resucts indicate that 4%paraform-0.5% glutaraldehyde mixture is better than 2.5%paraform-2.5% glutaraldehyde mixture for fixing rat by heart perfusing for TEM examine and iNOS expression measure.
【Key words】Rat;Induced nitric oxide synthase( iNOS);Transmission electron microscopy(TEM);Fixative;Gentamicin
通讯作者:张小兵(Email:790736924@qq.com)
作者简介:陈小婉,女,甘肃人,博士研究生,主要研究方向为耳科学。
【中图分类号】R764.3
【文献标识码】A
【文章编号】1006-7299(2016)01-0058-04
DOI:10.3969/j.issn.1006-7299.2016.01.015

