板蓝根抗病毒活性成分生物合成的研究进展*
肖 莹,马瑞芳,陈军峰,杨颖博,张 磊,陈万生**
(1. 第二军医大学附属长征医院药学部 上海 200003;2. 第二军医大学药学院 上海 200433;3. 上海中医药大学中药研究所 上海 201203)
板蓝根抗病毒活性成分生物合成的研究进展*
肖 莹1,马瑞芳1,陈军峰1,杨颖博3,张 磊2**,陈万生1**
(1. 第二军医大学附属长征医院药学部 上海 200003;2. 第二军医大学药学院 上海 200433;3. 上海中医药大学中药研究所 上海 201203)
板蓝根为十字花科(Cruciferae)植物菘蓝Isatis indigotica Fort.的干燥根,是清热解毒类的代表性中药。以落叶松脂素为代表的木脂素类成分是板蓝根发挥抗病毒活性的重要物质基础。本文综述板蓝根木脂素类成分生源途径解析、关键调控基因筛选和次生代谢工程调控方面的研究进展,为全面认识板蓝根抗病毒活性成分生物合成、提升板蓝根药材品质及促进板蓝根药用资源的可持续利用等奠定基础。
板蓝根 菘蓝 抗病毒 木脂素 生物合成
板蓝根(Isatidis Radix)为十字花科(Cruciferae)菘蓝属(Isatis)植物菘蓝Isatis indigotica Fort.的干燥根,始载于《神农本草经》,称为“蓝”,被列为上品,性寒、味苦,具有清热解毒、凉血利咽等功效,主治温疫时毒、发热咽痛、温毒发斑、痄腮、烂喉丹痧、大头瘟疫、丹毒、痈肿[1]。目前,其主要制剂有板蓝根冲剂、板蓝根注射液、板蓝根胶囊、板蓝根含片等,临床用于流行性感冒、流行性乙型脑炎、急慢性肝炎、流行性腮腺炎、带状疱疹等。众所周知,在2003年抗击非典型性肺炎SARS和2008年与甲型H1N1流感病毒的斗争中,板蓝根被广泛应用[2-4]。在当下全球流感肆虐之时,板蓝根的相关研究倍受关注。
李彬对板蓝根化学成分进行了系统研究,采用鸡胚法筛选发现木脂素类化合物落叶松脂素(图1A)和落叶松脂素苷(图1B)具有显著的抗病毒活性[5]。钟南山教授课题组研究发现落叶松脂素苷可以抑制流感病毒诱导的炎症反应[6],其衍生物Clemastanin B [7S,8R,8'R-(-)-lariciresinol-4,4'-bis-O-β-D-glucopyranoside](图1C)具有抗甲型和乙型流感病毒的活性[7]。这些结果有力诠释了以落叶松脂素为代表的木脂素类成分具有确切的抗病毒活性。
然而,对阜阳、亳州、赤峰、泰兴、上海等12个地区的板蓝根含量测定结果显示,落叶松脂素及落叶松脂素苷的含量分别仅为47.14 μg·g-1和84.67 μg·g-1[5]。因此,阐明板蓝根基源植物菘蓝中木脂素类次生代谢产物的生源途径,探明其代谢调控机制,通过生物技术提高抗病毒活性成分的含量,是解决日益增长的药源需求和有限植物资源间的矛盾的可行途径,也是保障针对此类植物药源的新药开发、临床应用和质量控制的关键。
1 菘蓝中抗病毒活性木脂素生源途径的解析
植物中落叶松脂素的生物合成途径已经初步探明[8,9],是经过苯丙氨酸途径由苯丙氨酸脱氨形成肉桂酸起始,经一系列羟基化、甲基化与还原反应,首先生成木脂素单体松柏醇,然后松柏醇在聚合蛋白酶(DirigentProtein,DIR)和松脂醇还原酶(Pinoresinolreductase,PLR)的催化作用下最终生成落叶松脂素。在某些植物中,落叶松脂素能进一步被松脂醇还原酶催化生成开环异落叶松脂素,开环异落叶松脂素在开环异落叶松脂素脱氢酶(Secoiso lariciresinolDehydrogenase,SIRD)的作用下生成罗汉松树脂酚,在糖基转移酶(UDP-sugar-dependent Glycosyltransferase,UGT)的作用下生成开环异落叶松脂素二葡萄糖苷(图2)。开环异落叶松脂素、罗汉松树脂酚和开环异落叶松脂素二葡萄糖苷都是具有重要生物活性的木脂素类成分[10]。
为了阐明菘蓝中特有的落叶松脂素生物合成途径,该途经中一系列催化酶基因被陆续从菘蓝中分离得到,并进行了生物信息学分析和表达特征研究(表1)。需要指出的是,菘蓝转录组测序的完成极大推动了落叶松脂素生物合成途径的全面解析。研究人员分别使用Roche 454平台及IlluminaHiSeq两种测序技术平台,对菘蓝根、茎、叶和花不同器官进行了转录组测序,最终获得了包含36367条ORF序列的菘蓝表达基因数据库。通过转录组功能(Gene Ontology,GO)及代谢通路(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,注释到落叶松脂素生物合成途径11个催化步骤的51个编码基因,生物合成途经中催化酶多以基因家族的形式存在[22]。例如,菘蓝中共注释获得19个聚合蛋白酶(IiDirs),编码183至414不等的氨基酸残基,具有不同的结构特征,在根、茎、叶和花中表达水平各异,且对信号分子茉莉酸甲酯(Methyl Jasmonate,MeJA)具有不同的响应,提示它们在菘蓝木脂素生物合成中可能具有不同的作用[23]。同时,通过转录因子的注释,获得56个转录因子家族的906条基因,它们可能是参与菘蓝木脂素类成分生物合成的关键调控基因,包括41个GRAS[24]、112个AP2/ERF[17]、78个bHLH[25]转录因子家族基因等。菘蓝中木脂素类成分生物合成途径催化酶及调控基因的详尽注释为进一步研究菘蓝抗病毒活性成分的生物合成特征及转录调控机制奠定了基础。

图1 板蓝根抗病毒活性成分化学结构式
研究者以植物激素MeJA诱导的菘蓝毛状根体系为对象,通过整合转录组及代谢组解析木脂素类化合物的生物合成特征与转录调控过程。分别运用RNA-seq和UPLC-QTOF/MS分析,对MeJA诱导后36 h内的菘蓝毛状根进行转录组及代谢组的整合,结果显示MeJA可以引起菘蓝细胞内转录及代谢两个层面的显著变化,且不同转录组和代谢物呈现出多样性的变化模式。主成分分析(Principal Component Analysis,PCA)清楚地反映了MeJA诱导后菘蓝细胞内转录和代谢变化的生理过程,信号响应及相关转录调控发生在诱导的起始阶段(0.5-1 h);随后代谢途径上催化酶基因的转录水平上调,相应代谢物的合成被激活并一直持续到整个过程的末期;而转录激活对次生代谢产物的影响则需要经过一定的累积,直到整个诱导过程的后期(12-24 h)才显现出来[14]。以上生理过程的阐明,为进一步筛选出关键的变量因子,并利用其对相关生物合成和转录调控网络进行解构提供了支撑。
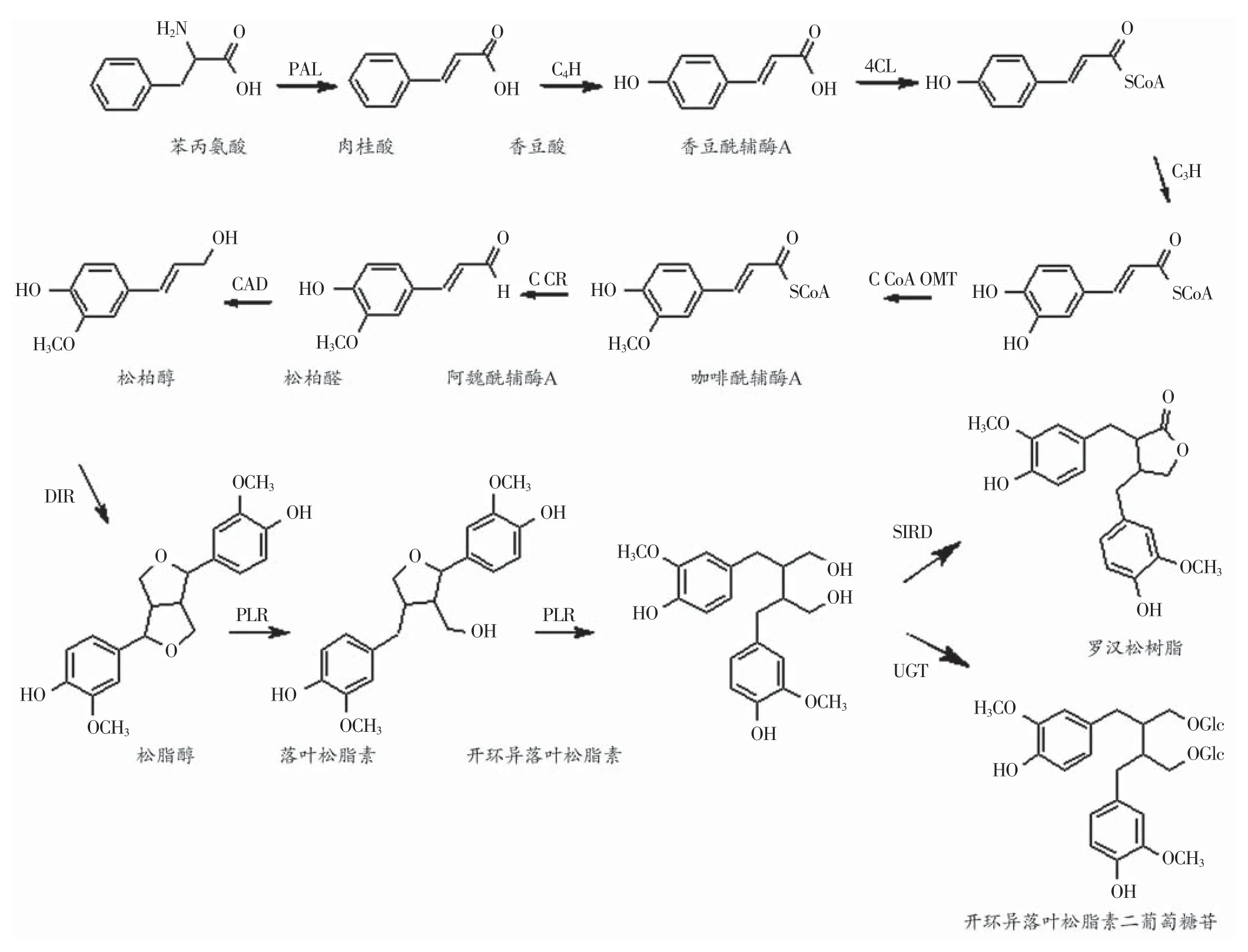
图2 落叶松脂素的生物合成途径
2 菘蓝中抗病毒活性木脂素生物合成关键调控基因的筛选
随着对植物次生代谢途径及相关基因了解的逐渐深入,人们越来越深刻地认识到植物次生代谢途径及其调控机制的复杂性,如何有效挖掘影响次生代谢产物生物合成的关键调控基因,快速获得激活目标化合物生物合成的靶点,已成为生物合成研究的难点。系统生物学的兴起和发展为解决这一难题打开了崭新的局面,其基本思路是通过整合基因组、转录组、蛋白质组和代谢组的信息构建调控模型,预测并挖掘关键的调控靶点,实现遗传操作的有的放矢、准确可靠[26]。菘蓝转录组测序及次生代谢组测定的完成[22]为通过该思路快速挖掘菘蓝中抗病毒活性木脂素生物合成关键调控基因创造了条件。
研究者对MeJA处理前后菘蓝转录组和代谢组进行检测,通过“转录本-转录本”、“代谢物-代谢物”以及“转录本-代谢物”之间动态相关性计算,构建了菘蓝木脂素合成途径的转录调控共表达相关性网络,对木脂素类化合物合成途径的关键调控因子及关键途径基因进行预测。结果显示,十个转录因子IiERF15、IiERF21、IiWRKY59、IibHLH62-2、IibHLH77、IibHLH99、IiMYB18、IiTNY、IiMYB94和IiEBP,两个途径基因Ii4CL3和IiDir9为调控菘蓝木脂素生物合成的核心调控因子;进一步的研究显示,抑制表达Ii4CL3显著降低了菘蓝木脂素的含量,而抑制表达Ii4CL1和Ii4CL2对木脂素含量无显著影响,证明运用该转录调控预测模型筛选关键调控基因的准确性[14]。
将MeJA处理后不同时间点菘蓝毛状根中木脂素生物合成途径基因的表达水平和5个木脂素成分的积累水平进行整合分析,构建“基因-化合物”关联性网络,共筛选出27个与菘蓝木脂素合成相关的基因,其中7个(IiPAL1、Ii4CL7、IiC3H、IiDIR1、IiDIR5、IiDIR9、IiPLR1)与落叶松脂素合成呈正相关。IiPLR1s系统研究发现,抑制表达IiPLR1显著降低了菘蓝毛状根中落叶松脂素的含量,而抑制表达IiPLR2和IiPLR3对落叶松脂素的含量积累无显著影响,说明IiPLR1确实是IiPLR家族中唯一对落叶松脂素生物合成具有重要作用的成员,证明了该“基因-化合物”关联性分析结果的准确性[21]。
运用典型相关分析预测112个菘蓝AP2/ERF转录因子对木脂素类成分生物合成的影响,筛选出Ii007、Ii049、Ii050和Ii080为关键转录调控因子[17]。
通过共表达分析预测78个菘蓝bHLH转录因子与木脂素途径基因表达的相互关系,发现IibHLH20、IibHLH24、IibHLH25、IibHLH60、IibHLH93和IibHLH95与木脂素合成途径基因存在共表达关系,提示它们可能参与菘蓝木脂素的生物合成[25]。
3 菘蓝中抗病毒活性木脂素的代谢调控
菘蓝中抗病毒活性木脂素生物合成关键调控基因的筛选为通过植物次生代谢工程激活合成途径,提高活性木脂素的含量提供了条件。
过量表达IiPLR1显著提高了菘蓝毛状根中落叶松脂素的含量,与野生型对照(56.0 μg·g-1dw)相比,转基因株系ovx-2和ovx-8将落叶松脂素的含量分别提高到353.9 μg·g-1和310.4 μg·g-1,是野生型的约6.3倍和5.5倍,且具有与野生型相当的生物量[21];过量表达IiC3H将菘蓝毛状根中落叶松脂素的含量提高了4.45倍[17]。以上研究为以菘蓝毛状根为生物反应器大规模生产活性木脂素提供了可行策略,也为通过代谢工程获得木脂素高积累的优质板蓝根品系提供了高效的调控靶点。
4 总结与展望
现代分子生物学的发展,尤其是转录组学、代谢组学、生物信息学等多学科的交叉与融合大大推进了人们对板蓝根木脂素类成分生物合成的认识。目前,板蓝根木脂素成分生物合成途径的基本框架及相关酶的研究已经取得了一定的进展。但植物次生代谢是一个受多因素调节、非常复杂的动态变化过程[27],距离全面解析板蓝根木脂素成分生物合成途径、阐明代谢调控机制尚有很多问题悬而未决。例如,板蓝根木脂素成分次生代谢受到哪些信号传导网络所调控?哪些转录因子介导其中?如何发挥作用?生物合成路径的时空定位如何?哪些因素影响其合成、运输及释放?板蓝根木脂素成分与初生代谢及其他次生代谢产物如何相互沟通联系“crosstalk”构建代谢调控网络等。
目前,关键酶基因的高效表达成功提高了菘蓝木脂素含量,已经取得了令人兴奋的研究进展。然而,相对而言,转录因子可以调控能被它所识别的一系列生物合成关键基因的表达,高效激活生物合成途径[28],目前已经筛选获得的多个转录因子将成为更具优势的提高活性木脂素含量的遗传操作靶点。随着对板蓝根木脂素成分生物合成途径及相关基因了解的深入,更多的新技术手段和研究工具,如蛋白质工程[29]、合成生物学[30]等,将更加全面深入的整合,大幅提升板蓝根抗病毒活性成分的产率,以及利用细胞工厂生产活性木脂素,使之能保障板蓝根品质并实现品质提升将逐步实现。
1 国家药典委员会编. 中华人民共和国药典(2015版). 北京: 中国医药科技出版社, 2015:205.
2 Lin C W, Tsai F J, Tsai C H, et al. Anti-SARS coronavirus 3C-like protease effects of Isatis indigotica root and plant-derived phenolic compounds. Antivir Res, 2005, 68(1):36-42.
3 孙惠惠. H1N1小鼠模型的建立及板蓝根颗粒对H1N1模型小鼠的作用的研究. 北京:中国协和医科大学硕士学位论文,2010.
4 Wang Y T, Yang Z F, Zhan H S, et al. Screening of anti-H1N1 active constituents from Radix Isatidis. Int J Mol SCI, 2011,4:419-422.
5 李彬. 板蓝根活性成分及品质评价. 上海:第二军医大学博士学位论文, 2003.
6 Li J, Zhou B, Li C, et al. Lariciresinol-4-O-β-D-glucopyranoside from the root of Isatis indigotica Influenza A virus-induced pro-Inflammatory response. J Ethnopharmacol, 2015, 174:379-386.
7 Yang Z, Wang Y, Zheng Z, et al. Antiviral activity of Isatis indigotica root-derived clemastanin B against human and avian influenza A and B viruses in vitro. Int J Mol Med, 2013, 31(4):867-73.
8 Humphreys J M, Chapple C. Rewriting the lignin roadmap. Curr Opin Plant Biol, 2002, 5(3):224-9.
9 Nakatsubo T, Mizutani M, Suzuki S, et al. Characterization of Arabidopsis thaliana pinoresinol reductase, a new type of enzyme involved in lignan biosynthesis. J Biol Chem. 2008, 283(23):15550–15557.
10 Satake H, Ono E, Murata J. Recent advances in the metabolic engineering of lignan biosynthesis pathways for the production of transgenic plant-based foods and supplements. J Agric Food Chem, 2013, 61(48):11721-11729.
11 Lu B B, Du Z, Ding R X, et al. Cloning and characterization of a differentially expressed phenylalanine ammonialyase gene (IiPAL) after genome duplication from tetraploid Isatis indigotica Fort.. J Intiegr Plant Biol, 2006, 48 (12):1439-1449.
12 胡永胜,张磊,陈万生.菘蓝中肉桂酸-4-羟基化酶基因克隆与表达分析.中草药, 2015, 46(1):101-106.
13 Di P, Hu Y S, Xuan H J, et al. Characterization and the expression profile of 4-coumarate: CoA ligase (Ii4CL) from hairy roots of Isatis indigotica. Afr J Pharm Pharnac, 2012, 6(28):2166-2175.
14 Zhang L, Chen J F, Zhou X, et al. Dynamic metabolic and transcriptomic profiling of methyl jasmonate-treated hairy roots reveals synthetic characters and regulators of lignan biosynthesis in Isatis indigotica Fort.. Plant Biotechnol J, 2016, 14(12):2217-2227.
15 周洵. 菘蓝中4-香豆酰辅酶A连接酶家族的功能研究. 上海:第二军医大学硕士学位论文, 2013.
16 宣洪娇. 菘蓝木脂素生源合成途径五个关键酶基因的功能研究.佳木斯:佳木斯大学硕士学位论文, 2012.
17 Chen R B, Li Q, Tan H X, et al. Gene-to-metabolite network for biosynthesis of lignans in MeJA-elicited Isatis indigotica hairy root cultures. Front Plant Sci, 2015,6:952.
18 陆倍倍. 四倍体菘蓝中优良品质相关基因的克隆及研究. 上海:第二军医大学硕士学位论文, 2006.
19 Hu Y S, Di P, Chen J F, et al. Isolation and characterization of a gene encoding cinnamoyl-CoA reductase from Isatis indigotica Fort.. Mol Biol Rep, 2011, 38:2075-2083.
20 胡永胜. 菘蓝中木脂素生源合成途径五个重要酶基因的克隆与功能分析.上海:第二军医大学硕士学位论文,2010.
21 Xiao Y, Ji Q, Gao S H, et al. Combined transcriptome and metabolite profiling reveals that IiPLR1 plays an important role in lariciresinol accumulation in Isatis indigotica. J Exp Bot, 2015, 66:6259-6271.
22 Chen J F, Dong X, Li Q, et al. Biosynthesis of the active compounds of Isatis indigotica based on transcriptome sequencing and metabolites proling. BMC Genomics, 2013, 14:857.
23 Li Q, Chen J F, Xiao Y, et al. The dirigent multigene family in Isatis indigotica: gene discovery and differential transcript abundance. BMC Genomics, 2014,15:388-401.
24 Zhang L, Li Q, Chen J F, et al. Computational identification and systematic classification of novel GRAS genes in Isatis indigotica. Chin J Nat Med, 2016, 14(3):161-176.
25 Zhang L, Chen J F, Li Q, et al. Transcriptome-wide analysis of basic helix-loop-helix transcription factors in Isatis indigotica and their methyl jasmonate responsive expression profiling. Gene, 2015, 576(1):150-159.
26 Farré G, Twyman R M, Christou P, et al. Knowledge-driven approaches for engineering complex metabolic pathways in plants. Curr Opin Biotech, 2015, 32:54-60.
27 Tatsis E C, O’Connor S E. New developments in engineering plant metabolic pathways. Curr Opin Biotech, 2016, 42:126-132.
28 Zhou M, Memelink J. Jasmonate-responsive transcription factors regulating plant secondary metabolism. Biotechnol Adv, 2016, 34(4):441-449.
29 Chen Z, Zeng A P. Protein engineering approaches to chemical biotechnology. Curr Opin Biotech, 2016, 42:198-205.
30 Cloney R. Synthetic biology: Automating genetic circuit design. Nat Rev Genet, 2016, 17(6):314-315.
Advances in Biosynthesis of Antiviral Active Components of Isatidis Radix
Xiao Ying1, Ma Ruifang1, Chen Junfeng1, Yang Yingbo3, Zhang Lei2, Chen Wansheng1
(1.Department of Pharmacy, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China; 2. School of Pharmacy, Second Military Medical University, Shanghai 200433, China; 3. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China)
Isatidis Radix, the root of Isatis indigotica Fort. (Cruciferae), is a representitive herb widely used for clearing away heat-toxin in traditional Chinese medicine (TCM). Lariciresinol is a representitive component of lignans and an important efficacious substance with the antiviral effect. This review elucidated the progress on its biosynthetic pathways, the screening of key regulatory genes and metabolic engineering of lignans components in Isatidis Radix, providing a favorable reference for the full understanding of biosynthesis of antiviral active components, the quality improvement of Isatidis Radix and the sustainable utilization of TCM resources.
Isatidis Radix, Isatis indigotica Fort. (Cruciferae), antiviral activity, lignan, biosynthesis
10.11842/wst.2016.11.012
R931.6
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-10-27
修回日期:2016-11-14
* 国家自然科学基金委国家杰出青年科学基金项目(81325024):中药药效物质,负责人:陈万生;国家自然科学基金面上项目(31670292):茉莉酸响应的AP2/ERF转录因子对菘蓝木脂素生物合成的调控作用及其分子机制研究。负责人:张磊;国家自然科学基金青年基金项目(31100221):四倍体菘蓝聚合蛋白酶与松脂醇还原酶的功能及特征研究,负责人:肖莹;国家自然科学基金面上项目(81673550):丹参根系形态、结构特征与有效成分积累的关联性及形成机制研究,负责人:陈军峰。
** 通讯作者:陈万生,本刊编委,教授,博士生导师,主要研究方向:中药药效物质和品质调控研究;张磊,副教授,硕士生导师,主要研究方向:中药天然产物生物合成与代谢调控研究。

