灵芝菌-玄七通痹胶囊药渣双向发酵工艺的研究
张庆明,徐云燕,顾宁宁,张兴德
·论 著·
灵芝菌-玄七通痹胶囊药渣双向发酵工艺的研究
张庆明1,徐云燕1,顾宁宁2,张兴德2
目的 优化灵芝菌-玄七通痹胶囊药渣双向发酵工艺,初步探讨其主要活性组分的物质差异。方法 以多糖、灵芝酸和皂苷作为检测指标,考察药渣浓度、固液比、药渣粒径等因素对灵芝菌发酵玄七通痹胶囊药渣的影响,并利用高效液相色谱(HPLC)技术分析添加药渣发酵后主要活性组分的物质差异。结果 以多糖为目标产物,最佳的药渣添加量25%,固液比1∶1.5,药渣粒径60目过筛,发酵时间25 d;以灵芝酸为目标产物,最佳的药渣添加量40%,固液比1∶1.8,药渣粒径60目过筛,发酵时间30 d。并且添加药渣发酵后,在多糖组分和灵芝酸组分中都产生了新的物质。结论 本研究不仅将为解决中药渣直接排向环境造成的污染等问题提供参考,而且还为实现中药渣再利用、新药及功能饲料添加剂的开发提供依据。
灵芝菌;玄七通痹胶囊药渣;双向发酵;多糖;灵芝酸
近年来,随着中医药事业的快速发展,药渣的废弃量日益增多,已成为中药生产企业中最严重的污染源之一。药渣含水量大、营养丰富,目前常用堆放、填埋及焚烧等处理方式,不仅造成了资源的浪费,还对水体和大气等环境产生了污染[1]。目前,研究者在药渣综合利用方面做了许多研究工作,包括用于培养食用菌、制成花肥及制备絮凝剂等[2-3],但我国药渣的种类繁多,性质差异巨大,因此仍需开展药渣新的利用研究。
灵芝菌是我国传统的药用真菌,能产生灵芝酸、灵芝多糖等多种活性物质[4-5]。根据双向发酵理论,构建灵芝菌和药渣的发酵体系,一方面灵芝菌生长过程中产生大量的酶系,对药渣中的某些组分进行转化形成新的成分,而这些新成分就是新活性化合物筛选的物质基础,另一方面,药渣中的某些物质也会对灵芝菌生长和代谢产生影响,从而形成新的成分或改变各成分的相互比例[6]。因此,利用药用真菌发酵药渣,变废为宝,为新药及功能饲料添加剂开发提供源泉。陈合等[7]利用灵芝菌转化中药“香菊”的药渣,进而考察了多糖、灵芝酸和蛋白的变化情况。庄毅等[8]综述了灵芝菌和黄芪药渣双向发酵菌质能显著提高肉鸡、沼虾等动物的机体免疫力和风味,但目前这方面的研究报道仍然较少,尤其对添加药渣后主要活性组分变化缺乏细致研究。
玄七通痹胶囊主要有滋补肝肾、活血化瘀等功效,市场销售量巨大,同时药渣处理成为了生产企业亟待解决的棘手问题,目前还未有灵芝菌发酵玄七通痹胶囊药渣的报道。本实验以玄七通痹胶囊药渣为基质,以灵芝菌为出发菌株,优化了发酵培养基组成及发酵条件,为后续生理活性研究和目标产物的分离鉴定打下基础。
1 材料与方法
1.1 菌种 灵芝菌(Ganodermalucidum)购自中国典型培养物保藏中心(批号CICC14002)。
1.2 中药渣 玄七通痹胶囊药渣由南京中山制药有限公司提供,湿物料经烘干、粉碎、过筛后置于干燥器中备用。本次实验用药渣中各主要成分含量如下:蛋白质20.2%,粗纤维30.7%,粗多糖2.1%,总皂苷1.7%,灵芝酸含量极低。若无特别说明,药渣质量均以干物料计。
1.3 培养基
1.3.1 平板培养基 为马铃薯葡萄糖琼脂(PDA)培养基,马铃薯浸取液1 L,加入葡萄糖20 g,琼脂20 g,于121 ℃灭菌30 min。用于灵芝菌的培养。
1.3.2 种子培养基 葡萄糖30 g,酵母膏10 g,玉米粉10 g,KH2PO41.5 g,MgSO41 g,蒸馏水1 L,pH 6.5左右,于121 ℃灭菌30 min,用于灵芝菌种子液的制备。
1.3.3 基础固体培养基 以药渣和麸皮为培养基质,添加一定量的水分,用于考察不同培养基组成对灵芝菌发酵转化药渣的影响。
1.4 仪器 恒温培养箱(PYX-DHS, 中国上海市跃进医疗器械一厂),紫外分光光度计(UV-2101C,美国UNICO),高速离心机(CR21G,日本HITACHI),压力蒸汽灭菌锅(HVE-50,日本HIRAYAMA),高效液相色谱(UltiMate 3000,美国DIONEX)。
1.5 培养方法
1.5.1 灵芝菌的培养 将灵芝菌种接入平板培养基中,于28 ℃下恒温培养5 d。进而将灵芝菌接入装有100 mL种子液培养基的250 mL锥形瓶,置于恒温空气浴振荡器中,在180 rpm、28 ℃条件下培养3 d。
1.5.2 灵芝菌固态发酵玄七通痹胶囊药渣 将灵芝菌种子液接种至玄七通痹胶囊药渣基础固体培养基中,接种量10 mL/100 g固体培养基,初始药渣浓度10%、药渣粒径40目、固液比1∶2、培养温度28 ℃、培养时间30 d。
1.5.3 影响固态发酵的单因子实验 分别考察药渣添加量、固液比、药渣粒径、培养温度及培养时间等因素对中药渣固态发酵的影响,以发酵产物中多糖、灵芝酸及皂苷的含量变化作为评价指标。
1.6 分析方法
1.6.1 多糖含量的测定 药渣发酵菌质低温烘干,粉碎。称取粉末10 g,加水200 mL,于95 ℃,回流提取1.5 h,过滤后加水100 mL,再次提取1.5 h。合并滤液,经旋转蒸发浓缩一定体积后,加入乙醇至乙醇终浓度达到85%,静置过夜,离心。沉淀加水复溶,利用苯酚-硫酸法[9-10]测定多糖含量。
1.6.2 灵芝酸含量的测定 取烘干粉碎后的药渣发酵菌质10 g,加入100 mL的95%乙醇,75 ℃回流提取1.5 h,重复一次,过滤,合并上清液,旋转蒸干。用100 mL氯仿溶解,60 mL饱和碳酸氢钠2次萃取,合并上层液。用盐酸调pH至2~3,用50 mL氯仿分两次萃取,合并氯仿层,蒸干后用甲醇复溶。利用草醛冰醋酸-高氯酸显色法测定灵芝酸的含量。
1.6.3 总皂苷含量的测定 取烘干粉碎后的药渣发酵菌质10 g,加水100 mL,于95 ℃回流提取1.5 h,重复一次,合并提取液,过滤,旋转蒸发浓缩后,加入水饱和正丁醇萃取3次,合并正丁醇层,加浓度1%NaOH水溶液萃取2次,弃去水层,加正丁醇饱和的水萃取2次,合并正丁醇层,蒸干,残渣加甲醇溶解后,利用高氯酸-香草醛法检测总皂苷含量。
1.6.4 多糖组成的分析 取干燥的多糖样品,加入2 mol/L的H2SO4溶液,100 ℃水解8 h,取出冷却后加入碳酸钡中和,3000 rpm离心去除沉淀,上清液样品经0.22 μm滤膜过滤,利用高效液相色谱(HPLC)分析单糖组分。色谱柱为Shodex SP0810,示差检测,柱温60 ℃。
1.6.5 灵芝酸组分的分析 灵芝酸组分进行HPLC分析[10],流动相:甲醇/水(0.05%冰乙酸),流速:0.8 mL/min,以20%甲醇冲洗柱体10 min,进而将梯度洗脱,甲醇浓度自20%提高至100%,时间40 min。而后维持甲醇浓度100%,冲洗柱体5 min后,在5 min内将甲醇浓度由100%梯度降至20%,维持5 min。20%甲醇10 min,20%-100%甲醇40 min,100%甲醇5 min,100%-20%甲醇5 min,20%甲醇5 min。色谱柱:Discovery HS C18柱。
2 结 果
2.1 药渣添加量对灵芝菌发酵的影响 玄七通痹胶囊药渣成分复杂,必定会对灵芝菌生长代谢产生影响,因此本研究首先考察药渣浓度对发酵的影响,结果见图1A。当药渣浓度达到考察上限55%时,灵芝菌仍能较好地生长。但在药渣浓度为25%时,发酵后多糖含量最高,达到了16.3 mg/g菌质。对灵芝酸而言最佳的药渣添加浓度是40%,灵芝酸含量达到了1.2 mg/g菌质(图1B)。而添加不同浓度的药渣发酵后,总皂苷浓度均较低,仅为0.1~0.3 mg/g之间(数据未列出),远低于初始药渣中的总皂苷浓度。
2.2 药渣粒径对灵芝菌药渣发酵的影响 固态发酵过程中颗粒的大小会直接影响单位体积反应表面积,也会影响颗粒间菌体的生长、氧供给率、散热率及二氧化碳的移出率,因此分别在最佳的药渣浓度情况下,考察了药渣粒径对灵芝菌发酵的影响,结果见图2。从结果可知,原料粒径为40目、60目和80目时发酵效果较好,其中60目时多糖及灵芝酸含量最高,分别达到了20.2 mg/g菌质和1.7 mg/g菌质。当利用100目粒径的药渣发酵时,两种物质的含量显著降低。此外研究发现,总皂苷的浓度在100目最高,达到11.2 mg/g菌质,60目时仅为0.12 mg/g菌质。
2.3 固液比对灵芝菌发酵药渣的影响 固态发酵过程中,灵芝菌是在无游离水的基质上进行生长代谢,含水量过多或过少都会对灵芝菌的生长代谢造成不利影响,固液比对玄七通痹胶囊渣固态发酵的影响见图3。研究结果表明,加水量对灵芝菌药渣发酵产生了较大的影响,当固液比为1∶1.5时,发酵产物中多糖含量最高,达到了35.2 mg/g菌质(图3A),而固液比为1∶1.8时,发酵产物中灵芝酸的含量最高,达到了2.6 mg/g菌质(图3B)。
2.4 发酵温度对灵芝菌药渣发酵的影响 灵芝菌的生长和代谢均需要一定的温度,温度过高、过低都会影响菌株的生长及产酶。由于大多数研究报道中,灵芝菌在28 ℃左右生长旺盛,因此选择25~35 ℃作为发酵温度,考察温度对灵芝菌药渣发酵的影响(图4)。结果表明,在发酵温度28 ℃时,多糖和灵芝酸含量均达到最高,分别为35.7 mg/g菌质和2.7 mg/g菌质,因此选择28 ℃作为灵芝菌-玄七通痹胶囊药渣的发酵温度。
2.5 灵芝菌-药渣的发酵进程曲线 适当地控制发酵时间,不仅可以获得最高的活性物质产量,还可以避免染菌及降低生产成本。在最佳发酵条件下,灵芝菌-玄七通痹胶囊药渣双向发酵过程中活性物质的变化情况见图5。多糖组分随着发酵的进行,先减少后增加,在15 d最低,而后随着时间延长,多糖含量逐渐增加。该结果表明,灵芝菌生长过程中先消耗了药渣基质中的多糖组分用于菌体生长,而后菌株生长代谢产生的多糖逐渐增加。在25 d达到最高后,进而减少。灵芝酸含量随着发酵的进行逐渐增加,在30 d达到最大。而总皂苷含量随着时间的进行逐渐减少,说明菌体对皂苷类物质进行了转化。
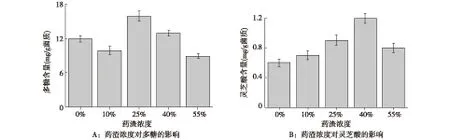
图1 药渣浓度对灵芝菌发酵药渣产多糖及灵芝酸的影响
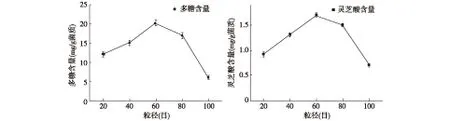
图2 药渣粒径对灵芝菌药渣发酵产多糖及灵芝酸的影响
2.6 灵芝菌-药渣发酵菌质的多糖组成变化分析 以未发酵药渣、未添加药渣的灵芝菌固体发酵菌质(基质为麸皮)提取的多糖样品为空白对照。利用浓硫酸水解样品和对照品,分析多糖的组成变化。图6A为添加药渣未发酵基质的多糖水解液单糖组成的HPLC图,图6B为未添加药渣的灵芝菌发酵多糖水解液单糖组成的HPLC图,图6C为添加药渣后的灵芝发酵多糖水解液的单糖HPLC图。从实验结果对比可知,药渣经灵芝菌发酵后产生了新的单糖组分,说明双向发酵产生了新的多糖组分。
2.7 灵芝菌-药渣发酵菌质的灵芝酸组分变化分析 以未发酵药渣、未添加药渣的灵芝菌固体发酵菌质(基质为麸皮)提取的灵芝酸组分为空白对照。图7A为未发酵药渣的灵芝酸组分HPLC图谱,图7B为未添加药渣的灵芝菌发酵菌质中灵芝酸组分的HPLC图,图7C为双向发酵菌质中灵芝酸组分的HPLC图。经对比分析可知,添加药渣发酵后,在灵芝酸三萜组分中也显著产生了新的物质。
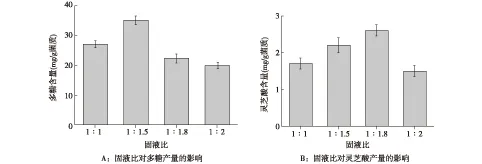
图3 固液比对灵芝菌药渣发酵产多糖及灵芝酸的影响
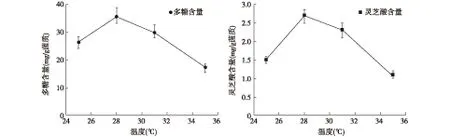
图4 温度对灵芝菌药渣发酵产多糖及灵芝酸的影响

图5 灵芝菌发酵玄七通痹胶囊的时间曲线

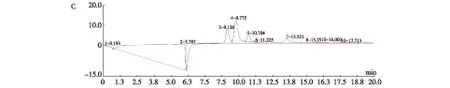
A:药渣单糖组分;B:灵芝菌未添加药渣发酵菌质的单糖组分;C:灵芝菌-药渣发酵菌质的单糖组分图6 灵芝菌-药渣发酵菌质中单糖组分的变化
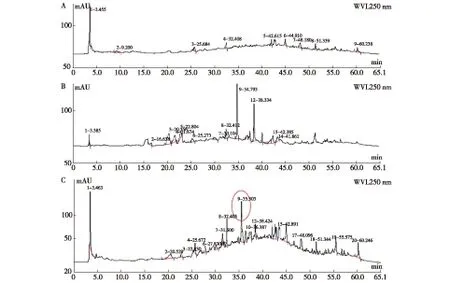
A:药渣灵芝酸组分;B:灵芝菌未添加药渣发酵菌质的灵芝酸组分;C:灵芝菌-药渣发酵菌质的灵芝酸组分图7 灵芝菌-药渣发酵菌质中灵芝酸组分的变化
3 讨 论
在传统的固体发酵中,基质的作用仅是单向性为真菌提供所需的营养物质。近年来,利用药用真菌发酵中药从而产生新的活性物质和提高药效,成为了研究热点。但目前对中药渣的生物转化研究相对较少,而且基本集中在利用药渣生产蛋白饲料等方面,而以药用真菌发酵中药渣进行新药及功能性饲料添加剂的开发具有极大的潜力。王建芳等[11]发现,利用香菇发酵鼻渊舒系列产品的药渣,最终的发酵菌质能显著促进小鼠的生长和免疫器官发育。
本研究以多糖和灵芝酸为主要的检测指标,优化了灵芝菌-玄七通痹胶囊双向发酵体系。进而发现发酵后生产的多糖[12]及灵芝酸组分均与未添加药渣的发酵产物有所差异。在今后的研究中,将探讨这两种组分的药理学活性。本研究不仅将为解决中药渣直接排向环境造成的污染等问题提供参考,而且还为实现中药渣再利用、新药及功能饲料添加剂的开发提供依据。
[1] 王 浩,严嘉敏,罗 佳. 中药药渣深入利用的研究进展[J]. 中药与临床,2015,6(3):62-65.
[2] 刘文伟,刘玉璇,赵 宇,等. 中药渣综合利用研究进展[J]. 药学研究,2013,32(1):49-50.
[3] 潘文华,邓乔丹,冯毅翀,等. 中药渣综合利用的可行性分析[J]. 时珍国医国药,2011,22(8):2026-2027.
[4] Liu L, Kurashiki K, Fukuta A, et al. Quantitative determination of the representative triterpenoids in the extracts ofGanodermalucidumwith different growth stages using high-performance liquid chromatography for evaluation of their 5α-reductase inhibitory properties[J].Food Chem, 2012,133(3):1034-1038.
[5] 丁 妍,周向毅,崔 莉,等. 灵芝多糖对辐射损伤小鼠的防护作用[J]. 医学研究生学报,2014, 27(11):1152-1155.
[6] 庄 毅,潘 扬,谢小梅,等. 药用真菌“双向发酵”的起源、发展及其优势与潜力[J]. 中国食用菌,2007,26(2):3-6.
[7] 陈 合,赵 燕,陈 明,等. 利用中药渣培养灵芝菌及生物活性成分的研究[J]. 食品工业科技,2006,27(10):58-63.
[8] 庄 毅,洪 净. 药用真菌双向固体发酵工程与中成药药渣开发[J]. 中国中药杂志,2006,31(22):8191-8192.
[9] 陈玉胜,阮 鸣,张李阳,等. “芝芪菌质”发酵配方的筛选及主要有效成分的含量测定[J]. 安徽农业科学,2008,36(4):1310-1311,1313.
[10]于 淼,原 源. HPLC测定益心酮片中四种黄酮类成分的含量法[J]. 东南国防医药,2015,17(2):157-159,165.
[11]王建芳,徐 春,徐萌萌,等. 利用香菇发酵中药废渣提高利用价值的研究[J]. 四川大学学报,2007,44(12):451-454.
[12]郑浩然,杨海龙. 铁皮石斛对灵芝多糖深层发酵的影响[J]. 安徽农业科学,2016, 44(19):141-142.
(本文编辑:叶华珍; 英文编辑:王建东)
Study on the bi-directional fermentation process of Ganoderma lucidum and xuanqi Tongbi residue
ZHANG Qing-ming1, XU Yun-yan1, GU Ning-ning2,
ZHANGXing-de2. 1.DepartmentofPreparations,NanjingGeneralHospitalofNanjingMilitaryCommand,Nanjing,Jiangsu210002,China; 2.CollegeofPharmacy,NanjingUniversiyofChineseMedicine,Nanjing,Jiangsu210023,China
Objective To optimize bi-directional fermentation process ofGanodermalucidumand xuanqi Tongbi residue and discover new substances from main active components. Methods With the contents of polysaccharide, ganoderic acid and saponin as detection index, the effects of fermentative parameters, such as drug residue concentration, solid-liquid ratio, particle size of residue on the yield of active substrates byGanodermalucidumwere studied. Then the new substances in main active components produced by bi-directional fermentation were analyzed using HPLC methods. Results Taking polysaccharide as the target product, the optimal fermentation condition were as follows: drug residue concentration was 25%, the ratio of solid to liquid was 1∶1.5, the particle size of residue was 60 mesh and the time was 25 d. After fermentation, the new substances both in polysaccharide component and ganoderic acid component were produced. Conclusion This study will not only provide reference for solving the pollution problems caused by the direct discharge of traditional Chinese medicine residues, but also provide the basis for the reuse of traditional Chinese medicine residues and the development of new drugs and functional feed additives.
Ganodermalucidum; xuanqi Tongbi residue; bi-directional fermentation; polysaccharide; ganoderic acid
1. 210002江苏南京,南京军区南京总医院制剂科;2. 210023江苏南京,南京中医药大学药学院
张兴德,E-mail:Xingde2293@126.com
张庆明,徐云燕,顾宁宁,等.灵芝菌-玄七通痹胶囊药渣双向发酵工艺的研究[J].东南国防医药,2016,18(6):585-590.
Q815
A
10.3969/j.issn.1672-271X.2016.06.008
2016-07-21;
2016-09-07)

