新型噬菌体的实验研究
文陶文靖 王莹 刘磊 王覃
新型噬菌体的实验研究
文/陶文靖 王莹 刘磊 王覃
针对两种噬菌体所对应的致病菌进行特异性检测和研究
本文实验表明,猪葡萄球菌和乙型副伤寒沙门氏菌对应的噬菌体能够特异性感染猪葡萄球菌和乙型副伤寒沙门氏菌,并且在有效抑制浓度下对金黄色葡萄球菌和鼠伤寒沙门氏菌的生长没有影响。
寻找更加专一、高效的选择性增菌方法是微生物快速检测行业亟待解决的问题。噬菌体作为细菌病毒,具有非常强的特异性,并且其安全性得到美国FDA的GRAS认证。目前,噬菌体在生物杀菌和超级细菌感染治疗中已经有大量的应用,但在致病菌选择性增菌、快速培养中少有应用。本文利用噬菌体开发一种新型选择性培养基,为致病菌的选择性增菌提供一种高效专一的培养方法。
实验部分
材料
菌种及海水:金黄色葡萄菌、猪葡萄球菌、鼠伤寒沙门氏菌、乙型副伤寒沙门氏菌本公司实验室分离;海水采集自青岛石老人海域;
培养基:LB培养基(1%胰蛋白胨),0.5%酵母提取物,1%NaCl;LB固体平板培养基:LB培养基基础上加入终浓度2%的琼脂。
试剂和仪器
金黄色葡萄球测试片、鼠伤寒沙门氏菌金标检测卡(北京良润生物科技);TGL-16M高速台式冷冻离心机;QYC-200恒温培养摇床;SW-CJ-1F超净台。
实验方法
噬菌体的筛选:将采集的海水样品用5倍体积去离子水稀释,再用NaOH调节pH为7.8,在5000 r/min离心15 min后并用0.45 µm的超滤膜过滤。将猪葡萄球菌(或乙型副伤寒沙门氏菌)均匀接种于LB固体平板,使菌体浓度为1.0×108 CFU/ml,将上述过滤后样品涂布于LB固体平板上,待表面干燥后,37℃倒置培养过夜。如果出现噬菌体斑即筛选到相应菌株的噬菌体。
挑取噬菌斑,加入到对数期的猪葡萄球菌(或乙型副伤寒沙门氏菌)中,于37℃震荡培养4~6 h,待澄清后,在5000 r/min离心20 min,然后用0.45 µm的滤膜过滤,得噬菌体。
致病菌的培养:将金黄色葡萄球菌、猪葡萄球菌、鼠伤寒沙门氏菌、乙型副伤寒沙门氏菌保存菌种活化,进行三线纯化,分别将单菌落接种于LB培养基中,37℃培养过夜,计数备用。
金黄色葡萄球菌、沙门氏菌的检测:分别使用良润生物科技提供的金黄色葡萄球测试片、鼠伤寒沙门氏菌金标检测卡进行检测,计数。
数据采用平均值±标准差(±s)来表示,组间比较采用SPSS17.0软件进行统计学分析,分析方法为单因素方差分析和邓肯(Duncan)多重比较分析,显著性水平p=0.05。
实验与分析
噬菌体的筛选结果
按照1.2.1所述方法分别进行猪葡萄球菌和乙型副伤寒沙门氏菌的筛选,结果均在培养过程出现噬菌斑,证明噬菌体筛选成功,分别命名为噬菌体I(猪葡萄球菌噬菌体)和噬菌体II(乙型副伤寒沙门氏菌)。进行噬菌斑的扩大培养后,经过测定猪葡萄球菌噬菌体的噬菌斑形成单位为5×1010 PFU/ml,乙型副伤寒沙门氏菌噬菌体的噬菌斑形成单位为3×1010 PFU/ml。
对猪葡萄球菌检测结果的影响
将按照1.2.2方法培养的猪葡萄球菌和金黄色葡萄球菌稀释至100 CFU/ ml,并将其分成4份,分别添加不同浓度的猪葡萄球菌噬菌体,使其终浓度分别为1.0×104 PFU/ml、1.0×105 PFU/ ml、1.0×106 PFU/ml、1.0×107 PFU/ ml,使用北京良润生物科技提供的金黄色葡萄球测试片进行检测,计数,每个实验重复三次。实验结果见表1。
从实验结果可以看出,在猪葡萄球菌培养体系中加入噬菌体I,显著抑制了猪葡萄球菌的生长,并且随着噬菌体浓度的增大抑制效果增强,当添加浓度为1.0×106 PFU/ml时,猪葡萄球菌被完全抑制。而噬菌体I添加到金黄色葡萄球菌培养体系时并没有对该菌生长产生影响,即使增加浓度也不会对金黄色葡萄球菌的生长产生影响。这个结果说明,利用1.2.1筛选的噬菌体I能够特异性的感染猪葡萄球菌,对金黄色葡萄球菌不敏感。
对葡萄球菌混合样品检测结果的影响
将培养好的猪葡萄球菌和金黄色葡萄球菌混合,适当稀释使其终浓度均达到100 CFU/ml。并将样品分成5份,分别添加不同浓度的猪葡萄球菌噬菌体,使其终浓度分别为2.0×105 PFU/ml、4.0×105 PFU/ml、6.0×105 PFU/ml、8.0×105 PFU/ml、1.0×106 PFU/ml,并使用北京良润生物科技有限公司提供的金黄色葡萄球测试片进行检测,计数,每个实验重复三次。实验结果见表2。
结果已经表明当噬菌体I浓度达到1.0×106 PFU/ml时能够有效抑制猪葡萄球菌。本实验进一步缩小了抑制剂浓度,从实验结果可以看出,当噬菌体I的终浓度达到6.0×105 PFU/ml以上时,就能够有效抑制猪葡萄球菌的生长,使测试片对金黄色葡萄球菌具有特异性。
对乙型副伤寒沙门氏菌检测结果的影响
将培养好的乙型副伤寒沙门氏菌待检品稀释至100 CFU/ml,并将其分成4份,分别添加不同浓度的乙型副伤寒沙门氏菌噬菌体,使其终浓度分别为1.0×103 PFU/ml、1.0×105 PFU/ml、1.0×107 PFU/ml、1.0×109 PFU/ml,并使用北京良润生物科技有限公司提供的鼠伤寒沙门氏菌金标检测卡进行检测,每个实验重复三次。表3实验结果表明,添加噬菌体II的浓度超过1.0×103 PFU/ ml时均可以有效抑制乙型副伤寒沙门氏菌的生长,证明筛选出来的噬菌体II能够有效感染乙型副伤寒沙门氏菌。
对沙门氏菌混合样品检测结果的影响
将培养好的乙型副伤寒沙门氏菌和鼠伤寒沙门氏菌混合,适当稀释使二者终浓度分别达到100 CFU/ml。并将样品分成若干份,分别添加不同浓度的猪葡萄球菌噬菌体,使其终浓度分别为1.0×103 PFU/ml、1.0×105 PFU/ml、 1.0×107 PFU/ml、1.0×109 PFU/ml,并使用良润提供的鼠伤寒沙门氏菌金标检测卡进行检测,每个实验重复三次,实验结果见表4。
本实验使用的微生物是乙型副伤寒沙门氏菌和鼠伤寒沙门氏菌混合培养物,当噬菌体II的浓度为1.0×103 PFU/ ml时有菌检出,而2.4的实验结果表明在同样浓度下没有乙型副伤寒沙门氏菌检出,说明本实验检出的微生物仅有鼠伤寒沙门氏菌。证明噬菌体II能够特异性的感染乙型副伤寒沙门氏菌,对鼠伤寒沙门氏菌不敏感。
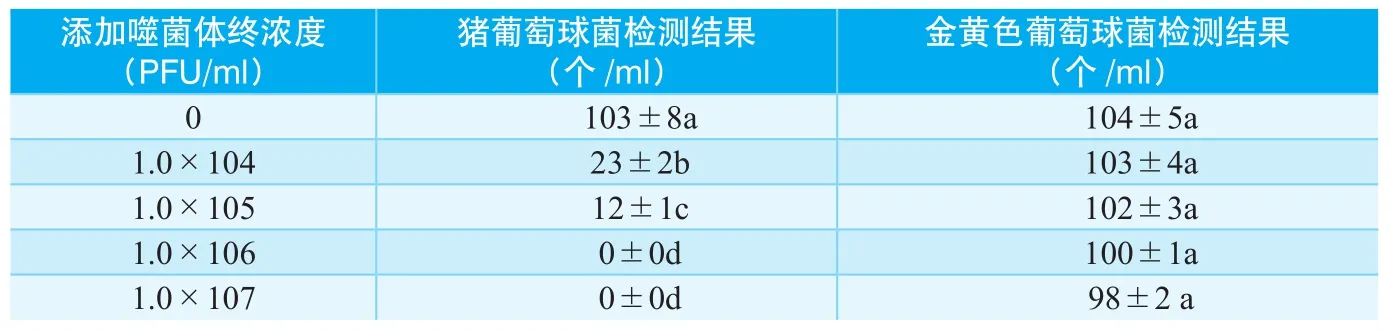
表1.噬菌体I浓度对猪葡萄球菌检测结果的影响

表2. 噬菌体I浓度对葡萄球菌混合样品检测结果的影响

表3. 噬菌体II浓度对乙型副伤寒沙门氏菌结果的影响

表4.噬菌体II浓度对混合沙门氏菌结果的影响
结果与讨论
本文针对目前致病菌(金黄色葡萄球菌和鼠伤寒沙门氏菌)检测过程中两种重要的干扰菌株(猪葡萄球菌和乙型副伤寒沙门氏菌)的现状,利用类似的方法筛选出这两菌株对应的噬菌体。实验结果表明,这两种噬菌体能够特异性感染猪葡萄球菌和乙型副伤寒沙门氏菌,同时在有效抑制浓度下对金黄色葡萄球菌和鼠伤寒沙门氏菌的生长没有影响。因此可以将这两种噬菌体进行金黄色葡萄球菌和鼠伤寒沙门氏菌的选择性增菌,从而实现这两种致病菌的特异性检测。 LP
本文作者陶、刘来自北京良润公司;王莹来自青岛农大食品科学工程院;王覃来自北京智云达公司。

