表面处理镁合金接骨板耐蚀性和微动磨损性能研究
周 均,周梦林,郑 靖,何 涛,
1 浙江省医疗器械检验院,杭州市,310018
2 西南交通大学摩擦学研究所,成都市,610031
3 浙江省医疗器械安全性评价研究重点实验室,杭州市,310018
表面处理镁合金接骨板耐蚀性和微动磨损性能研究
【作者】周 均1,周梦林2,郑 靖2,何 涛1,3
1 浙江省医疗器械检验院,杭州市,310018
2 西南交通大学摩擦学研究所,成都市,610031
3 浙江省医疗器械安全性评价研究重点实验室,杭州市,310018
针对镁合金作为金属接骨板时由于降解速率过快导致其机械性能恶化的问题,该文选用ZK60镁合金作为研究对象,首先在其表面通过微弧氧化处理形成外层多孔的氧化层,然后采用电沉积方法在氧化层上沉积羟基磷灰石涂层,对多孔表面进行封孔处理,采用体外模拟试验测试其耐腐蚀性能和微动磨损性能。结果表明,两者能够有效提高镁合金的耐腐蚀性能,其中,后者的耐腐蚀性能较好,和前者相比,后者的微动磨损性能明显降低,涂层剥落明显。
金属接骨板;镁合金;微弧氧化;羟基磷灰石;微动磨损
0 引言
金属接骨板是一类用于固定骨折的骨科植入器械,材质多为不锈钢、纯钛及钛合金,其较高的弹性模量在固定骨折期间容易形成应力遮挡,不利于骨折愈合,从而导致植入物在体内长时间承受载荷而引发失效[1-2]。研究表明,接骨板在体内的失效断裂经常发生在螺钉孔处。在人体进行康复活动的过程中,螺钉与接骨板接触点所造成的微动腐蚀往往是破坏的起源[3]。
镁合金作为金属接骨板具有独有特效,其密度与人体皮质骨密度接近,且具有较低的弹性模量(E=41~45 GPa)[4],较低弹性模量的接骨板能够明显降低其在骨折固定中的应力遮挡,从而有利于骨折愈合[5]。而且镁合金接骨板能够在体内完全降解,无须二次取出,能有效降低外科手术费用和患者疼痛。此外,镁合金接骨板在生物体内降解能够促进骨钙盐在植入体表面沉积[6],促进骨伤愈合[7]。但是,镁合金在生物体内降解速率过快从而导致无法有效保持机械完整性是其用作接骨板的一大难题[8]。目前,镁合金在接骨板中的应用尚处于研究阶段[9-10],合金化和表面处理是提高其耐蚀性能的两种重要手段[11-12]。前期研究结果表明,镁合金表面进行微弧氧化处理可以有效提高其生物相容性、耐蚀性和耐磨性能[13-15],但是,目前几乎没有研究关注镁合金在接骨板服役工况下的微动磨损性能。
本论文研究采用恒电压模式对ZK60镁合金表面进行微弧氧化处理,并采用电沉积法在氧化层上沉积羟基磷灰石涂层进行封孔处理,在此基础上,采用模拟体液作为介质,考察了表面处理后的镁合金在接骨板服役工况下的耐蚀性和微动磨损行为。
1 实验材料与方法
1.1 样品制备
基体材料选用挤压态ZK60镁合金,组成成分见表1。镁合金样品尺寸为10 mm ×10 mm×20 mm,经400#到2500#砂纸逐级打磨至表面光滑。微动磨损试验采用直径d=12 mm的挤压态ZK60镁合金半球作为对摩件,表面粗糙度Ra=0.02 µm。室温下用无水乙醇对样品进行超声清洗5 min后干燥备用。

表1 镁合金ZK60的元素组成(wt%)Tab.1 Elemental composition of magnesium alloy ZK60
微弧氧化电解液为5 g/L NaOH、15 g/L Na2SiO3·9H2O和7 g/L KF。微弧氧化采用直流脉冲模式,电源额定功率为50 kW,恒定电压为400 V,电解液由搅拌器和循环水进行冷却,溶液温度不高于35oC。
微弧氧化处理后,镁合金样品经去离子水清洗,然后在电解质中电沉积羟基磷灰石涂层。电解液为0.042 mol/L Ca(NO3)2·4H2O,0.025 mol/L (NH4)2HPO4和0.1 mol/L NaNO3,处理过程参见文献[16]。沉积完成后用去离子水清洗样品,并在80oC 0.1 mol/L的NaOH溶液中浸泡4 h后干燥。
通过扫描电镜观察样品表面微观形貌,分别采用X射线能谱仪和X射线衍射对样品表面元素和组成成分进行表征。
1.2 耐蚀性实验
利用电化学工作站,将微弧氧化处理(MAO-treated sample)和羟基磷灰石封孔处理(HA-sealed MAO sample)两种镁合金样品置于Hank’s溶液中进行极化测试,测试温度为37 ℃。
1.3 微动磨损实验
为了模拟接骨板服役工况,采用球—平面接触模式的切向微动来模拟接骨板固定骨折后病人在行走过程中接骨板与螺钉的工作状态。微动试验在PLINT微动磨损试验机上进行[17],表面处理后的镁合金制成平面和球面试样,试验介质为Hank’s溶液。实验参数为:位移幅值D为60 µm,法向载荷Fn为40 N,频率f为2 Hz,循环次数 N 为1×104次,试验温度为25oC,试样接触界面浸润在模拟体液中。
2 结果与讨论
2.1 涂层表面形貌与耐蚀性
镁合金ZK60经微弧氧化处理后的表面形貌如图1所示,表面呈多孔状,局部存在裂纹图1(a)。通过电化学沉积处理后,微弧氧化处理层表面形成了片状晶体图1(b),EDX线扫结果显示电沉积层主要含Ca、P元素。XRD分析结果表明(图2),微弧氧化处理层主要含有MgO和Mg2SiO4,经电沉积后,表面层主要含有羟基磷灰石。

图1 镁合金样品表面SEM形貌照片Fig.1 SEM images of surface morphology of magnesium alloy samples
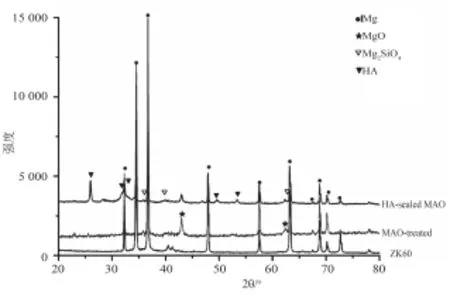
图2 ZK60镁合金样品表面处理前后的XRD表征图谱Fig.2 XRD patterns of ZK60 alloywith and without coating
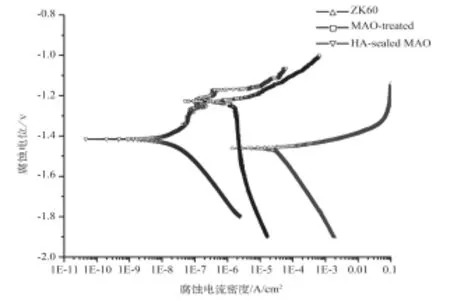
图3 ZK60镁合金样品表面处理前后的极化曲线Fig.3 Typical polarization curves of ZK60 alloy with and without coating
图3 为ZK60镁合金样品表面处理前后在Hank’s溶液中的Tafel极化曲线。可以发现,与未经任何表面处理的ZK60镁合金样品相比,无论是表面微弧氧化处理还是微弧氧化后再沉积羟基磷灰石,均能显著提高镁合金表面的腐蚀电位,腐蚀电流密度明显降低。通过Tafel外推法得到ZK60样品、微弧氧化处理样品和HA封孔处理样品的腐蚀电位Ecorr分别为-1.47 V、-1.24 V和-1.41 V,腐蚀电流密度icorr分别为2 × 10-5A/ cm2、1.9 × 10-6A/cm2和2.8 × 10-8A/cm2。显然,HA封孔处理样品的腐蚀电流密度比微弧氧化处理样品降低了两个数量级,耐蚀性得到显著提升。
2.2 微动磨损行为
图4给出了微弧氧化处理和羟基磷灰石封孔处理两种镁合金样品表面摩擦系数随循环次数的变化关系曲线。可见,在模拟接骨板服役工况的微动环境下,随着循环次数增加,微弧氧化处理镁合金样品表面摩擦系数变化平稳,约为0.55;而羟基磷灰石封孔处理镁合金样品在摩擦接触初期摩擦系数高达0.9,经200次循环后摩擦系数急剧降低,随后摩擦系数随着循环次数增加缓慢降低,1 000次循环后摩擦系数在0.45处波动。

图4 微弧氧化处理和羟基磷灰石封孔处理两种样品表面摩擦系数Fig.4 Coeff cient of friction of MAO-treated sample and HA-sealed MAO sample
图5 给出了两种镁合金样品磨损表面形貌OM照片。可以发现,在给定的试验工况下,两种镁合金样品的微动过程均处于滑移区。微弧氧化处理镁合金样品磨损较为轻微,呈现轻微犁沟和局部粘着剥落,表面处理层依然存在;而羟基磷灰石封孔处理镁合金样品表面呈现显著磨损,表面处理层被完全去除,露出镁合金基体。显然,羟基磷灰石封孔处理镁合金在模拟体液中的微动性能明显劣于微弧氧化处理镁合金。
由于微弧氧化处理层的表层为多孔层,且表面粗糙度较高,经过前期磨合后,微弧氧化处理镁合金样品表面摩擦系数会逐渐相对稳定。而羟基磷灰石封孔处理镁合金样品表面的羟基磷灰石层,相当于第三体磨粒,增大了界面间的摩擦力,当表层羟基磷灰石层被去除后,接触界面间的摩擦系数急剧降低,随后摩擦系数进一步降低并伴随较大波动,则表明镁合金表面处理层在微动过程中遭到破坏。这可能是因为在电沉积时以MAO镁合金试样作为阴极,在阴极表面会产生少量H2,从而破坏了微弧氧化处理层的原始结构,降低了表面处理层与基体的结合强度,此外,外表层的羟基磷灰石涂层明显增加了接触界面间的摩擦力,更易导致表面破坏,使得羟基磷灰石封孔处理镁合金样品的抗微动磨损性能降低。

图5 镁合金样品表面磨痕形貌OM照片Fig.5 OM images of surface wearscars of magnesium alloy samples
3 结论
在ZK60镁合金样品表面通过微弧氧化处理后形成外层多孔、内层紧密的涂层,其主要成分是MgO和Mg2SiO4,能够有效地提高镁合金在模拟体液中的抗腐蚀性能。在此氧化层表面用电沉积法沉积羟基磷灰石涂层,不仅能够有效对其进行封孔处理,而且可以进一步提高镁合金在模拟体液中的抗腐蚀性能。和微弧氧化处理镁合金样品相比,电沉积封孔后的微弧氧化涂层的微动磨损性能明显降低,涂层剥落明显。为了避免电沉积法对微弧氧化层内部的影响,下一步将采用可降解高分子材料对微弧氧化层进行封孔处理,研究封孔处理后微弧氧化层的微动磨损性能。
[1] Nassiri M, Macdonald B, O’ Byrne JM. Locking compression plate breakage and fracture non-union: A finite element study of three patient-specific cases[J]. EU J Orthop Surg Traum, 2012, 22(4):275-281.
[2] Stauffer AC, Koss DA, Mckirgan JB. Microstructural banding and failure of a stainless steel[J]. Metall Mater Trans A, 2004, 35(4):1317-1324.
[3] Tavares SSM, Mainier FB, Zimmerman F, et al. Characterization of prematurely failed stainless steel orthopedic implants[J]. Eng FailAnal, 2010, 17(5):1246-1253.
[4] Staiger MP, Pietak AM, Huadmai J, et al. Magnesium and its alloy as orthopedic biomaterials: A review[J]. Acta Biomater, 2006, 27(9):1728-34.
[5] Becker G, Calvis A, Hazlett L, et al. Bioabsorbable polymeric fracture f xation devices aim to reduce stress shielding in bone[C]// NE Bioeng Conf, IEEE, 2014:8727-8738.
[6] Chaya A, Yoshizawa S, Verdelis K, et al. In vivo, study of magnesium plate and screw degradation and bone fracture healing[J]. Acta Biomater, 2015, 18: 262-269.
[7] Chaya A, Yoshizawa S, Verdelis K, et al. Fracture healing using degradable magnesium fixation plates and screws[J]. J Oral Maxillof Surg, 2015, 73(2): 295-305.
[8] Lin X, Tan L, Wang Q, et al. In vivo, degradation and tissue compatibility of ZK60 magnesium alloy with micro-arc oxidation coating in a transcortical model[J]. Mater Sci Eng C, 2013, 33(7):3881-3888.
[9] Chen Y, Xu Z, Smith C, et al. Recent advances on the development of magnesium alloys for biodegradable implants[J]. Acta Biomater, 2014,10(11):4561-4573.
[10] 齐峥嵘, 张强, 殷毅,等. 可降解镁合金作为骨植入材料的体内研究进展[J]. 中国修复重建外科杂志, 2012(11):1381-1386.
[11] Wu G, Ibrahim JM, Chu PK. Surface design of biodegradable magnesium alloys — a review[J]. Surf Coat Technol, 2013, 233(1):2-12.
[12] Zeng R, Dietzel W, Witte F, et al. Progress and Challenge for Magnesium Alloys as Biomaterials[J]. Adv Eng Mater, 2008, 10(8):B3-14.
[13] 曾志恒, 楼白杨. 镁合金微弧氧化膜的耐蚀性及其在腐蚀介质下的磨损行为[J]. 材料科学与工程学报, 2011(3):433-436.
[14] Zhang XP, Zhao ZP, Wu FM, et al. Corrosion and wear resistance of AZ91D magnesium alloy with and without microarc oxidation coating in Hank’s solution[J]. J Mater Sci, 2007, 42(20):8523-8528.
[15] Yang X, Li M, Lin X, et al. Enhanced in vitro biocompatibility/ bioactivity of biodegradable Mg-Zn-Zr alloy by micro-arc oxidation coating contained Mg2SiO4[J]. Surf Coat Technol, 2013, 233:65-73.
[16] Chen S, Guan S, Li W, et al. In vivo, degradation and bone response of a composite coating on Mg-Zn-Ca alloy prepared by microarc oxidation and electrochemical deposition[J]. J Biomed Mater Res B: Appl Biomater, 2012, 100(2):533-543.
[17] 朱旻昊, 周惠娣, 陈建敏,等. 二硫化钼粘结固体润滑涂层的径向和切向微动损伤的比较研究[J]. 摩擦学学报, 2002, 22(1):14-18.
Study of the Anti-corrosion and Anti-fretting Properties of Surf cial Treated magnesium Alloy Bone Plate
【 Writers 】ZHOU Jun1, ZHOU Menglin2, ZHENG Jing2, HE Tao1,3
1 Zhejiang Institute of Medical Device Supervision and Testing, Hangzhou, 310018
2 Southwest Jiao Tong University, Tribology Research Institute, Chengdu, 610031
3 Zhejiang Provincial Key Laboratory of Medical Device Safety Evaluation, Hangzhou, 310018
The weakening of mechanical properties caused by rapid degradation has been an impediment to the clinical application of magnesium alloy for a long time. In this paper, the effect of surface treatment on the anti-corrosion and anti-fretting properties of magnesium alloy ZK60 was studied. Firstly, an oxidizing layer whose outer layer was porous was first made on the surface of magnesium alloy through micro-arc oxidation treatment (MAO). Then ahydroxyapatitecoating was fabricated by electrodeposition on the oxidizing layer to seal the porous layer. The corrosion resistance and fretting performance of them were investigated in vitro under a simulated bone-plate service condition. Polarization testing results showed that both of them can signif cantly enhanced the corrosion resistance of magnesium alloy and the corrosion resistance of the latter was better. The fretting testing results showed that obvious coating f aking occurred on the worn surface of the latter, and its anti-fretting properties are inferior to that of the former.
metallic bone plate, magnesium alloy, micro-arcoxidation, hydroxyapatite, fretting
TG115.58
A
10.3969/j.issn.1671-7104.2016.05.009
1671-7104(2016)05-0347-04
2016-08-17
浙江省科技厅省属科研院所专项(2014F30030)
周均,E-mail: clarezj1217@126.com

