口服药物制剂的开发设计与评估
刘爱玲
(瑞普(天津)生物药业有限公司,天津 300300)
口服药物制剂的开发设计与评估
刘爱玲
(瑞普(天津)生物药业有限公司,天津 300300)
阐述了口服药物的药物特性、不同动物胃肠道生理特性、药物制剂口服吸收评价三个方面的内容。口服药物开发设计需要考虑药物本身的特性、靶动物胃肠道生理特性和药物制剂剂型;药物本身的特性常常可参考药物的生物药剂学分类特性进行差异化的药物制剂设计;不同物种肠道长度及pH值也存在很大差异,口服药物设计时要充分给予考虑,同时介绍了口服药物的评估模型(人工生物膜模型、细胞模型和动物模型),以期为药学研究工作者开发设计与评估口服药物制剂提供参考。
口服药物制剂;开发;设计;评估
口服给药是药物经口服后被胃肠道吸收入血,起到局部作用或全身作用的一种给药途径,经口给药不论对人,还是动物都是最为常用、最方便、又较安全的给药方法,但是药物口服吸收是一个十分复杂的过程,胃肠道生理特性、药物的理化性质和制剂等因素的变化都会对药物吸收产生大的影响。作为药学研究工作者来说,必须要了解药物特征,了解口服药物的吸收机制,了解不同种属的生理结构等影响因素由为重要,特别是对于口服生物利用度较低的药物,研究影响其吸收的因素, 对于改善药物的吸收性质,提高药物的临床疗效具有重要的意义。
1 口服药物的药物特性
在设计药物过程中第一步要考虑的就是药物本身的特性,可以根据药物溶解性、渗透性等特性设计剂型、设计给药途径,通过体外测定药物的溶解性、渗透性相关药物参数,对药物的溶解度和渗透的研究预测药物是属于溶解控制还是吸收控制。具体可以参考BCS生物学分类思路。
1.1 药物的生物药剂学分类(BCS)及其应用 生物药剂学分类系统是由Amidon等1995年提出的关于药物的分类概念,给药学研究者以及药物评审机构提供了很好的指导,美国FDA已经将其应用于仿制药物评审指导,药物制剂研究人员也可按照其分类来设计制剂组方(表1、表2)[1]。

表1 生物药剂学分类及开发原则

表2 WHO对药物生物药剂学分类[2]
高渗透性的定义:大于或等于85%的药物在小肠得以吸收, 则判定为高渗透性药物。一般可使用动物在体灌肠试验方法、动物肠组织切样体外渗透性实验、体外表皮单细胞培养通透性实验等方法进行药物渗透情况研究。考虑药物在透过胃肠壁膜前可能会有部分降解,为证明药物从胃肠道消除是由于药物透过胃肠壁膜而不是发生降解,研究中需注意考察药物在胃肠道中的稳定性。高溶解性的定义:在37 ℃条件下, 如果药物单次最高剂量可溶解于250 mL的pH 1~7.5 的介质中, 则判定为高溶解性药物。
1.2 口服药物制剂的特性 剂型决定了给药途径和吸收途径,口服制剂具有方便给药的特性常被首先考虑开发的制剂,如果药物苦味等较重,可以选择做成微囊、片剂包糖衣、胶囊等剂型,如果对胃刺激性大或酸中不稳定的药物,可以制成肠溶制剂,从治疗效果的角度欲发挥速效作用可将药物制成口服液剂、可溶性粉剂、合剂、气雾剂、颗粒剂、分散剂;欲使作用缓慢发挥作用,可将药物制成蜜丸、缓释片剂、缓释微囊等。
2 不同动物胃肠道生理特性
人体以及各类动物胃肠道系统由于性状、大小、功能各异,导致在pH值、胆汁、胰液、粘液、流体体积和内容物之间存在很大的生理差异,这些差异将会对药物溶出速率、溶解度、运送时间、药物分子跨膜转运造成影响,不同动物胃肠道微生物的含量不同,也将会对药物代谢、肝肠循环产生不同结果,胃肠道的尺寸和蠕动不同将导致药物在胃肠道内的运输时间不同,在胃肠道肠粘膜上存在蛋白质差异也将会影响药物与受体结合,影响药物的吸收,因此在设计药物制剂时要充分考虑这些因素。
2.1 不同物种胃部特征 哺乳动物不同物种之间基本结构相似,但是胃肠道的整体形态会受食物性质、食物摄入频率、需要存储的食物以及身体的大小形状影响,胃肠道的形态以及粘膜区面积有很大不同,各类物种的胃粘膜分布形状如图1,粘膜区基本分贲门腺区、胃底腺区和幽门腺区[3-4]。
人与狗、猪的胃部是最为接近的,胃部基本都是由贲门、胃底、幽门三部分腺粘膜组成,猪的胃是人的2~3倍,且胃的大部分被贲门腺体粘膜占据,马、牛相对腺体粘膜部位较少,啮齿动物和马、猪在进食部分端有无腺体区,被覆盖角化的复层鳞状上皮细胞,用于存储和食物的消化。
2.2 不同物种肠道特征 肠道特征如表3所示。
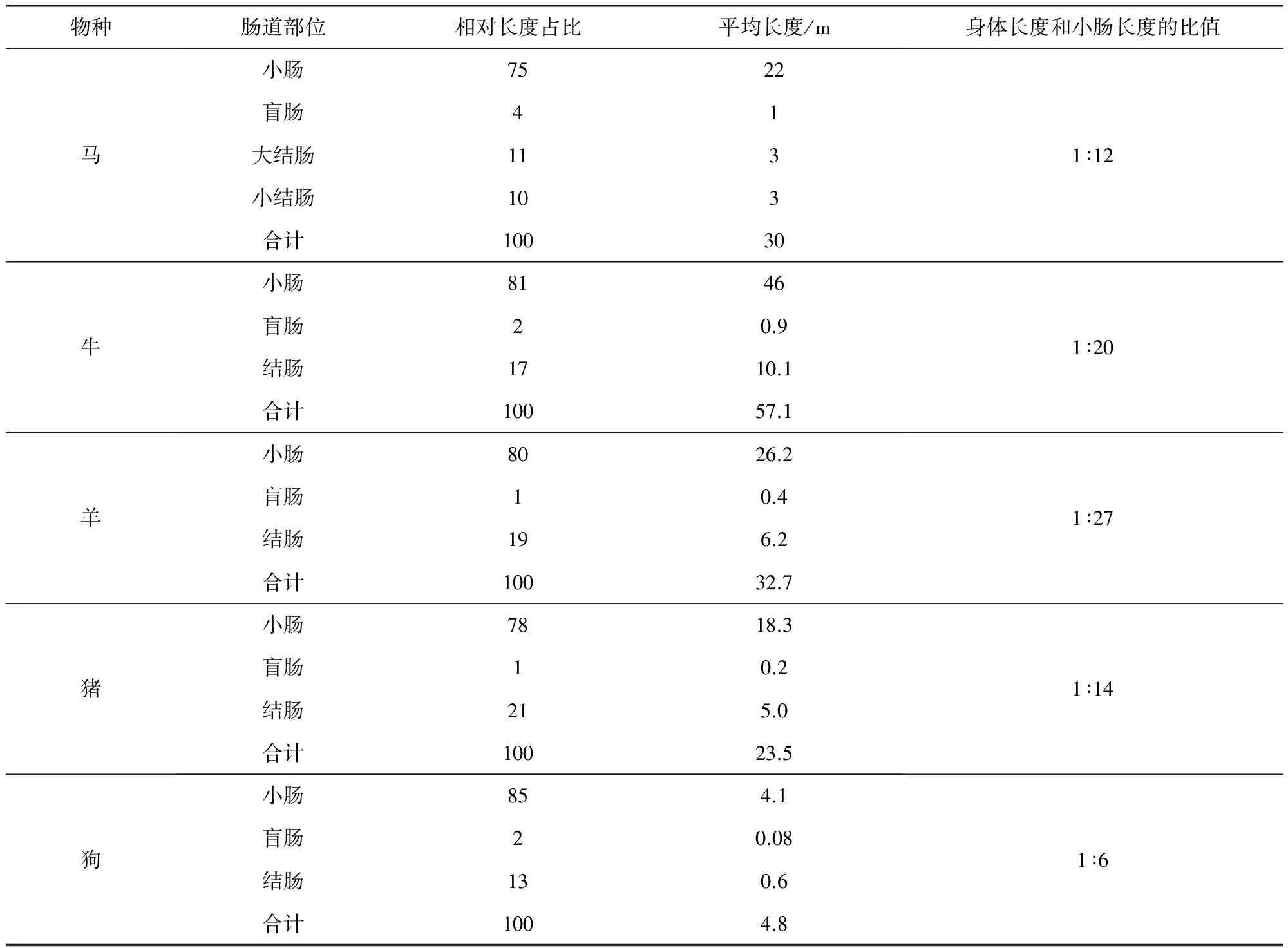
表3 不同动物解刨后测定的肠道长度
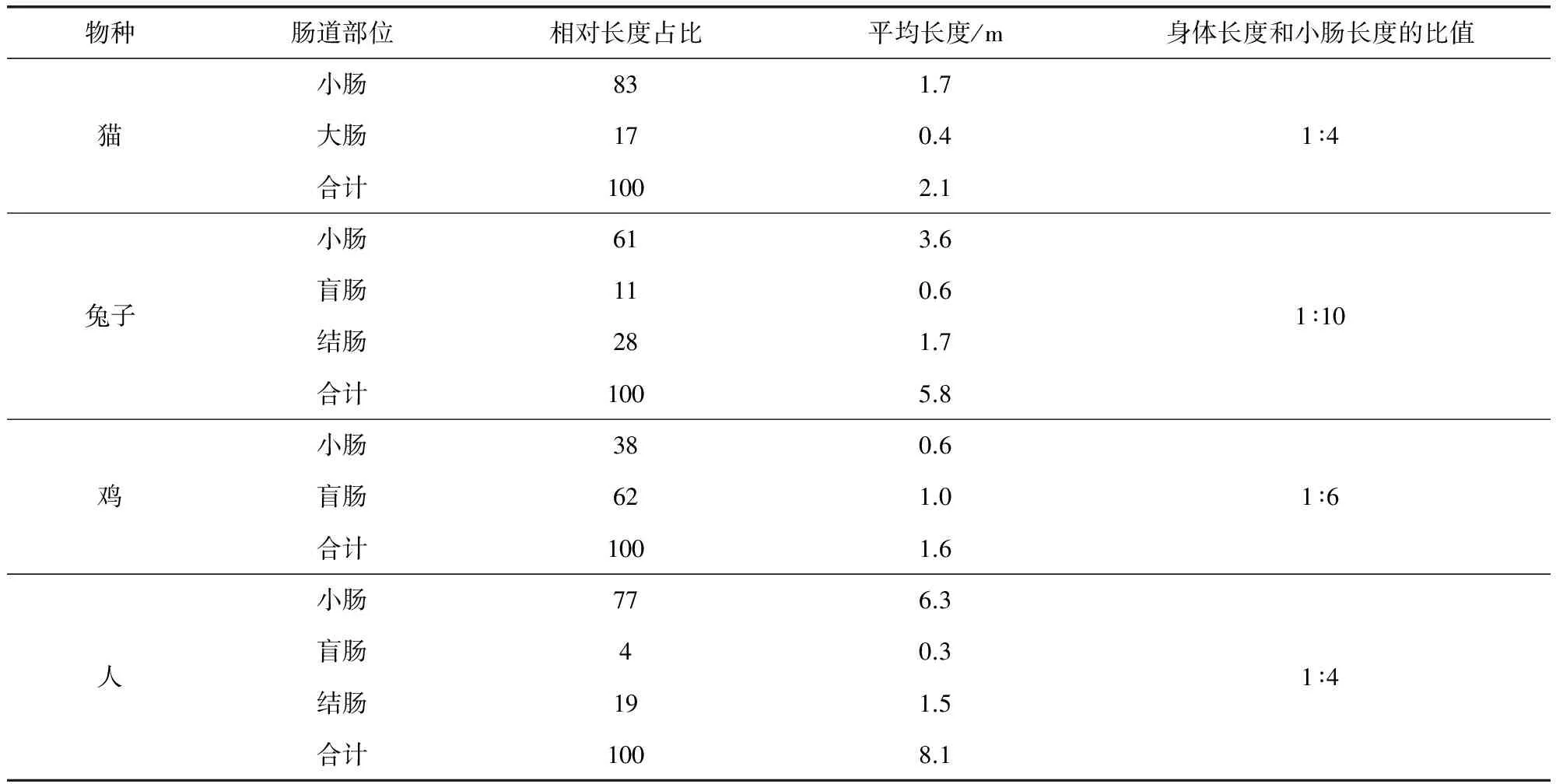
续表
草食性动物要消化植物具有消化道长,杂食性动物(人、猪、熊):中等长度消化道,肉食性动物(狼、狗、猫)可以消化动物性脂肪及蛋白质,消化道短且酸性,小肠也短。由表3中解刨后的动物小肠长度值可以看出,牛羊具有很庞大的小肠,而且是自身机体长度的20倍以上,猪14倍,马16倍,猫和狗相对较少只有6倍和4倍。小肠内膜是由列成环形皱褶的柱状上皮细胞组成,每个上皮细胞表面都有微绒毛,使的小肠表面积增大了500多倍。小肠是营养物质及药物吸收的主要场所[5]。不同动物胃肠道pH值也有区别,详细参考数据如表4所示。
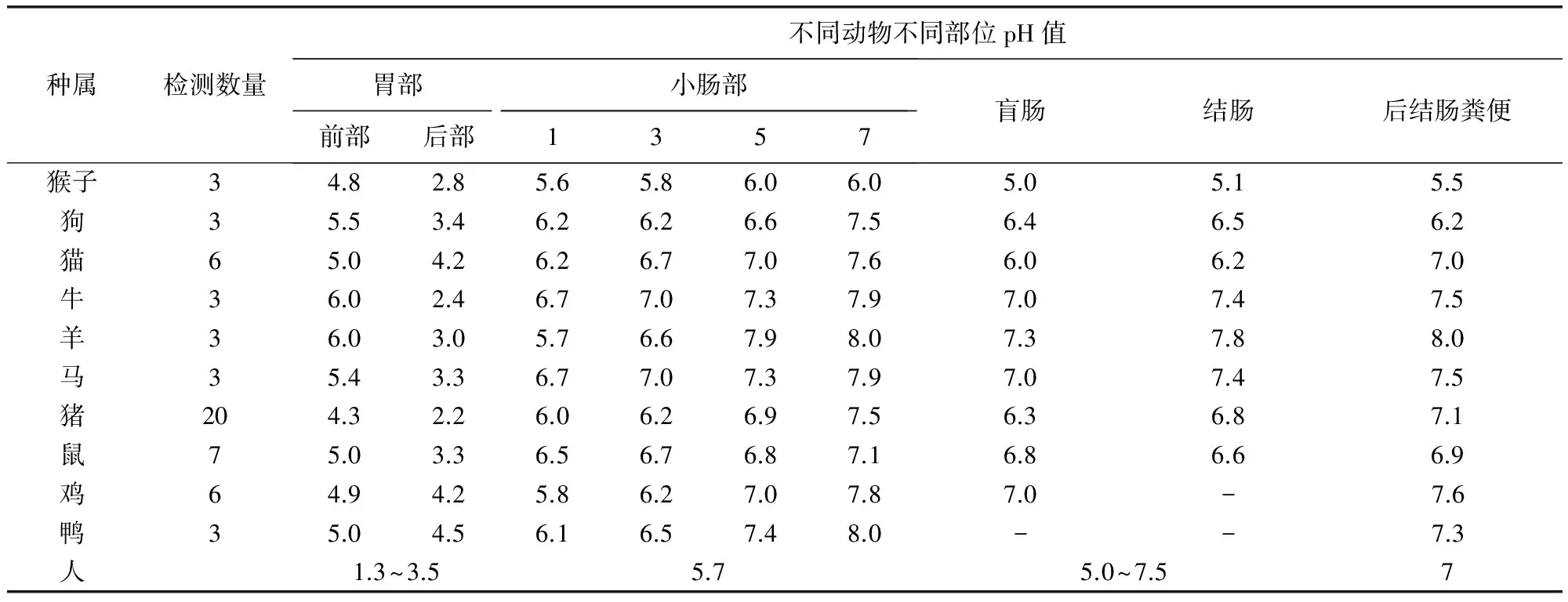
表4 不同种属动物胃肠道pH值
3 药物制剂口服吸收评价
目前用于研究药物给药吸收评价模型主要有人工生物膜模型、细胞模型和动物模型。人工生物模型是通过制备模拟上皮细胞人工生物膜,测定药物通过人工膜的情况来对药物在体内的吸收进行科学的预测和评价,该方法可以作为药物制剂筛选过程中比较好的评价方法;细胞模型是采用自发生长表达比较好的人源、动物源细胞制备细胞层后进行药物分子跨膜转运的研究,适用于原料药物研发过程中化合物筛选;动物模型主要采用大鼠等实验动物以及靶动物进行离体肠道和在体胃肠道系统进行药物吸收分析,该方法相对能更加真实反映药物的吸收过程,但是相对复杂,影响因素比较多,一般用于评价药物的吸收机理、代谢过程等的研究。
3.1 人工生物膜模型 人工生物膜法[6-7]一般采用磷脂双分子层或凝胶色谱柱作为载体,分别测定药物的磷脂双分子层透过率和色谱柱的保留值来初步评判药物在体内吸收情况。
磷脂双分子层:一般采用过滤板,吸取溶解于十二烷的磷脂溶液10 μL 加于96孔滤板中的疏水膜上,10 min内定量吸取待测样品液加入到膜上方作为给药池,膜另一侧加入空白磷酸盐缓冲液为接受池,将滤板置于振荡水浴锅内低速振摇后取接受池样品进行测试分析。一般最好要设置对照药物或制剂同时试验。
凝胶色谱柱法:首先将硅胶活化,至于20%的盐酸中回流,大量蒸馏水洗至中性,120 ℃下真空干燥过夜,取1 g卵磷脂用10~30 mL溶剂溶解,加入活化硅胶4 g旋转挥发,除去有机溶剂后,真空条件下继续挥发3 h,除去残留溶剂。加入磷酸盐缓冲溶液,静置使缓慢溶胀4 h。缓冲液洗涤3000 r/min离心3次除去未固载的卵磷脂,装柱制成模拟生物膜色谱柱,测定研制的不同制剂、参比制剂等的保留值,来预测药物在体内的吸收过程。
3.2 细胞模型 细胞模型一般采用Caco-2 细胞系( 来源于人结肠腺癌细胞)、T84 细胞系( 来源于人结肠癌细胞)、MDCK 细胞系( 来源于马丁达比犬肾上皮细胞)、LLC-PK1 细胞系( 来源于猪的近端肾小管上皮细胞)在支撑膜上形成细胞层,加载测试药液后,在37 ℃恒温摇床中释药,不同时间测定两侧及细胞中的药物含量,模拟体内吸收情况。
3.3 动物模型 在体灌流法一般有几种,常用的方法是采用麻醉后的大鼠开腹用生理盐水清洗肠道内容物后,加入不被吸收的酚红等标示物进行肠道单向灌流、循环灌流或肠血管灌流在体方法,测定肠道、血液等当中的药物浓度,真实反映药物在小肠的吸收过程。
离体试验法是取大鼠小肠段,分取肠黏膜并将其固定于扩散池上,用于测定药物透过上皮细胞的情况;也可以分离出小肠段并去掉肠系膜并分割为若干小段,外翻使肠黏膜向外,结扎一端后灌注人工培养液再结扎另一端形成囊状,置于含药培养液中培养,根据囊内、外被测药物随时间的变化量来反映肠道对物质吸收状况,测定药物透过上皮细胞的情况。
动物体内法是直接采用试验动物或靶动物,经口灌药或服药后不同时间采用色谱法等在不同时间测定血液里面药物原型及代谢物的含量浓度,从而反映或评价药物在体内的吸收。
4 小结
好的药物是设计出来的,经口给药的药物制剂虽然方便、安全、适用,但是因为其影响因素很多,要想开发出一个疗效可靠的好制剂,设计者首先要研究药物的溶解性、渗透性、稳定性、起效浓度、药物的中毒浓度等理化性质,研究开发成口服制剂的可能性,然后根据给药对象是人、牛、羊、犬还是鸡,分析不同给药对象的胃肠道生理结构、分泌物、对药物的吸收、代谢存在差异问题,研究不同种属对药物的耐受性、敏感性等问题,充分考虑各种因素后,设计研究的药物制剂再采取相对科学的评价方法进行评价。
[1] GAO Yang,GENG Li-dong.Comparison and discussion of FDA,WHO and EMA guidelines on BCS-based biowaiver[J].Chinese Journal of New Drugs,2012,21(24):2861-2869.
[2] Jennifer B Dressman,Gordon L Amidon,Christos Reppas,etal.Dissolution Testing as a prognostic tool for oral drug absorption:immediate release dosage forms[J].Pharmaceutical research,1998,15(1): 11-22.
[3] Marilyn Martineza, Gordon Amidonb, Lane Clarkec,etal.Applying the biopharmaceutics classification system to veterinary pharmaceutical products Part II. Physiological considerations[J].Advanced Drug Delivery Reviews,2002,54:825-850.
[4] Tugrul T. Kararli.Comparison of the gastrointestinal anatomy, physiology, and biochemistry of humans and commonly used laboratory animals[J].Biopharmaceutics & Drug disposition,1995,16:351-380.
[5] Yasushi Shono, Ekarat Jantratid, Jennifer B Dressman.Precipitation in the small intestine may play a more important role in the in vivo performance of poorly soluble weak bases in the fasted state: Case example nelfinavir[J].European Journal of Pharmaceutics and Biopharmaceutics,2011,79:349-356.
[6] 毛希琴,邹汉法,罗权舟,等. 模拟生物膜色谱用于预测药物的小肠吸收[J].分析化学,2001,10(29):1135-1139.
[7] 莫李立,王素军.口服药物吸收模型的研究进展[J].广东药学院学报, 2011,27(1):104-106.
(编辑:侯向辉)
Design and Evaluation of Oral Drug Preparations Development
LIU Ai-ling
(TianjinRingpuBio-TechnologyCoLtd,Tianjin300300,China)
This paper describes three aspects: the characteristics of the oral drug, the gastrointestinal physiological characteristics of the target different animals and evaluation of pharmaceutical preparation formulations. While developing and designing oral drugs, the characteristics of the drug itself, the gastrointestinal physiological characteristics of the target animals and pharmaceutical preparation formulations should be taken into consideration; the characteristics of the drug itself often refer to the biopharmaceutic classification features to process the designing of differentiated pharmaceutical preparations; furthermore, the intestinal length and the pH value of different species animals are quite different, which should be fully considered when designing the oral drugs. The evaluation models of oral drugs such as artificial biological membrane models, cell models and animal models are also introduced in this text.
oral drug preparations;development;design;evaluation
刘爱玲,高级工程师,从事创新药物及制剂开发研究。E-mail:hhaa2000@sohu.com
2016-06-29
A
1002-1280 (2016) 09-0061-05
S851.66

