非生物胁迫对水通道蛋白启动子活性的调节作用
宋 顺,黄东梅,徐碧玉,金志强,孙 威,许桂莺,李敬阳,许 奕,
(1.中国热带农业科学院海口实验站,海南 海口 570102;
2.海南省香蕉遗传改良重点实验室,海南 海口 570102;
3.中国热带农业科学院热带生物技术研究所/农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101)
非生物胁迫对水通道蛋白启动子活性的调节作用
宋 顺1,2,黄东梅1,2,徐碧玉3,金志强1,2,孙 威1,2,许桂莺1,2,李敬阳1,2,许 奕1,2,3
(1.中国热带农业科学院海口实验站,海南 海口 570102;
2.海南省香蕉遗传改良重点实验室,海南 海口 570102;
3.中国热带农业科学院热带生物技术研究所/农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101)
前期通过染色体步移法克隆得到巴西蕉水通道蛋白基因MaPIP1-2上游841 bp的启动子序列,分析其启动子序列含有响应干旱和高盐等非生物胁迫的顺式作用元件。为了进一步研究该启动子的功能,成功构建MaPIP1-2基因启动子的植物表达载体,并且转化拟南芥,在MaPIP1-2::GUS 转基因拟南芥中发现,MaPIP1-2启动子活性受到干旱和高盐的诱导表达,随着浓度增加,其启动活性增强。
水通道蛋白;启动子;逆境;GUS
香蕉是热带、亚热带地区最重要的经济作物之一,被联合国粮农组织(FAO)定位为发展中国家仅次于水稻、小麦、玉米之后的第四大粮食作物。香蕉前期植株较小,根系浅生,易受旱。在栽培生产中,香蕉耗水量大,缺水会导致香蕉变小、果实数量减少和营养器官生长发育不良,从而造成减产[1]。因此,提高香蕉抗旱能力对于香蕉生产至关重要。研究相关的功能基因来提高香蕉抵御干旱及非生物胁迫的能力是一个重要途径。
水通道蛋白(aquaporins,AQPs)具有转运水和其他小分子(如甘油、尿素)的功能,在植物适应逆境胁迫方面起重要作用[2]。有关报道显示,植物能够通过调节AQP的表达响应多种非生物逆境的胁迫,AQP的活性直接受磷酸化调控,其受非生物胁迫[3]、ABA和乙烯等植物激素[3-5]、H2O2[6]等一系列的刺激影响。在200 mmol/L NaCl的处理下,大麦 HvPIP2能够调节水分的流失,在非洲爪蟾卵母细胞中表现出了较强的水转运活性[3],外源ABA能够提高太阳花和玉米根部的导水率[7]。对玉米中“冷忍耐型”和“冷敏感型”的AQP功能进行研究表明,“冷忍耐型”的AQP活性更高,是由于氧化作用减少了对膜的损害[6]。在植物中过量表达一些AQP家族基因能够提高转基因植物对干旱胁迫的耐受性[8-11]。例如,过表达TaAQP7提高了转基因烟草对干旱胁迫的耐受性[11]。在拟南芥中转化大麦TaTIP2;2提高了转基因拟南芥对干旱胁迫的耐受性[12]。
干旱和盐等非生物胁迫极大影响了植物的生长发育和新陈代谢[13-14]。而植物本身具有自身能够响应存在多种对这些胁迫的适应机制,这些响应机制能够帮助植物在非生物胁迫中迅速产生反应得以生存。植物对干旱和高盐胁迫的应答主要是通过对胁迫信号的感知和对胁迫信号的转导,从而作出应答反应而降低胁迫所导致的伤害。
目前,调控该基因响应干旱和盐等非生物胁迫的机制仍未有相关报道。前期通过染色体步移法克隆出香蕉MaPIP1-2启动子,并对该启动子序列进行初步预测,本试验将该启动子构建植物表达载体,进一步通过农杆菌介导法转化拟南芥,研究不同诱导条件下GUS蛋白的活性差异,为进一步研究MaPIP1-2基因在香蕉抗逆途径中的功能奠定基础。
1 材料与方法
1.1 试验材料
拟南芥野生型种子为中国热带农业科学院热带生物技术研究所保存并提供。
大肠杆菌感受态DH5α和农杆菌EHA105购自天根公司;植物表达载体Pcambia1304为本实验室保存。
DNA Marker、Ex Taq II、pMD18-T购自TakaRa 公司,5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(X-Gluc)和茉莉酸甲酯(MeJA)为Sigma 公司产品,质粒提取试剂盒购自Omega Bio-Tek公司,其他化学药品为分析纯。
1.2 试验方法
1.2.1GUS融合瞬时表达载体的构建 选用Pcambia 1304植物表达载体构建试用于启动子瞬时表达的GUS表达基因融合载体,以NcoI和SpeI酶切pMD18- T/ MaPIP1-2重组质粒和Pcambia 1304空载体,分别回收启动子片段和线性载体,连接,转化DH5α后进行菌液PCR及酶切检测,重组质粒命名为MaPIP1-2::GUS。
1.2.2转化拟南芥及其筛选鉴定 将构建好的重组质粒MaPIP1-2::GUS转化到农杆菌菌株EHA105中,PCR鉴定后保存。将已转化有pCAMBIA1304-MaAQP1的农杆菌,加到含有Kan和Rif抗生素的LB培养基中,28℃振荡10 h,加入拟南芥转基因浸润液(1/2MS,50 g/L Sucrose)中,将拟南芥倒置浸染到菌液中,采用花序浸染法进行转化。将转化后的拟南芥于湿度较大的暗培养箱中培养24 h,后移至23℃、光照12 h条件下生长。待其收获种子后,将晾干的种子以75%乙醇+0.02% Triton X100溶液浸泡10 min,移除乙醇溶液,重复2~3次,将种子吹打到无菌滤纸上,风干;将晾干的种子撒播在选择培养基(1/2MS,1.5% Sucrose,0.7% Agra,25 μg/mL hygromycin B)上;4℃黑暗处理3 d后转移到培养房中,在23℃条件下生长,10 d后选择能正常生长的幼苗移栽到花钵中,筛选到T3纯合系后进行PCR检测,保存转基因拟南芥种子用于后续试验。
1.2.3非生物胁迫 将转基因拟南芥种子进行以下处理:(1)播撒在0、50、100、150 mmol/L NaCl 的MS培养基上进行高盐处理,15 d后观察形态及GUS测定。(2)播撒在0、100、200、300 mmol/L 甘露醇的MS培养基上进行模拟干旱处理,15 d后观察形态及GUS测定。
1.2.4组织化学染色与GUS蛋白定量分析 GUS蛋白的组织染色法参照 Jefferson 法(Jefferson,1987)。将胁迫处理后 的 葡 萄 叶片 放 置 于 GUS 染色〔10 mmol/L Na2EDTA,100 mmol/L NaH2PO4,0.5 mmol/L K4Fe(CN)6·3H2O,0.1% Triton X-100 和 0.5 mg/L X-Gluc〕中,在 37℃培养箱中培养 24 h 后使用 70%乙醇脱色。GUS蛋白荧光定量方法参照Jefferson法(Jdfferson,1988),GUS 活性定量结果通过每毫克蛋白每分钟产生 4-methylumbelliferon(4-MU)的量来确定。GUS活性测定试验3次重复。
2 结果与分析
2.1 GUS表达载体的构建
为了进一步研究MaPIP1-2启动子在不同非生物胁迫下的GUS表达活性,构建了MaPIP1-2::GUS融合表达载体。在上游引物AP1和下游引物SP3分别加入NcoI和SpeI内切酶,将pMD18- T/ MaPIP1-2和Pcambia 1304载体同时用NcoI和SpeI内切酶进行酶切后,回收目的片段后连接转化,PCR以及双酶切鉴定如图1所示,结果表明PCR产物和酶切条带均为841 bp。
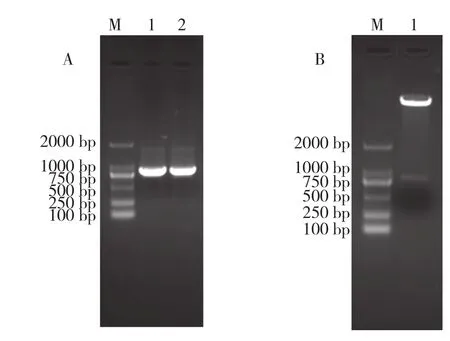
图1 MaPIP1-2启动子载体构建的PCR 及NcoI和SpeI双酶切鉴定结果
2.2 不同非生物胁迫对转基因拟南芥GUS表达的影响
将构建好的MaPIP1-2::GUS融合表达载体转化到农杆菌EHA105中,使用化学组织染色和GUS蛋白定量方法验证MaPIP1-2启动子对干旱和高盐胁迫的诱导响应。结果显示,随着盐浓度的增加,转基因株系的根系变短,且主根颜色加深(图2A);当甘露醇浓度为100 mmol/L时,其根部下端明显加深,而当浓度为200 mmol/L时,其除了根部下端加深外,靠近叶片下端也明显加深,当浓度增加为300 mmol/L时,该转基因植株根系明显缩短,且整个根系都加深(图2B)。可见,随着甘露醇浓度以及盐浓度的增加,转化MaPIP1-2启动子的拟南芥植株GUS染色加深,表达增强,说明其受到干旱和高盐胁迫的响应。
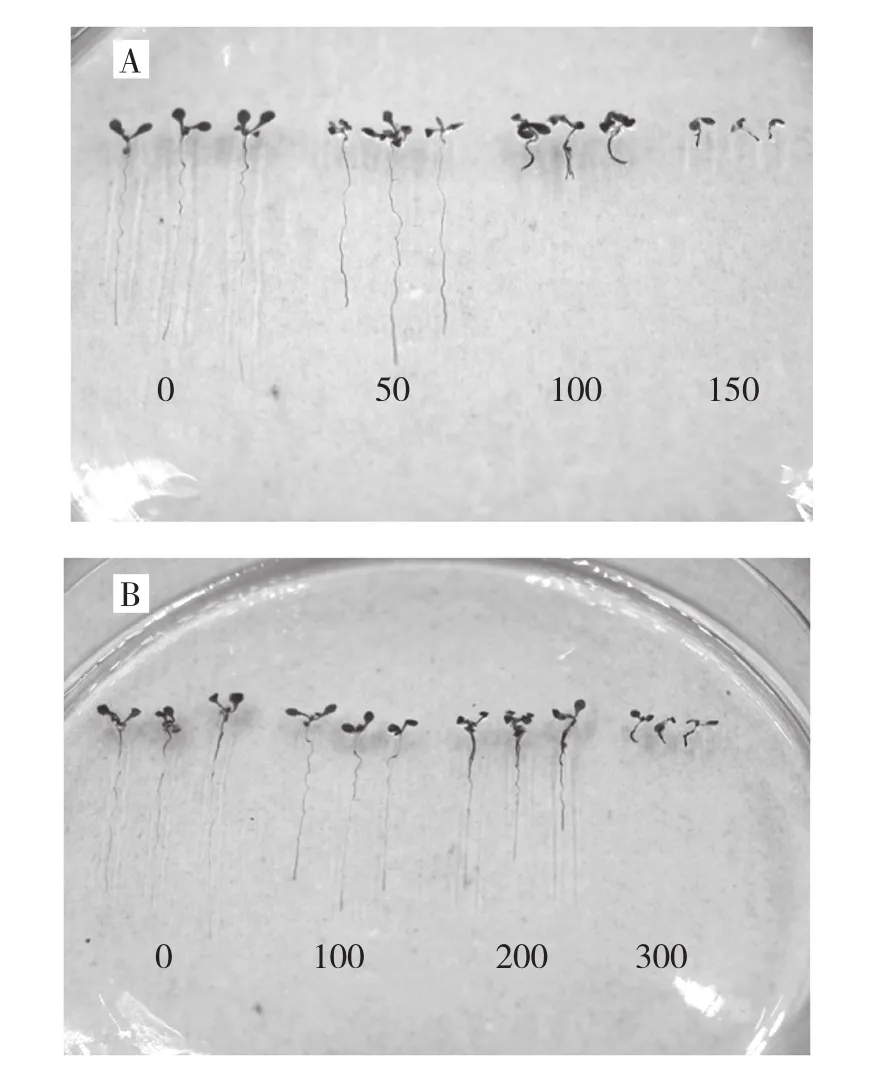
图2 干旱和盐胁迫对MaPIP1-2启动子活性的影响 (GUS染色测定)
2.3 不同非生物胁迫对MaPIP1-2启动子GUS酶活性的影响
利用 GUS 蛋白定量方法进一步分析启动子活性。结果(图3)显示,随着NaCl浓度的增加,MaPIP1-2启动子GUS活性也递增,当NaCl浓度为150 mmol/L时,其GUS酶活性为对照的1.85倍。经100 mmol/L甘露醇处理后,MaPIP1-2启动子的GUS活性约是对照的1.35倍,随着浓度增加,GUS活性递增,当甘露醇浓度达到300 mmol/L时,其GUS活性为对照的2.08倍。

图3 不同浓度NaCl和甘露醇处理下MaPIP1-2启动子GUS蛋白活性
3 结论与讨论
启动子是基因表达调控的关键顺式作用元件,也是基因工程表达载体的一个重要元件。对启动子结构和功能的阐释,有助于基因表达的时空控制。选择恰当方法克隆序列未知的启动子有着非常重要的意义和广阔的应用前景。
前期克隆得到水通道蛋白基因的启动子序列并初步分析其顺式作用元件,其中含有与非生物胁迫相关的如WUN-motif与伤害相关,TCA-element与盐胁迫相关,这些均与该基因在响应外界非生物胁迫的功能相对应。转录调控是基因表达阶段中最主要的调控方式,该过程是反式作用因子与靶基因上游相关顺式作用元件进行结合,从而调节基因表达[15]。近年来的研究表明,许多植物基因的表达都受逆境胁迫的诱导,抗逆基因的表达又是依靠其上游启动子的调控来实现的。启动子是起始基因转录的一段 DNA 序列,是基因表达调控的关键点[16]。在本研究中,通过用NaCl和甘露醇处理转化MaPIP1-2启动子的拟南芥植株,发现该植株随着处理浓度的增加,该启动子的GUS活性也增加,说明其受到NaCl和甘露醇的诱导,而在该启动子顺式作用元件中也找到与胁迫相关的元件。
水通道蛋白基因对于植物的水分平衡起着重要作用,而在干旱胁迫下该基因具有不同的表达模式[17]。在拟南芥中大部分的水通道蛋白基因受到干旱胁迫下调表达[18],而其中的AtPIP1;4 的表达却呈现上调趋势[19]。在葡萄中,水分胁迫导致葡萄根中VvPIP1;1的表达上调近3倍[20]。水通道蛋白表达的下调可能是减少植物自身水分散失和维持叶片膨压的一种方式,而该基因的上调可能会使外源的水分进入植物的器官或者细胞,避免外界干旱胁迫对植物造成的损伤[17,19]。本研究中MaPIP1-2在模拟干旱胁迫的甘露醇中表达上调,说明该基因在干旱胁迫下对保护植物自身避免损伤中发挥着一定作用。
本研究是在前期研究的基础上,为了进一步研究该启动子的功能,将该启动子构建植物表达载体,并用不同的胁迫处理研究该启动子的活性。研究结果将进一步对揭示MaPIP1-2启动子的启动机理和活性提供依据,后续工作将对该启动子的启动原理及与上游转录因子的相互结合作进一步深入研究。
[1] Van Asten P J A,Fermont A M,Taulya G.Drought is a major yield loss factor for rainfed East African highland banana[J].Agric Water Manage,2011,98:541-552.
[2] Kjelbom P,Larsson C,Johansson I,et al.Aquaporins and water homeostasis in plants[J].Trends Plant Sci,1999,4 (8):308-314.
[3] Horie T,Kaneko T,Sugimoto G,et al.Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots[J].Plant Cell Physiol,2011,52:663-675 .
[4] Kaldenhoff R,Fischer M.Aquaporins in plants[J].Acta Physiol,2006,187:169-176.
[5] Bienert G P,Schjoerring J K,Jahn T P.Membranetransport of hydrogen peroxide[J].Biochim Biophys Acta,2006,1758:994-1003.
[6] Alexandersson E,Fraysse L,Sjovall-Larsen S,et al.Whole gene family expression and drought stress regulation of aquaporins[J].Plant Molecular Biology,2005,59:469-484.
[7] Hose E,Steudle E,Hartung W.Abscisic acid and hydraulic conductivity of maize roots:a study using cell- and root-pressure probes[J].Planta,2000,211:874-882.
[8] Sade N,Gebretsadik M,Seligmann R,et al.The role of tobacco Aquaporin1 in improving water use efficiency,hydraulic conductivity,and yield production under salt stress[J].Plant Physiol,2010,152:245-254.
[9] Gao Z,He X,Zhao B,et al.Overexpressing a putative aquaporin gene from wheat,TaNIP,enhances salt tolerance in transgenic Arabidopsis[J].Plant Cell Physiol,2010,51:767-775.
[10] Hu W,Yuan Q,Wang Y,et al.Overexpression of a wheat aquaporin gene,TaAQP8,enhances salt stress tolerance in transgenic tobacco[J].Plant Cell Physiol,2012,53:2127-2141.
[11] Zhou S,Hu W,Deng X.Overexpression of the wheat aquaporin gene,TaAQP7,enhances drought tolerance in transgenic tobacco[J].PLoS One,2012,7(12):e52439.
[12] Xu CH,Wang M,Zhou L,et al.Heterologous Expression of the Wheat Aquaporin Gene TaTIP2;2 Compromises the Abiotic Stress Tolerance of Arabidopsis thaliana[J].PLoS One,2013,8(11):e79618.
[13] Ahmad P,Prasad M N V.Abiotic Stress Responses in Plants:Metabolism,Productivity and Sustainability[M].Springer New York Dordrecht Heidelberg London,2012:473.
[14] Ahmad P,Prasad M N V.Environmental Adaptations and Stress Tolerancein of Plants in the Era of Climate Change[M].Springer New York Dordrecht Heidelberg London,2012b:715.
[15] 和静,李瑞民,王跃进.野生毛葡萄芪合成酶基因双向启动子活性分析[J].果树学报,2016,33(2):137-147.
[16] 郭晋艳,郑晓瑜,邹翠霞,等.植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J].生物技术通报,2011(4):16-21.
[17] Alexandersson E,Danielson J A H,Rade J,et al.Transcriptional regulation of aquaporins in accessions of Arabidopsis in response to drought stress[J].The Plant Journal,2010,61:650-660.
[18] Jang J Y,Kim D G,Kim Y O,et al.An expression analysis of a gene family encoding plasma membrane aquaporins in response to abiotic stresses in Arabidopsis thaliana[J].Plant Molecular Biology,2004,54:713-725.
[19] Aroca R,Amodeo G,Ferna'ndez-Illescas S,et al.The role of aquaporins and membrane damage in chilling and hydrogen peroxide induced changes in the hydraulic conductance of maize roots[J].Plant Physiol,2005,137:341-353.
[20] Vandeleur R K,Mayo G,Shelden M C,et al.The role of plasma membrane intrinsic protein aquaporins in water transport through Roots:Diurnal and drought stress responses reveal different strategies between Isohydric and Anisohydric cultivars[J].Plant Physiology,2009,149:445-460.
(责任编辑 崔建勋)
Regulation of abiotic stress on aquaporin promoter activity
SONG Shun1,2,HUANG Dong-mei1,2,XU Bi-yu3,JIN Zhi-qiang1,2,SUN Wei1,2,XU Gui-ying1,2,LI Jing-yang1,2,XU Yi1,2,3
(1.Haikou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,Haikou 570102,China;
2.Hainan Key Laboratory of Banana Genetic Improvement,Haikou 570102,China;
3.Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture/Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,China)
A 841bp sequence of MaPIP1-2 promoter was isolated from banana (Musa acuminat L.AAA group cv.Brazilian) through chromosome walking PCR.PLACE analysis indicated that MaPIP1-2 promoter contatined abiotic stress-responsive elements,such as drought-responsive elements and salt-related cis-elements.To investigate the function of the promoter,the plant expression vector with MaPIP1-2 promoter was successfully constructed and transformed into Arabidopsis thaliana.In MaPIP1-2::GUS-expressing Arabidopsis,the activity of MaPIP1-2 promoter was found to be associated with the drought and salt treatment.The activity of MaPIP1-2 promoter was enhanced with the increasing concentration of salt and mannitol.
aquaporin;promoter;stress;GUS
Q784
A
1004-874X(2016)12-0001-05
10.16768/j.issn.1004-874X.2016.12.001
2016-09-20
国家自然科学基金(31501371)
宋顺(1984-),男,硕士,助理研究员,E-mail:sss1984006@163.com
许奕(1985-),女,硕士,助理研究员,E-mail:lukydog163@163.com
宋顺,黄东梅,徐碧玉,等.非生物胁迫对水通道蛋白启动子活性的调节作用[J].广东农业科学,2016,43(12):1-5.

