CD105在妊娠期高血压发病机制的研究进展
孙 毅
复旦大学附属妇产科医院(上海,200011)
·综述·
CD105在妊娠期高血压发病机制的研究进展
孙毅
复旦大学附属妇产科医院(上海,200011)
近年来妊娠期高血压发病率明显升高,且其发病机制仍未明确。目前许多学者认为妊娠早期子宫螺旋小动脉重铸障碍导致子宫胎盘血液循环缺氧,胎盘缺氧状态下滋养细胞受损,释放大量细胞因子入血,最终导致疾病发生是其发病机制的关键环节。许多研究证实CD105参与血管重铸及全身血管内皮功能调节,与妊娠期高血压疾病发生发展及严重程度密切相关,其血清学检测为预测子痫前期的发生风险及疾病预后提供有力证据,本文就近年来的相关研究进行综述。
1 妊娠期高血压
妊娠期高血压为妊娠期特有的疾病,子痫前期在妊娠期发病率为5~8%[1],可导致各个脏腑系统严重的不可逆损害,其发病机理仍未完全明确。目前认为妊娠早期子宫螺旋小动脉重铸障碍,胎盘浅着床导致胎盘在缺氧状态下滋养细胞受损,同时释放大量细胞因子入血是其发病机制的关键环节[2]。CD105又称Endoglin,人体CD105有两种存在方式:一种是作为细胞膜结合蛋白,主要表达在新生血管内皮细胞;一种是可溶性蛋白,主要存在外周血液循环系统,其中可溶性的CD105与子痫前期密切相关。CD105可影响滋养细胞向浸润表型分化,从而影响其侵蚀功能,导致胎盘浅着床;它还参与调节全身小血管收缩和舒张功能及子宫螺旋小动脉的重铸,在血管发生、发育、血管重塑、维持血管完整性方面发挥着重要作用[3]。
2 CD105对妊娠期血管的影响
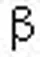
研究显示敲除体外培养滋养叶细胞和妊娠早期滋养叶细胞的CD105基因,可以明显提高滋养叶细胞的侵袭能力[11],在子痫前期患者中,CD105表达明显升高可抑制滋养细胞的侵袭能力,导致胎盘浅着床及螺旋小动脉的重铸,胎盘血流灌注明显减少。Akitoshi等[2]研究显示在氧浓度为2%时合体滋养细胞及血管内皮细胞即释放sEng入血。sEng亦可增加肺部和肝脏内微血管的通透性,产生肾小球动脉局灶的内皮增生,可能诱导产生体内调节性T细胞[12]。
3 CD105在妊娠期高血压分层管理中的作用
发生子痫前期及子痫风险评估、各脏器损害程度及预后,同时避免产生医源性早产尤为重要。 Tarek等[13]的研究,在妊娠13周时测得血压正常孕妇及发生子痫前期高危孕妇的sEng水平,妊娠26周再次测得,发现早发型子痫前期的孕妇sEng水平比晚发型孕妇明显升高,妊娠17~20周即开始升高,到33~36周测得急速升高,因此可能预测孕妇发生子痫前期的风险,而正常孕妇sEng水平在妊娠33周开始升高。Rana等[1]研究显示血清sEng和sFlt1水平升高,PlGF水平降低,是诊断、预测子痫发病风险,监测疾病严重程度和围产期预后的有力生物学标记物,为在疾病过程中实施正确的医疗干预提供了有力证据。但是由于研究的病例数量少,重症患者比重大,因此有30%患者被预测在2周内有发生子痫前期的风险,且研究中未考虑其它因素的影响,因此存在偏倚,还需更多前瞻性队列研究验证此结论的可靠及真实性。在此疾病的临床治疗过程中,最重要的是尽量延长孕周,减少早产率及新生儿并发症和母婴死亡率,减少医疗费用,提高安全性及有效性,因此发现明确的生物学标记物预测疾病的进展情况及严重程度势在必行。CD105可能会成为预测的生物学标记物,并且通过此思路找到更多的血管生成的标志物以提高诊断的灵敏度避免漏诊率;CD105也可能成为疾病严重程度的检测指标,对判断疾病预后将有重要的参考价值同时对于分娩方式的选择有指导意义:在子痫前期孕妇中胎盘长期处在慢性缺氧状态,自然分娩过程中子宫的强烈收缩导致子宫急性缺氧及过度的氧化应激,可能释放更多的sEng入血,诱发产后子痫的发生。
参考文献
[1]Rana S, Cerdeira AS, Wenger J, Salahuddin S, Lim K-H, et al. Plasma Concent- rations of Soluble Endoglin versus Standard Evaluation in Patients with Suspected Preeclampsia[J]. PLoS One,2012,7(10):e48259.
[2]Nakashima A1, Yamanaka-Tatematsu M, Fujita N et al. Impaired autophagy by soluble endoglin,under physic- ological hypoxia in early pregnant period, is involved in poor placentation in preecl- ampsia[J]. Autophagy,2013,9(3):303-316.
[3]Mano Y, Kotani T, Shibata Ket al.: The loss of endoglin promotes the invasion of extravillous trophoblasts[J]. Endocrinology,2011,152(11):4386-94.
[4]Bernabeu C, Conley BA, Vary CP. Novel biochemical pathways of endoglin in vascular cell physiology[J]. J Cell Biochem,2007,102(6):1375- 1388.
[5]Hawinkels LJ,Kuiper P,Wiercinska E et al.Matrix metalloproteiase-14(MT1- MMP)-mediated endoglin shedding inhibits tumor angiogenesis[J]. Cancer Res. 2010 May,15,70(10):4141-4150.
[6]Cudmore MJ, Ahmad S, Sissaoui S et al, Loss of Akt activity increases circulating soluble endoglin release in preeclampsia:identification of inter-dependency between Akt-1and heme oxygenase-1. European Heart Journal[J]. 2012,33(9):1150-1158.
[7]Topomian M,Gros R,Kabir MG et al. A role for endoglin in coupling e NOS activity and regulating vascular tone revealed in hereditary hemorrhagic telangie- etasia[J].Circ Res,2005,96(6): 684-692.
[8]Lee JE, Oh HA, Song H ,et al. Autophagy regulates embryonic survival during delayed implantation[J]. Endocrinology 2011; 152(5):2067-75.
[9]Akitoshi N, Mikiko YT, Naonobu F et al. Impaired autophagy by soluble endoglin, under physiological hypoxia in early pregnant period, is involved in poor placentation in preeclampsia[J]. Autophagy . 2013,9(3):303-316.
[10]Perucci LO, Gomes KB, Freitas LG et al. Soluble Endoglin,Transforming Growth Factor-Beta 1 and Soluble Tumor Necrosis Factor Alpha Receptors in Different Clinical Manifestations of Preeclampsia[J]. PLoS One. 2014 May 22;9(5):e97632.
[11]Mano Y, Kotani T, Shibata Ket al.:The loss of endoglin promotes the invasion of extravillous trophoblasts[J]. Endocrinology, 2011, 152(11):4386-4394.
[12]Bell et al. Variation in endoglin pathway genes is associated with preeclampsia: a case-control candidate gene association study[J]. BMC Pregnancy and Childbirth. 2013, 1(1)13:82-91.
[13]Tarek M E,Aml S E,Hala D. Maternal serum endoglin as an early marker of pre- eclampsia in high-risk patients[J]. International Journal of Women's Health. 2012,4: 521-525.
[责任编辑:王丽娜]
收稿日期:2015-01-29修回日期:2016-01-05
- 中国计划生育学杂志的其它文章
- 多环节干预减少重复剖宫产瘢痕妊娠

