紫花苜蓿根腐病原菌——拟枝孢镰刀菌的鉴定及其生物学特性研究
潘龙其,张丽,杨成德*,袁庆华,王瑜,苗丽宏
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业
可持续发展研究中心,甘肃 兰州730070;2.中国农业科学研北京畜牧兽医研究所,北京100193)
紫花苜蓿根腐病原菌——拟枝孢镰刀菌的鉴定及其生物学特性研究
潘龙其1,张丽1,杨成德1*,袁庆华2*,王瑜2,苗丽宏2
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业
可持续发展研究中心,甘肃 兰州730070;2.中国农业科学研北京畜牧兽医研究所,北京100193)
摘要:本文对从内蒙古赤峰巴雅尔草业基地紫花苜蓿根部分离到的菌株BYE27-2-5进行了致病性测定、形态学和rDNA-ITS序列分析鉴定及生物学特性测定。结果表明,该菌菌丝生长、产孢和孢子萌发的最适温度分别为25,30和28℃;pH值5.0~11.0均宜于菌丝生长,产孢最适pH 8.0,孢子萌发最适pH 7.0;光暗交替利于菌丝生长,光照利于产孢和孢子的萌发;孢子在相对湿度低于75%不萌发,高于95%萌发较快;葡萄糖蛋白胨培养基利于菌丝生长和孢子萌发,马铃薯蔗糖琼脂培养基利于产孢;碳源中葡萄糖利于菌丝生长和孢子萌发,蔗糖利于产孢;氮源中蛋白胨利于菌丝生长,酵母膏利于产孢和孢子萌发;菌丝致死温度为54℃(10 min),分生孢子的致死温度为48℃(10 min);根据其形态特征和rDNA-ITS序列分析结果,鉴定其为拟枝孢镰刀菌(Fusarium sporotrichioide)。
关键词:紫花苜蓿;拟枝孢镰刀菌;病原鉴定;生物学特性
Identification and biological characteristics ofFusariumsporotrichioideisolated fromMedicagosativaroot
PAN Long-Qi1, ZHANG Li1, YANG Cheng-De1*, YUAN Qing-Hua2*, WANG Yu2, MIAO Li-Hong2
1.CollegeofGrassland,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.SCenterforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.InstituteofAnimalSciencesofCAAS,Beijing100193,China
Abstract:The strain BYE27-2-5 isolated from alfalfa (Medicago sativa) with root rot in north China was comprehensively evaluated by analyses of its biological characteristics, morphology, and ITS sequence. The optimum temperatures for mycelium growth, sporulation, and spore germination were 25℃, 30℃, and 28℃, respectively. The strain was able to grow in a pH range of 5.0-11.0 and the optimal pH for sporulation and spore germination were 8.0 and 7.0, respectively. Alternative light conditions were optimal for mycelial growth whereas complete light conditions were optimal for sporulation and spore germination. Spores germinated most rapidly at 95% relative humidity or in water-drop conditions, and failed germinate at relative humidity levels below 75%. Dextrose peptone medium was the best medium for mycelial growth and spore germination and potato dextrose agar was the best medium for sporulation. The best carbon source for mycelial growth and spore germination was glucose and that for sporulation was sucrose. The best nitrogen source for mycelium growth was peptone and that for spore germination and sporulation was yeast extract. The lethal temperature for mycelia was 54℃ (10 min) and that for spores was 48℃ (10 min). Based on these biological characteristics and the results of an ITS sequence analysis, the isolate was identified as Fusarium sporotrichioide.
Key words:alfalfa; Fusarium sporotrichioide; pathogen identification; biological characteristics
苜蓿(Medicagosativa)是世界上最早栽培、分布面积最广的优质牧草,素有“牧草之王”的美誉,也是我国当前生态建设工程中应用最为广泛的草种[1]。与粮食、经济作物相比,有较强的耐盐碱性,是良好的水土保持植物[2]。苜蓿根腐病是一种主要发生在根部的世界性病害,尤其在美国、加拿大、阿根廷、澳大利亚、俄罗斯和日本等国家发生严重[3],我国自1991年发现该病以来,先后在新疆、甘肃、青海、四川[4-5]等地陆续报道,王雪薇等[6]、陈耀等[7]发现新疆苜蓿根腐病使苜蓿死亡率达60.08%~73.45%。据估计,全世界每年由该病造成20% 左右的产量损失,严重的甚至高达40%。一般来说,不同地区的根腐病症状因病原物的不同而异。总之,被侵染植株生长缓慢,枝条枯萎,叶片变黄,根部维管束呈深褐色,根茎和中部变空,大量侧根腐烂死亡,整株枯萎或整根腐烂则需几周至1个月以上[8]。国内外学者对于该病的病原进行了大量的研究,均认为该病病原较为复杂,但多与镰刀菌有关。尽管Robet F N发现细菌也可以造成根腐病,但真菌的侵染是导致该病的主要原因[9]。我国先后报道的病原达28种,其中镰刀菌13种,分别为尖孢镰刀菌(Fusariumoxysporum)、茄腐皮镰刀菌(F.solani)、燕麦镰刀菌(F.avenaceum)、锐顶镰刀菌(F.acuminatum)、接骨木镰刀菌(F.sambucinum)、三线镰刀菌(F.tricinctum)、半裸镰刀菌(F.semitectum)、木贼镰刀菌(F.equiseti)、串珠镰刀菌(F.moniliforme)、大刀镰刀菌(F.culmorum)、链状镰刀菌(F.fusarioides)和梨孢镰刀菌(F.poae)等。其他病原真菌12种,细菌2种,线虫1种[10]。此外,疫霉属(Phytophthora)、立枯丝核菌(Rhizoctonia)、根腐丝囊霉(Aphanomyces)、腐霉(Pythium)、壳多隔孢菌(Stagnosporameliloti)、壳满孢菌(Plenodomusmeliloti)、柱枝双孢霉(Cylindrocladiumcrotalariae)、柱胞菌(Cylindrocarponehrenbeigii)、皮伞菌(Marasmiusspp.)、核盘菌(Sclerotiniasp.)、黑粘座孢霉(Myrotheciumroridum)和多主瘤梗单胞霉(Phymatotrichumomnivorum)等也是引起苜蓿根腐病的主要真菌,也能导致苜蓿根腐病的发生[11]。目前,内蒙古地区苜蓿种植面积达80万hm2,占全国种植总面积的1/5,其也是我国苜蓿种子和苜蓿草产品的主产区之一。紫花苜蓿根腐病导致苜蓿固氮能力降低,利用年限和生长寿命缩短、苜蓿产量和品质下降、甚至引起苜蓿草地的提早衰败(2~3年内大面积死亡)和苜蓿加工利用价值的丧失[12]。近年来随着紫花苜蓿种植面积的增加和种植年限的延长,病害问题越发严重,已成为主要的制约因素之一。苜蓿根腐病的研究在苜蓿产业化开发和生态环境建设方面具有重大意义。因此,本试验在国内首次对内蒙赤峰巴雅尔草业基地紫花苜蓿根腐病菌——拟枝孢镰刀菌进行了系统研究,以期为苜蓿根腐病的诊断和防治提供依据。
1材料与方法
1.1 供试病原菌
供试病原菌为本实验室2013年从巴雅尔草业基地(内蒙古赤峰)紫花苜蓿(皇后)根腐病发病部位采用方中达[13]的组织分离法分离,再经过单孢分离[14]获得的单孢菌株。
1.2 症状描述
根据紫花苜蓿根腐病田间危害症状的特点进行描述、记载并拍照。
1.3 致病性测定
采用灌根法和米粒接种法接种。在室温条件下将1×106个/mL的孢子悬浮液浇灌于盆栽的中苜一号60 d幼苗根围,后覆无菌土5 mm,3次重复,以无菌水为对照;米粒接种法为将1×106个/mL的孢子悬浮液制成米粒接种体均匀的分散在幼苗根围(10粒/株),覆无菌土5 mm,3次重复,以无菌水制成的米粒接种体为对照。3 d后连续每天观察苜蓿的发病情况至形成典型症状,从发病部位再次分离病原菌。
1.4 病原菌鉴定
1.4.1形态特征观察将单孢菌株纯化后转接于马铃薯蔗糖琼脂(PSA)平板,25℃黑暗培养,观察菌落颜色、形状以及菌丝疏密程度。产孢后,在显微镜下观察大、小分生孢子和厚垣孢子的形态、拍照并测量孢子的大小(100个)。根据病原菌形态特征,结合Booth《镰刀菌属》[15]等相关资料进行形态学鉴定。
1.4.2病原菌rDNA-ITS序列分析采用镰刀菌属特异性引物Fu3(5′-CCGAGTTTACAACTCCCAAA-3′)和Fu4(5′-TCCTCCGCTTATTGATATGC-3′)[16]对病原菌rDNA的ITS片段按刘志恒等[17]的方法进行分析。
1.5 病原菌生物学特性测定
1.5.1不同条件对菌丝生长和产孢量的影响(1)温度对菌丝生长和产孢量的影响,菌株25℃黑暗培养5 d,用无菌打孔器在其菌落边缘打取直径0.5 cm的菌饼,接种于PSA平板中央,3次重复,分别置于0~45℃(间隔5℃)恒温箱黑暗培养,5 d后用十字交叉法测量菌落直径。7 d后每皿取4块直径1.0 cm的菌饼,用1 mL无菌水洗脱孢子,血球计数板计产孢量,3次重复。
(2)pH值对菌丝生长和产孢量的影响,用HCl(1 mol/L)和NaOH(1 mol/L)将PSA培养基pH分别调至2.0~12.0(间隔1.0),3次重复,25℃恒温箱黑暗培养;接种、菌丝生长和产孢量测量方法同1.5.1(1)。
(3)光照对菌丝生长和产孢量的影响,将直径0.5 cm的菌饼接种于PSA培养基平板中央,分别置于24 h/d光照、24 h/d黑暗和(12 h光照与12 h黑暗)/d光暗交替条件下25℃恒温培养,3次重复,其他方法同1.5.1(1)。
(4)培养基对菌丝生长和产孢量的影响,供试培养基有马铃薯葡萄糖琼脂培养基PDA、马铃薯蔗糖琼脂培养基PSA、水琼脂培养基WA、VBC、查贝克氏培养基CZ、蔗糖培养基PS、玉米粉培养基CMA、燕麦培养基OMA、V8碳酸钙琼脂培养基、葡萄糖蛋白胨、淀粉琼脂、Bilai’s、苜蓿煎汁、胡萝卜和真菌生理培养基。25℃恒温箱培养,3次重复;其他方法同1.5.1(1)。
(5)碳、氮源对菌丝生长和产孢量的影响,以真菌生理培养基为基础培养基,以KNO3为氮源,以葡萄糖、果糖、半乳糖、麦芽糖、蔗糖、甘露醇和淀粉作为碳源,以无碳源培养基为对照;以葡萄糖为碳源,以KNO3、(NH4)2SO4、NH4Cl、尿素、蛋白胨、牛肉膏和酵母膏作为氮源,以无氮源培养基为对照。25℃恒温箱培养,3次重复;其他方法同1.5.1(1)。
(6)菌丝致死温度测定,将直径0.5 cm的菌饼置于装有5 mL无菌水的试管中,将试管置于40~70℃(间隔5℃)恒温水浴锅中处理10 min,测得致死温度范围,设置间隔1℃梯度,重复上述操作,确定致死温度,3次重复。
1.5.2不同条件对分生孢子萌发的影响(1)分生孢子萌发时间的测定,将分生孢子配制成浓度为10~20个孢子/视野(10×40倍)悬浮液,采用凹载片萌发法,25℃保湿培养,分别于4~24 h(间隔2 h)后检查300个孢子萌发情况,确定最佳萌发时间。
(2)温度对分生孢子萌发的影响,采用凹载片萌发法,将分生孢子悬浮液置于5~45℃(间隔5℃)不同温度保湿培养,5次重复,12 h(由预实验得)后测定孢子萌发率,每次随机测定300个孢子。
(3)pH对分生孢子萌发的影响,PSA培养液和孢子悬浮液等体积混合,用HCl(1 mol/L)和NaOH(1 mol/L)调节其pH至2.0~12.0(间隔1.0),25℃保湿培养,其他同1.5.2(2)。
(4)光照对分生孢子萌发的影响,将孢子悬浮液分别置于24 h/d光照、24 h/d黑暗和(12 h光照与12 h黑暗)/d光暗交替光照条件下25℃保湿培养,其他方法同1.5.2(2)。
(5)湿度对分生孢子萌发影响测定,将孢子悬浮液滴于凹载片上,风干后置于用不同盐类饱和溶液控制的湿度为65%,70%,75%,80%,85%,90%,95%,97%,100%以及水滴等不同湿度的密闭容器中。其他同方法1.5.2(2)。
(6)培养液对分生孢子萌发的影响,供试培养液有苜蓿煎汁、胡萝卜煎汁、PDA、PSA、VBC、CZ、PS、CMA、OMA、葡萄糖蛋白胨、淀粉琼脂、Bilai’s、V8和真菌生理培养液,无菌水孢子悬浮液为对照。将分生孢子悬浮液与上述14种培养液等体积混合,采用凹载片萌发法,25℃保湿培养8 h,其他方法同1.5.2(2)。
(7)碳、氮源对分生孢子萌发的影响,碳源培养液有葡萄糖、果糖、半乳糖、麦芽糖、蔗糖、甘露醇、淀粉和无碳源对照8种;氮源培养液有KNO3、(NH4)2SO4、NH4Cl、尿素、蛋白胨、牛肉膏、酵母膏和无氮源对照8种,培养液分别与分生孢子悬浮液等体积混合,采用凹载片萌发法,25℃保湿培养,其他方法同1.5.2(6)。
(8)分生孢子致死温度的测定,将装有5 mL孢子悬浮液的试管置于40~60℃(间隔5℃)恒温水浴锅中处理10 min,采用凹载片萌发法,25℃保湿培养,12 h后测定孢子萌发率,测得致死温度范围,设置间隔1℃梯度,重复上述操作,确定致死温度,5次重复。
1.6 统计分析方法
运用DPS 6.55对试验数据进行处理、分析。
2结果与分析
2.1 病害症状描述
紫花苜蓿根腐病在各调查区均有发生(发病率12%~42%)。轻病田,个别植株萎蔫枯死(图1a);重病田,全田枯死(图1b)。该病原菌主要侵染根部和根茎部,发病初期地上部分叶片发黄,个别枝条萎蔫枯死(图1c);根基部逐渐扩展成褐色腐烂,根部产生水渍状坏死斑,主根导管呈棕褐色(图1d);发病后期地上部分叶片变黄枯萎,全株枯死(图1e);整根全部腐烂(图1f)。

图1 紫花苜蓿根腐病田间自然发病症状Fig.1 Symptom of M. sativa root rot in field a:轻病田;b:重病田;c:发病初期地上部分;d:发病后期地上部分;e:发病初期根部;f:发病后期根部。a: Little infected field; b: Heavily infected field; c: Leaf of sick plant in early period; d: Leaf of sick plant in later period; e: Root of sick plant in early period; f: Root of sick plant in later period.
2.2 病原菌的分离与致病性测定
采用常规组织分离法,对多个发病植株根部进行分离、单孢纯化,得到的多个真菌单孢分离物,将培养性状、菌丝形态、孢子形态一致的分离物,合并编号为BYE27-2-5。
将分离物接种7~15 d后,中苜一号全部发病,对照均不发病。其中米粒接种体接种比分生孢子悬浮液灌根发病快5~8 d。米粒接种体接种的中苜一号发病后,植株萎蔫枯死(图2a),根部出现腐烂(图2c),发病症状与田间相似,对照不发病(图2b,d)。再次分离,从发病部位获得了与原接种分离物相同的病原菌。根据柯赫氏法则,菌株BYE27-2-5为紫花苜蓿根腐病的病原菌。

图2 接种与不接种BYE27-2-5紫花苜蓿根腐病症状Fig.2 Symptom of M. sativa root rot inoculated with BYE27-2-5 a:接种发病地上部分;b:CK;c:接种发病地下部分;d:CK。a:Leaf of inoculated plant; b:CK; c:Root of inoculated plant; d:CK.
2.3 病原菌的鉴定
2.3.1形态特征观察其在PSA培养基上生长较快,5 d可长满全皿,菌落圆形,边缘整齐,正面初为橙色,后渐变为白色,气生菌丝发达,呈絮状(图3a);背面初为粉红色,后渐变成红褐色(图3b);分生孢子大、小两型,小型分生孢子2~3 d可产生,无色单孢,0~1个分隔,卵形或棍棒形(图3c),大小1.57 μm×2.25 μm~4.75 μm×20.45 μm;大型分生孢子5~7 d产生,镰刀状(图3d),3~5个分隔,多为3个分隔,大小2.54 μm×5.27 μm~38.35 μm×53.55 μm;WA上培养10 d产生厚垣孢子,圆形或卵圆形串珠状(图3e);分生孢子梗无隔,细长或单瓶梗,产孢多为芽生殖(图3f)。
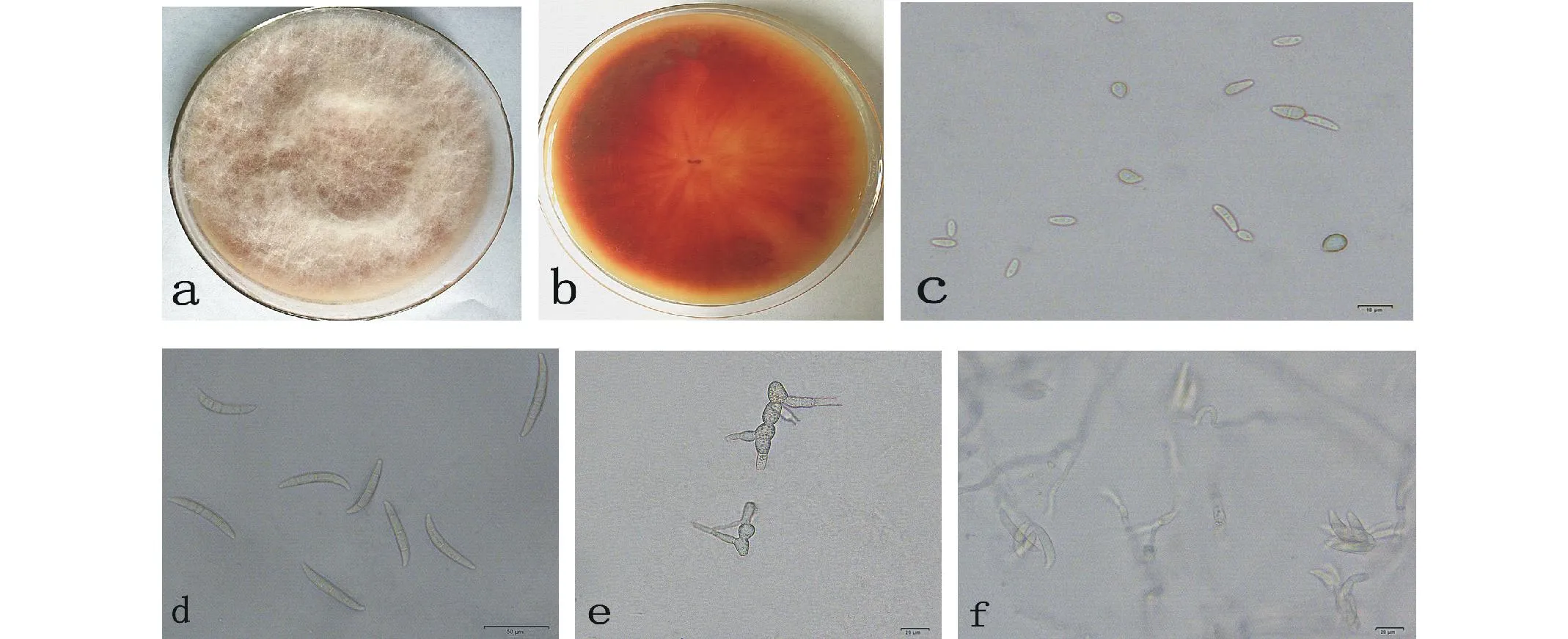
图3 病原物菌落、分生孢子和厚垣孢子形态Fig.3 The colony, conidium, chamydospore of isolated pathogen
a:菌落正面;b:菌落背面;c:小型分生孢子;d:大型分生孢子;e:厚垣孢子;f:产孢结构。a: Upper surface of the colony; b: Lower surface of the colony; c: Conidium; d: Macro conidia; e: Chlamydospore; f: Fruit structure.
根据病原菌的培养形状、两型分生孢子和厚垣孢子的形态特征,结合相关资料[18-20],初步确定BYE27-2-5为拟枝孢镰刀菌 (Fusariumsporotrichioides)。
2.3.2病原菌rDNA-ITS序列分析利用引物Fu3/Fu4对菌株进行PCR扩增,在约500 bp处有一特异性片段(图4)。将扩增产物测序,所测序列经BLAST对比分析,选取相似性较高的rDNA-ITS序列,并用ClustalX进行多重序列比较,再通过MEGA构建系统发育树,该病原菌与拟枝孢镰刀菌(KC254054)聚在一起(图5),结合形态学特征,确定该病原菌为拟枝孢镰刀菌。
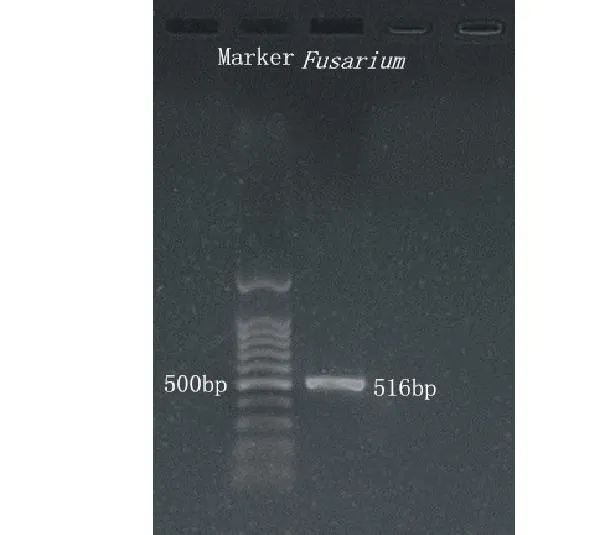
图4 rDNA-ITS序列的扩增Fig.4 PCR product of rDNA-ITS
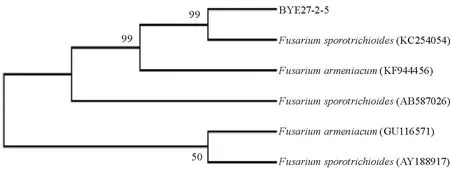
图5 病原菌的系统发育树Fig.5 Phylogenetic tree of BYE27-2-5
2.4 不同条件对病原菌菌丝生长及产孢的影响
2.4.1温度对菌丝生长及产孢的影响菌丝生长和产孢的温度范围均为5~35℃,菌丝生长最适温度为25℃,5 d菌落直径为7.44 cm,最适产孢温度为30℃,7 d产孢量为5.93×105个/mL,低于5℃或高于35℃菌丝不生长也不产孢(图6)。
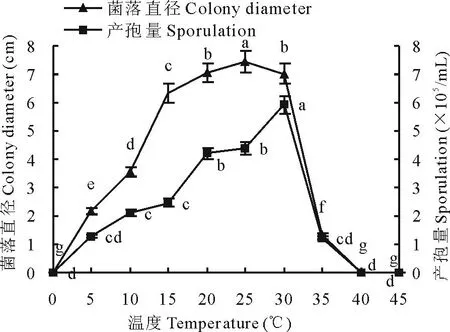
图6 温度对病原菌菌丝生长和产孢的影响Fig.6 Effects of temperature on mycelium growth and sporulation
2.4.2pH值对菌丝生长和产孢的影响菌丝生长的pH值范围为3.0~12.0,菌丝生长最适pH值为5.0~11.0,pH低于3.0菌丝停止生长。产孢量曲线呈单峰型,pH在3.0~8.0范围内,随着pH值增高产孢量逐渐增大,之后随着pH值增高产孢量逐渐减小,最适产孢pH值为8,7 d产孢量为7.60×105个/mL;pH低于3.0不产孢(图7)。
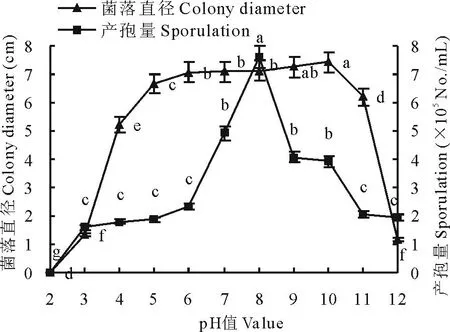
图7 pH值对病原菌菌丝生长和产孢的影响Fig.7 Effects of pH on mycelium growth and sporulation
不同小写字母表示在0.05水平上差异显著,下同。Different lowercase letters represented significant differences at 0.05 level. The same below.
2.4.3光照对菌丝生长和产孢的影响光照处理对菌株菌丝生长和产孢无显著影响。黑暗和光照下,菌丝的生长和产孢的差异不明显,但光暗交替更利于菌丝的生长,5 d菌落直径为7.15 cm,但不宜产孢(图8)。
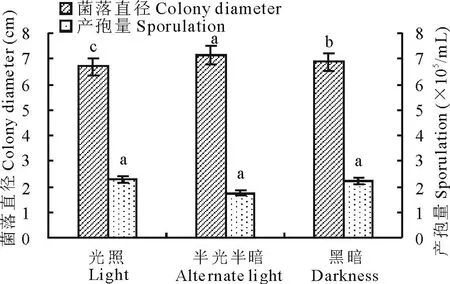
图8 光照对病原菌菌丝生长和产孢的影响Fig.8 Effects of illumination on mycelium growth and sporulation
2.4.4培养基对菌丝生长和产孢的影响病原菌菌丝在15种培养基上生长和产孢量差异显著,在葡萄糖蛋白胨培养基菌丝生长最快,5 d菌落直径为7.50 cm,其次为PDA和CZ,产孢量最大的是PSA,7 d产孢量为11.13×105个/mL,其次为马铃薯淀粉培养基(P<0.05);Bilai’s上菌丝生长最慢,5 d菌落直径为4.08 cm,PS不宜产孢(P<0.01)(表 1)。
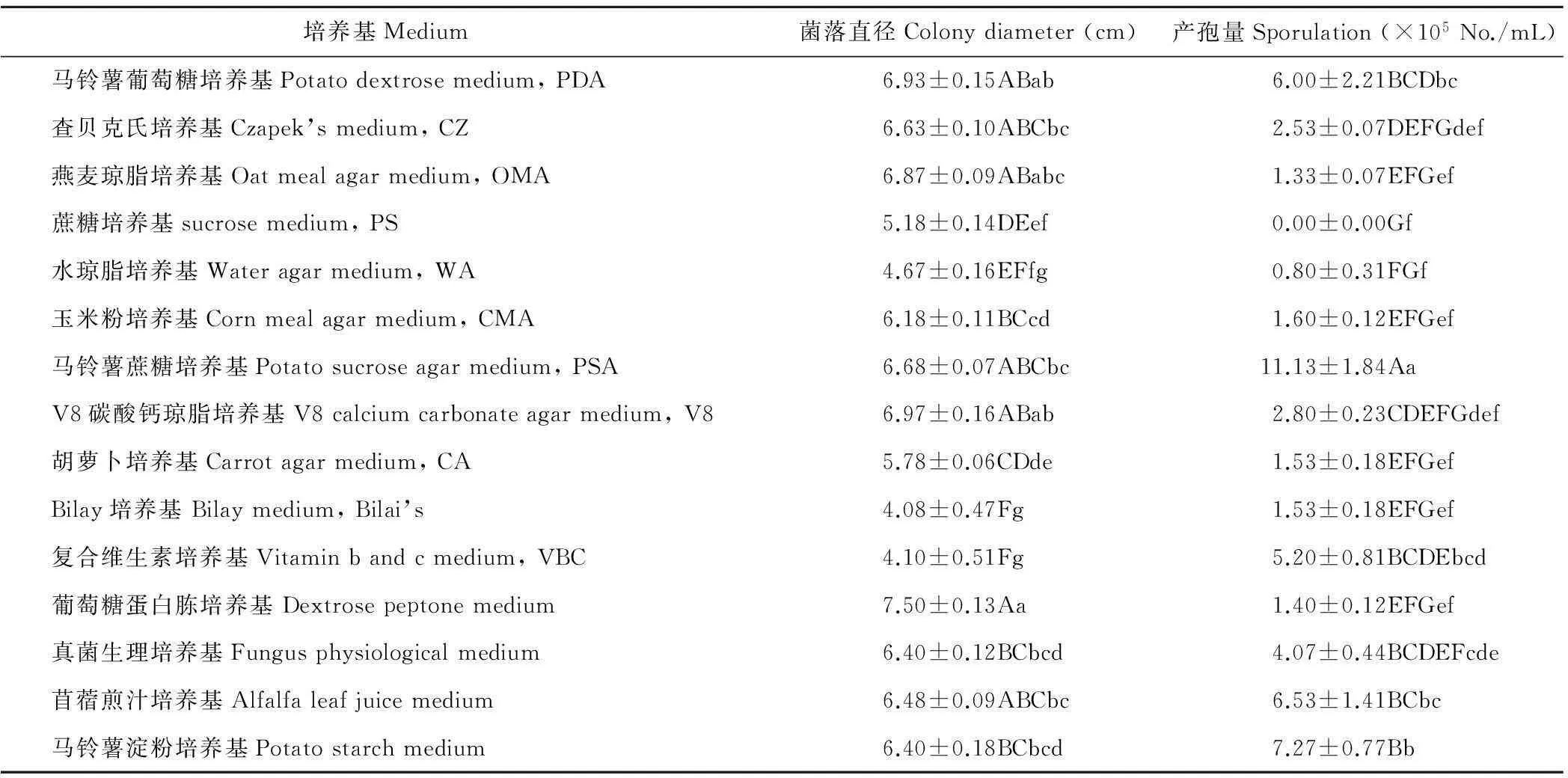
表1 培养基对病原菌菌丝生长和产孢的影响
注:大、小写字母分别表示同一列在0.01与0.05水平上差异显著,下同。
Note: Different capital and lowercase letters represented significant differences at 0.01 and 0.05 levels. The same below.
2.4.5碳源、氮源对菌丝生长和产孢的影响供试碳源以葡萄糖和可溶性淀粉较为适宜菌丝生长,蔗糖较适宜产孢(P<0.05);半乳糖和麦芽糖不利于菌丝生长,葡萄糖不利于产孢(P<0.01);供试氮源以蛋白胨较适宜菌丝生长,酵母膏和(NH4)2SO4较宜于产孢(P<0.05);KNO3不利于菌丝生长,牛肉膏不利于产孢(P<0.01)。该结果表明,碳源和氮源的有无对菌丝的生长和产孢差异极显著,各碳源间或氮源间有差异(表2)。
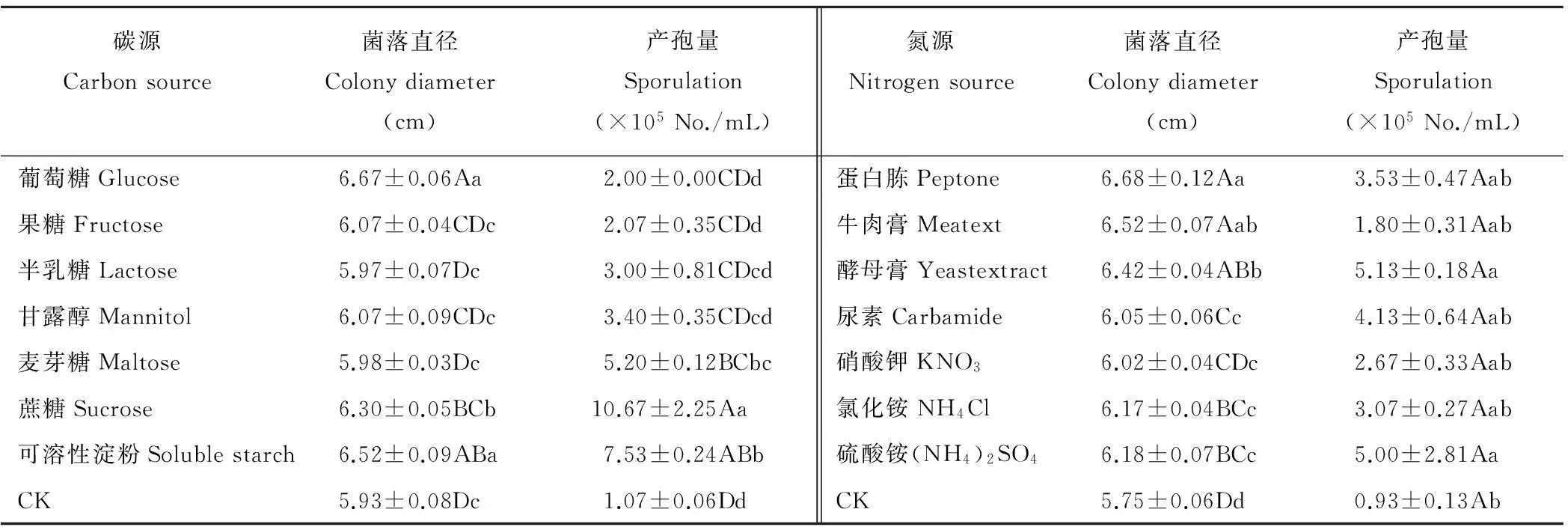
表2 碳源、氮源对病原菌菌丝生长和产孢的影响
2.4.6菌丝致死温度当处理温度≥54℃时,菌饼在培养基上不能生长,即病原菌菌丝致死温度是54℃,10 min(图9)。
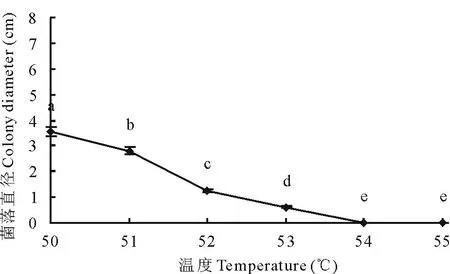
图9 菌丝致死温度Fig.9 Fatal temperature of mycelium
2.5 不同条件对分生孢子萌发的影响
2.5.1分生孢子萌发时间测定4 h后孢子开始萌发, 12 h后孢子萌发达到峰值并趋于稳定,以下孢子萌发试验均以此为基础(图10)。
2.5.2温度对分生孢子萌发的影响孢子萌发的温度范围为10~35℃,最适温度为28℃,12 h后孢子萌发率为93.80%,在5~28℃之间,孢子萌发率随着温度的升高而增高,在28~40℃之间,孢子萌发率随着温度的升高而降低(图11)。
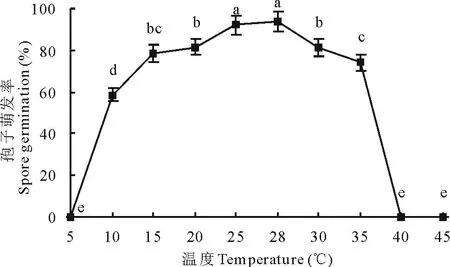
图11 温度对分生孢子萌发的影响Fig.11 Effects of temperature on spore germination
2.5.3pH对分生孢子萌发的影响在pH为3.0~12.0范围内孢子均可萌发,最适pH为7.0,12 h后孢子萌发率为92.56%,不同pH值对孢子萌发的影响差异显著(图12)。
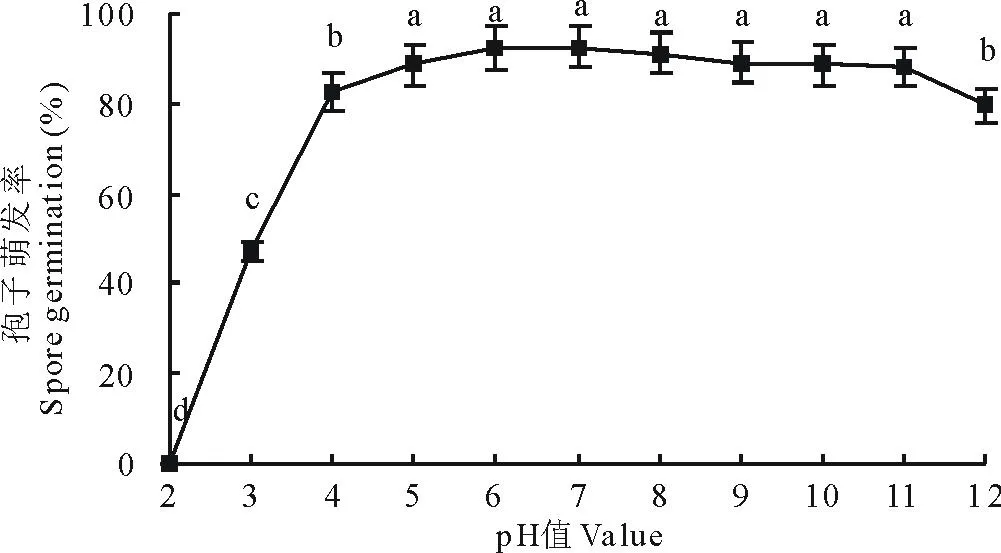
图12 pH值对分生孢子萌发的影响Fig.12 Effects of value on spore germination
2.5.4光照对分生孢子萌发的影响光照对孢子萌发的影响差异不明显,24 h全光照条件下,萌发率略高于其他两条件,孢子萌发率为93.08%,光照条件宜于孢子萌发(图13)。
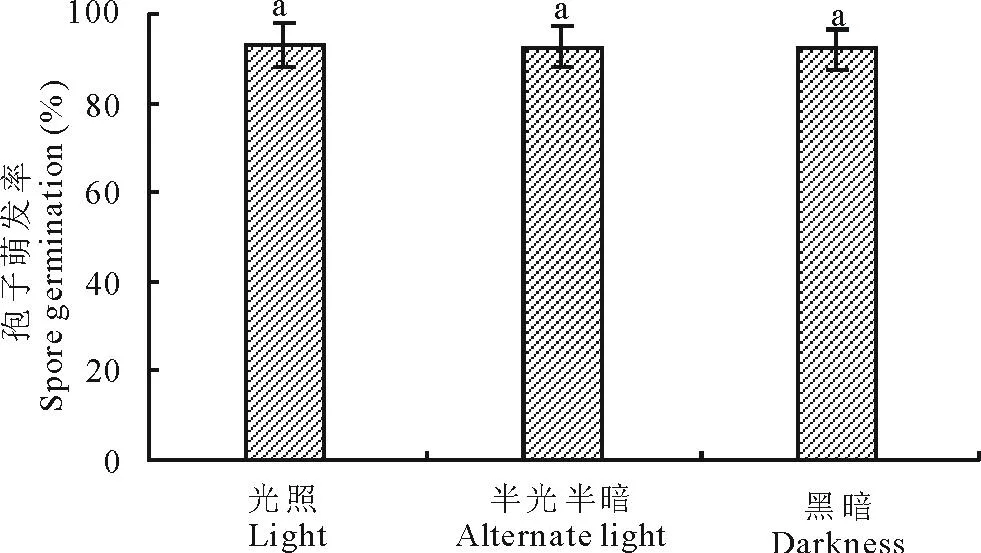
图13 光照对分生孢子萌发的影响Fig.13 Effects of illumination on spore germination
2.5.5湿度对分生孢子萌发的影响分生孢子在相对湿度65%~75%的条件下均不能萌发,在相对湿度为75%~100%的条件下,湿度越大萌发率越高,相对湿度100%条件下萌发率最高,孢子萌发率为93.82%(图14)。
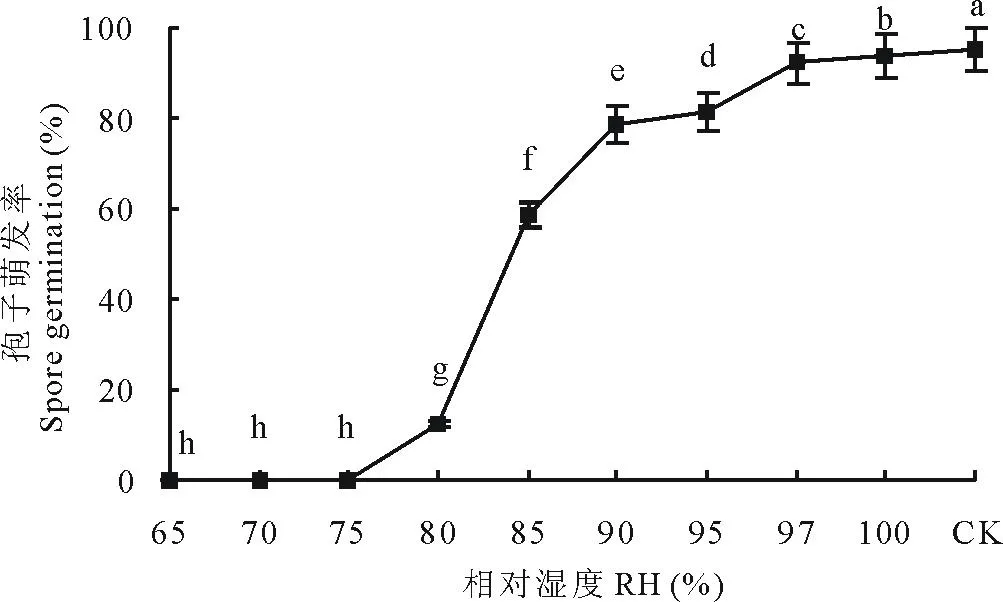
图14 湿度对分生孢子萌发的影响Fig.14 Effects of humidity on spore germination
2.5.6培养液对分生孢子萌发的影响14种不同培养液对分生孢子萌发都有一定的促进作用,其中葡萄糖蛋白胨培养液、CA、真菌生理培养液能有效地促进孢子萌发,葡萄糖蛋白胨培养液中孢子萌发率为93.99%,CK为75.76%(图15)。
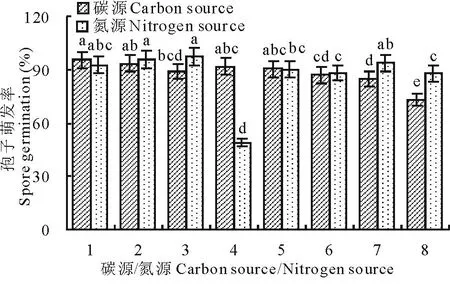
图15 培养基对分生孢子萌发的影响
1:PDA;2:葡萄糖蛋白胨培养液;3:CZ;4:OMA;5:PS;6:CMA;7:PSA;8:V8;9:CA;10:真菌生理培养液;11:苜蓿汁液培养液;12:马铃薯淀粉培养液;13:Bilai’s;14:VBC;15:CK。1: PDA; 2: Dextrose peptone medium; 3: CZ; 4: OMA; 5: PS; 6: CMA; 7: PSA; 8: V8; 9: CA; 10: Fungus physiological medium; 11: Alfalfa leaf juice medium; 12: Potato starch medium; 13: Bilai’s; 14: VBC; 15: CK.
2.5.7碳、氮源对分生孢子萌发的影响葡萄糖和果糖的效果最好,萌发率分别为95.35%和93.28%,淀粉的效果最差,萌发率为84.88%。除尿素外,其他氮源对孢子的萌发促进作用差异不显著,酵母膏和牛肉膏的效果最明显,萌发率分别为97.10%和95.56%,尿素对病原菌分生孢子的萌发有抑制作用,萌发率仅为49.09%(图16)。
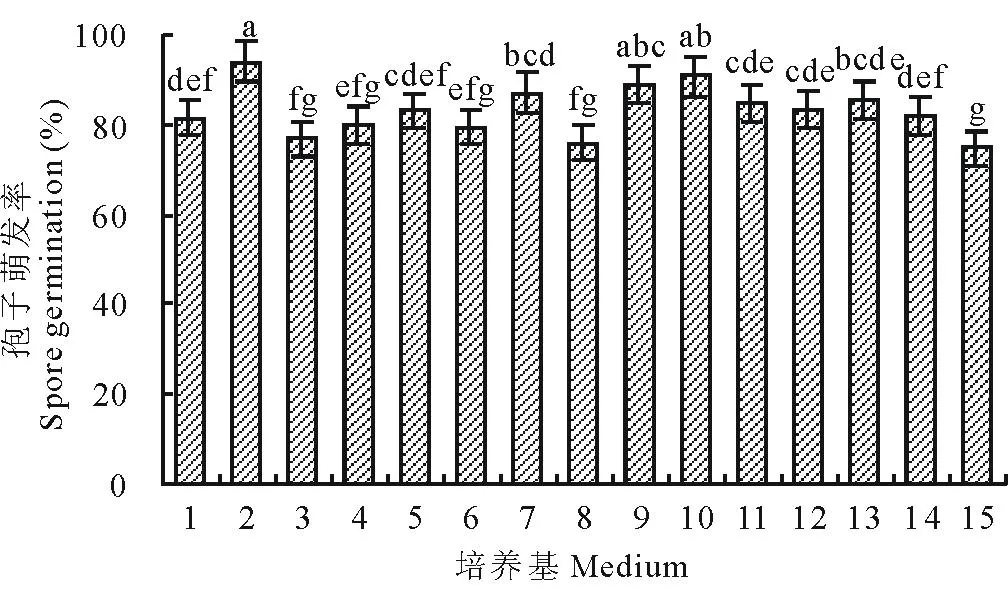
图16碳源/氮源对分生孢子萌发的影响
Fig.16Effects of carbon source/nitrogen source
on spore germination
1:葡萄糖/蛋白胨;2:果糖/牛肉膏;3:半乳糖/酵母膏;4:甘露醇/尿素;5:麦芽糖/KNO3;6:蔗糖/NH4Cl;7:淀粉/硫酸铵;8:CK(碳源)/CK(氮源)。1:Glucose/peptone; 2:Fructose/meatext;3:Lactose/yeast extract;4:Mannitol/carbamide; 5:Maltose/KNO3; 6:Sucrose/NH4Cl; 7:Soluble starch/(NH4)2SO4; 8:CK(carbon)/CK(nitrogen).
2.5.8分生孢子致死温度的测定当处理温度≥48℃时,该菌分生孢子不能萌发,即病原菌分生孢子致死温度是48℃,10 min(图17)。
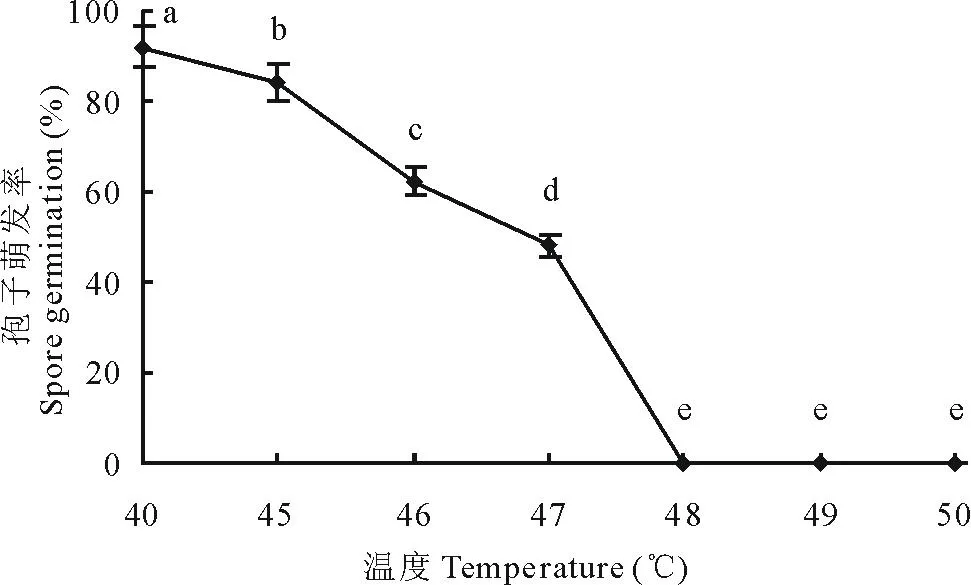
图17 分生孢子致死温度Fig.17 Fatal temperature of spore
3结论与讨论
至今,引起苜蓿根腐病的病原菌各说不一,究其原因,一是苜蓿根腐病的病原因不同生态条件的调查采样而异,但大多数与镰刀菌有关,国内外报道的镰刀菌病原总计13种之多[11];二是病原的侵染具有复杂性,由镰刀菌一个种或多个种混合侵染造成[21]。虽然对不同分离物复合接菌有共同的认知,但系统的研究鲜有报道,侧面说明多病原菌的复合侵染引发苜蓿根腐病的研究有待进一步深入。
本研究结合形态学鉴定和rDNA-ITS序列分析,鉴定内蒙古赤峰巴雅尔草业基地的紫花苜蓿根腐病的致病菌为拟枝孢镰刀菌,从该菌生长的pH范围和温度范围看出,该菌是一种具较强适应性、耐热性的强抗逆性致病菌,能够利用多种培养基、碳氮源进行生长和繁殖,加之孢子萌发快等特点,该致病菌对苜蓿的危害性更大[22];从致病性测定中人工接种拟枝孢镰刀菌的中苜一号紫花苜蓿发病率(5 d)和死亡率(10 d)分别为96.3%和97.5%,可见其具有较强的致病性;另外苜蓿根腐病是土传病害,根部发病造成大量植株迅速枯死。综上,安全高效的预防措施今后也需进一步加强研究。
本文所研究的拟枝孢镰刀菌系内蒙古自治区苜蓿种植区首次报道该种可以侵染苜蓿,并在国内首次详细研究该病原菌的生物学特性。本研究明确了拟枝孢镰刀菌引起的苜蓿根病的症状及其生物学特性,为生产中诊断和防治苜蓿根腐病提供了理论依据,但有关品种抗病性鉴定及大田防治方法等还需进一步研究。
References:
[1]Nan L L, Shi S L, Zhang J H. Study on root system development ability of different root-type alfalfa. Acta Prataculturae Sinica, 2014, 23(2): 117-124.
[2]Tian C X, Zhang Y M, Wang K,etal. The anatomical structure responses in alfalfa tosalinity-alkalinity stress of NaHCO3. Acta Prataculturae Sinica, 2014, 23(5): 133-142.
[3]Huang N, Lu X S. Research and resistance evaluation progress on alfalfa leaf and root diseases.Chinese Agricultural Science Bulletin, 2012,28(5):1-7.
[4]Liu H B, Yu Y X. Research progress in root rot of alfalfa. Grassland and Turf (Bimonthly), 2006, 3: 3-13.
[5]Zhang F C. The control measure of alfalfa common diseases and insect pests. Journal of Sichuan Grassland,1994, (1): 59-64.
[6]Wang X W, Wang C L, Zhou G,etal. Investigation and analysis on lucerne diseases from altay newly-established areas in Northern Xinjiang. Journal of Xinjiang Agricultural University,1996, 19(3): 40-44.
[7]Chen Y, He J C, Xiao F,etal. The preliminary study on root rot diseases of alfalfa in Xinjiang uygur autonomous region.Grassland of China, 1989, (2): 71-73.
[8]Hu Q Q. The occurring status and control measure of alfalfa root rot. Inner Mongolia Prataculture, 2009,21(1):37-40.
[9]Cao L X, Zhao C H, Kong Q Q,etal. Research progress of control and pathogen in alfalfa root rot. Inner Mongolia Agricultural Science And Technology, 2006, (3):36-37.
[10]Li M Q, Chai Z X, Li J H,etal. Identification pathogens of crown and root rot of alfalfa in Dingxi region. Acta Agrestia Sinica, 2003, 11(1):83-86.
[11]Chen Y J, Liu X M, Cui G W,etal. Research progress in root rot of alfalfa.Acta Agrestia Sinica, 2000, (1):51-56.
[12]Liang Q W, Sun D X, Wu Y H,etal. The problems and suggestion of alfalfa in Chifeng. Feed Research, 2014, 3: 68-70.
[13]Fang Z D. The Method on Studies of Plant Pathology[M]. Beijing:Chinese Agricultural Press, 1998: 124.
[14]Qiu X Y, Tang Z P, Zhang M,etal. Research on the isolation method of single spore of most plant pathogenic fungi. Journal of Anhui Agriculture Science, 2011, 39(9): 5263-5264.
[15]Booth C. The GenusFusarium[M]. Chen Q Y. Beijing: Agricultural Press, 1988: 103.
[16]Zhang Y, Zheng J Q, Xie B Y,etal. Identification on pathogen of cabbagewilt disease. Acta Phytopathologica Sinica, 2008, 38(4): 337-345.
[17]Liu Z H, Zheng C, Huang X Y,etal. Pathogen identification and biological characteristics of eggplant leaf mold. Plant Protection, 2013, 43(3): 58-69.
[18]Wang G C, Zheng Z, Ye Q M,etal. Guide to the Identification of Common Fusarium[M]. Beijing: Chinese Agricultural Sciences and Technology Press, 1996: 36-37.
[19]Xiao J W, Ran J X, Yang Z C,etal. Identification ofFusariumisolates from America soybean. Plant Quarantine, 2011, (1): 29-32.
[20]Du B, Yang S C, Liu C Q,etal. The pathogen of erigeron breviscapus root rot in Yunnan.Scientia Agricultura Sinica, 2007, 40(8): 1830-1834.
[21]Wang D C, Meng Y R, Li W M,etal. Isolation and identification of the pathogens causing root rot disease ofMedicagosativa. Pratacultural Science, 2005, 22(10): 78-81.
[22]Li W C, Li W M, Meng Y R. Biological characteristics of dry root rot (Fusariumsolani) ofMedicagosativa. Acta Prataculturae Sinica, 2005, 14(4): 106-111.
参考文献:
[1]南丽丽, 师尚礼, 张建华. 不同根型苜蓿根系发育能力研究. 草业学报, 2014, 23(2): 117-124.
[2]田成霞, 张咏梅, 王凯, 等. 紫花苜蓿组织解剖结构对NaHCO3盐碱胁迫的响应. 草业学报, 2014, 23(5): 133-142.
[3]黄宁, 卢欣石. 苜蓿叶部与根部病害研究的评价进展.中国农学通报, 2012, 28(5):1-7.
[4]刘海波, 玉永雄. 紫花苜蓿根腐病研究进展. 草原与草坪, 2006, 3: 3-13.
[5]张富川. 苜蓿常见病虫害的防治措施. 四川草原, 1994, (1): 59-64.
[6]王雪薇, 王纯利, 周刚, 等. 新疆阿勒泰新垦区苜蓿病害调查与分析. 新疆农业大学学报, 1996,19(3): 40-44.
[7]陈耀, 阂继淳, 肖凤, 等. 新疆苜蓿根腐病研究初报. 中国草地, 1989, (2): 71-73.
[8]胡清泉. 紫花苜蓿根腐病的发生现状与防治措施. 内蒙古草业, 2009,21(1):37-40.
[9]曹丽霞, 赵存虎, 孔庆全, 等. 紫花苜蓿根腐病病原及防治研究进展. 内蒙古农业科技, 2006, (3):36-37.
[10]李敏权, 柴兆祥, 李金花, 等. 定西地区苜蓿根和根颈腐烂病的研究. 草地学报, 2003, 11(1): 83-86.
[11]陈雅君, 刘学敏, 崔国文, 等. 紫花苜蓿根腐病的研究进展. 中国草地, 2000, (1): 51-56.
[12]梁庆伟, 孙德欣, 乌艳红, 等. 赤峰市苜蓿种植存在的问题与建议. 饲料研究, 2014, 3: 68-70.
[13]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998:124.
[14]邱小燕, 汤志鹏, 张敏, 等. 一种适用于多数植物病原真菌的单孢分离方法. 安徽农业科学, 2011, 39(9): 5263-5264.
[15]布斯.镰刀菌属[M]. 陈其瑛. 北京: 农业出版社, 1988:103.
[16]张扬, 郑建秋, 谢炳炎, 等. 甘蓝枯萎病病原菌的鉴定. 植物病理学报, 2008, 38(4): 337-345.
[17]刘志恒, 郑川, 黄欣阳, 等. 茄子绒菌病斑病原菌鉴定及生物学特性研究. 植物保护, 2013, 43(3): 58-69.
[18]王拱辰, 郑重, 叶琪明, 等. 常见镰刀菌鉴定指南[M]. 北京:中国农业技术出版社, 1996: 36-37.
[19]肖杰文, 冉俊祥, 杨占成, 等. 美国大豆中镰刀菌的分离鉴定. 植物检疫, 2011, (1): 29-32.
[20]杜宾, 杨生超, 刘翠琼, 等. 云南灯盏花根腐病病原菌初步鉴定. 中国农业科学, 2007, 40(8): 1830-1834.
[21]王多成, 孟有儒, 李文明, 等. 苜蓿根腐病病原菌的分离及鉴定. 草业科学, 2005, 22(10):78-81.
[22]李万苍, 李文明, 孟有儒. 苜蓿根腐病菌(Fusariumsolani)生物学特性研究. 草业学报, 2005, 14(4):106-111.
欢迎订阅2016年《中国草地学报》
《中国草地学报》是由中国农业科学院草原研究所和中国草学会共同主办的国家级草学学术期刊,其宗旨是:立足全国,面向世界,积极宣传和报道中国草学研究领域的新理论与重要成果,介绍新进展与发展动态,内容以草学基础理论研究和应用理论研究为主,兼纳高新技术研究和直接产生生态效益、经济效益的开发性研究,主要包括草原学、牧草学、草地学和草坪学等学科领域内有关草地与牧草资源、草地经营管理与改良利用、牧草遗传育种与引种栽培、牧草生理生化、草地建设与生态保护、草地生产与饲草料加工调制、草坪绿地、草业经济与可持续发展战略等。栏目主要有“专题报告”、“研究报告”、 “综述与专论”、“研究简报”等。读者对象为从事草业科研、教学、生产和管理的专家、学者、院校师生、领导及业内中高级科技人员,也适合农学、畜牧学、林学、环境科学、地理科学等相关领域的科技人员阅读参考。
本刊为中国草业领域创办最早的科技期刊,自1979年创刊以来先后荣获内蒙古优秀期刊或优秀科技期刊奖3次,获全国优秀农业期刊奖3次,获中国农业科学院优秀科技期刊奖和华北地区优秀期刊奖各1次,获《CAJ-CD规范》执行优秀奖1次。现为中国草学界影响较大的期刊之一,是全国中文核心期刊、中国科技核心期刊、中国农业核心期刊、RCCSE中国核心学术期刊、中国科学引文数据库来源期刊和全国优秀农业期刊,并被《中国核心期刊(遴选)数据库》、《万方数据-数字化期刊群》、《中文电子期刊资料服务库》、《中国科技论文与引文数据库》、《中国学术期刊综合评价数据库》、《中国期刊全文数据库》、《中国学术期刊(光盘版)》、《中国期刊网》、《中国知网》、《中国生物学文献数据库》和《中国生物学文摘》等多种数据库及二次文献收录。2008年影响因子已达1.000以上,在2011年公布的1998种中国科技核心期刊中综合排名为370位,其中影响因子排第94位; 2013年在中国科技期刊CSCD影响因子300名排行表中位居第100位。双月刊,大16开A4版本,120页,国内外公开发行,每册定价15.00元,全年共90.00元。国内统一刊号CN15-1344/S,国内邮发代号16-32,全国各地邮局(所)均可订阅,错过订期可直接向本刊编辑部补订。
地址:呼和浩特市乌兰察布东街120号;邮编:010010;电子信箱:zgcdxb@126.com;
电话:0471-4928361(办公室)0471-4926880(总编室)
http://cyxb.lzu.edu.cn
潘龙其,张丽,杨成德,袁庆华,王瑜,苗丽宏. 紫花苜蓿根腐病原菌——拟枝孢镰刀菌的鉴定及其生物学特性研究. 草业学报, 2015, 24(10): 88-98.
PAN Long-Qi, ZHANG Li, YANG Cheng-De, YUAN Qing-Hua, WANG Yu, MIAO Li-Hong. Identification and biological characteristics ofFusariumsporotrichioideisolated fromMedicagosativaroot. Acta Prataculturae Sinica, 2015, 24(10): 88-98.
通讯作者*Corresponding author. E-mail:yangcd@gsau.edu.cn, yuanqinghua@iascaas.net.cn
作者简介:潘龙其(1988-),男,甘肃天水人,在读硕士。E-mail:gsaupanlongqi@126.com
基金项目:公益性行业(农业)科研专项项目(201303057)和国家科技支撑项目“优质多抗牧草新品种选育与良种繁育关键技术研究与示范”(2011BAN17B01)资助。
收稿日期:2014-11-13;改回日期:2015-01-14
DOI:10.11686/cyxb2014466

