铜催化苄醇类化合物的氨氧化反应
铜催化苄醇类化合物的氨氧化反应
陈书斌,孙健,徐帆,李景华
(浙江工业大学 药学院,浙江 杭州 310014)
摘要:研究了一种直接以醇类和氨水为起始原料,无有机配体参与的铜催化氨氧化法合成芳香氰基化合物的方法,反应条件温和.反应以Cu(OH)2/TEMPO/O2为催化体系模型,在室温下通过对苄醇类化合物在一个大气压的氧气氛围中催化合成芳香腈.反应的催化体系得到了改进,综合考察了反应进行的最佳温度、时间、催化剂用量及溶剂的选择.在优化的条件下,反应的转化率和选择性结果良好,可达到90%以上,收率可观,对苄醇类底物的适用性广泛.
关键词:氨氧化;苄醇;芳香腈;Cu(OH)2;TEMPO
收稿日期:2015-01-19
作者简介:陈书斌(1991—),男,浙江温州人,硕士研究生,主要从事医药中间体的合成研究,E-mail:bingohaha@126.com.通信作者:李景华研究员,E-mail:lijh@zjut.edu.cn.
中图分类号:O625.67
文献标志码:A
文章编号:1006-4303(2015)05-0578-04
Abstract:A mild, organic ligand free, catalytic process for synthesizing aromatic nitriles directly from aromatic carbinols and aqueous ammonia as starting materials has been developed. Aromatic nitriles are synthesized from aromatic carbinols with molecular oxygen under ambient pressure at room temperature using Cu(OH)2/TEMPO/O2 as a catalytic system. The catalytic system has been improved. And the choice of the best reaction temperature, time, amount of catalyst and solvent are all comprehensively investigated. The conversion rate and selectivity of the reaction turn out to be over 90% under the optimized conditions, and the yields are excellent. The substrate scope is broad including all kinds of aromatic carbinols.
Keywords:ammoxidation; aromatic carbinols; aromatic nitriles; copper salt; TEMPO
Copper-catalyzed ammoxidation of aromatic carbinols
CHEN Shubin, SUN Jian, XU Fan, LI Jinghua
(College of Pharmaceutical Sciences, Zhejiang University of Technology, Hangzhou 310014, China)
氰基化合物广泛应用于制药,精细化工,材料化学,合成化学,农业等各领域.一般合成氰基化合物的方法有:无机氰基化合物的亲核取代反应法[1]、酰胺或者醛肟的脱水反应[2]以及伯胺的氧化[3].但上述传统方法有诸如使用昂贵试剂或剧毒无机氰化物,需苛刻反应条件等缺陷.从绿色合成角度而言均非理想的合成方法,故绿色法合成氰基化合物日益受到化学家的关注.
2011年,Hoover等采用了Cu/TEMPO/NMI/2,2-联吡啶(以下简称bpy)体系在室温下催化氧化醇生成醛[4].Capdevielle等于1989年报道了苄醇类衍生物可以和氯化铵在1.5~2.0当量的铜粉哌啶分散体系催化下得到高产率的芳香腈类化合物[5].而Yin等综合前人工作,于2013年报道了用CuI/bpy/TEMPO/O2催化体系55 ℃下在氨水中把苄醇类衍生物转化为腈类化合物[6].此反应的反应机理为醇在整体的催化体系中先转化为醛,再在氨水的存在下,进一步催化转化为目标产物腈类.综合上述报道,我们拟利用铜盐/TEMPO/O2为催化体系模型,探索更为简便环保的合成方法.虽然前人的工作均在一定程度上优化了反应条件,但不可避免地都存在一些弊端.如大多使用了有机配体bpy.相较于前人的方法,本实验方法无需有机配体,反应温度室温即可,条件温和,更为简便绿色,更有利于工业化的应用.
1实验部分
1.1主要仪器与试剂
主要仪器:德国Büchi B-540型数字显示显微熔点测定仪;核磁共振仪为Bruker Model Avance Ⅲ(500 MHz)核磁共振仪(TMS作内标,CDCl3作溶剂);气相色谱仪为天美7890II型气相色谱仪,检测器为氢离子火焰检测器,毛细管柱为SE-54型30 m×0.32 mm×0.25 μm;柱色谱为柱层析硅胶(用200~300目硅胶,青岛海洋化工),所有反应均在常规玻璃反应仪器中进行,由磁力搅拌.
主要试剂:购买的分析纯各类催化剂、氨水、TEMPO、有机溶剂等常规试剂,以及购买的化学纯各类苄醇类衍生物底物.
1.2实验过程
我们选择了苯甲醇作为反应的模型底物,以Cu(OH)2/TEMPO/O2作为苄醇氨氧化为腈的反应催化体系,结果能够良好的催化氨氧化得到氰基化合物.为了探究氨氧化具有更好催化活性的催化剂,并在保证反应产率和选择性的同时降低催化量,我们进而对反应的条件进行优化,得到最佳催化剂和最优反应条件.
带有取代基的芳香腈(Ⅱ)的合成路线为
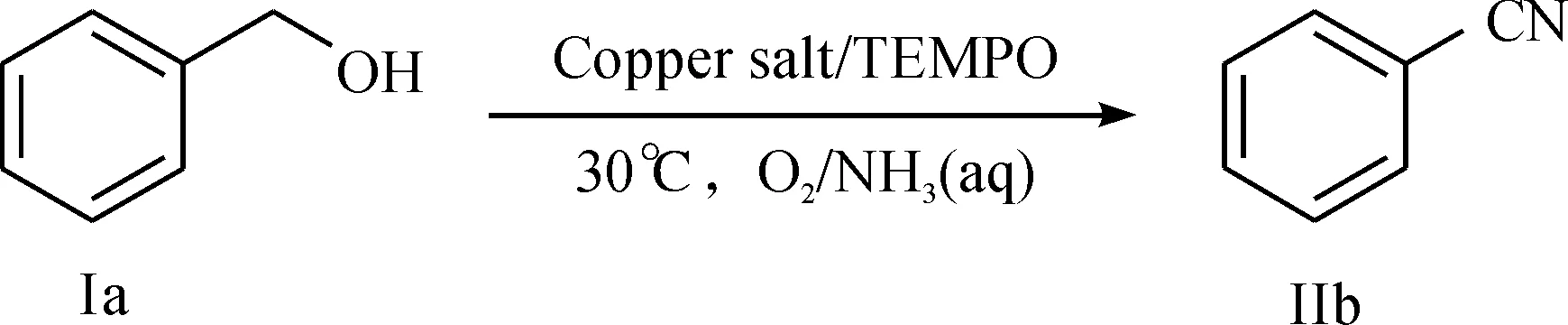
在10 mL试管中依次加入4.9 mg Cu(OH)2(0.05 mmol),0.5 mL溶剂,0.5 mL氨水后在室温下搅拌至蓝色清液.然后加入醇类底物(1 mmol),7.8 mg TEMPO(0.05 mmol),搅拌混合均匀后移入30 ℃油浴,套氧气球,反应24 h后停止反应.乙酸乙酯萃取,饱和NH4Cl(aq),饱和NaHSO3(aq),饱和食盐水依次洗涤后合并有机相,无水硫酸钠干燥过夜.抽滤后所得有机相旋蒸(43 ℃水浴,真空度约5 kPa)浓缩后以柱色谱分离产物.洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶5~1∶15.对分离出的产物用核磁共振确认.
苯甲腈(Ⅱa):无色液体,1H NMR(500 MHz,CDCl3):δ7.45(t,J=7.7 Hz,2H),7.59(m,3H).3,4-二甲基苯甲腈(Ⅱb):白色固体,mp:66~67 ℃,1H NMR(500 MHz,CDCl3):δ2.30(s,3H),2.33(s,3H),7.22(d,J=7.6 Hz,1H),7.40(dd,1H),7.42(d,1H).3,4-二甲氧基苯甲腈(Ⅱc):白色固体,mp:67~68 ℃,1H NMR(500 MHz,CDCl3):δ3.91(s,3H),δ3.91(s,3H),6.91(d,J=8.8 Hz,1H),7.09(d,J=1.9 Hz,1H),7.29(dd,1H).2,4-二甲氧基苯甲腈(Ⅱd):白色固体,mp:95~96 ℃,1H NMR(500 MHz,CDCl3):δ3.87(s,3H),3.92(s,3H),6.47(d,J=2.3 Hz,1H),6.52(dd,1H),7.49(d,J=8.6 Hz,1H).对硝基苯甲腈(Ⅱe):白色固体,mp:144-145 ℃,1H NMR(500 MHz,CDCl3):δ7.90(d,J=8.5 Hz,2H),8.37(d,J=8.5 Hz,2H).间硝基苯甲腈(Ⅱf):白色固体,mp:115~116 ℃,1H NMR(500 MHz,CDCl3):δ7.76(m,1H),8.02(d,J=7.8 Hz,1H),8.49(m,1H),8.55(m,1H).邻氯苯甲腈(Ⅱg):白色固体,mp:44~45 ℃,1H NMR(500 MHz,CDCl3):δ7.39(m,1H),7.55(m,2H),7.70(m,1H).2,4-二氯苯甲腈(Ⅱh):白色固体,mp:61~62 ℃,1H NMR(500 MHz,CDCl3):δ7.39(m,1H),7.56(d,J=2.0 Hz,1H),7.63(d,J=8.4 Hz,1H).对氟苯甲腈(Ⅱi):白色固体,mp:36~37 ℃,1H NMR(500 MHz,CDCl3):δ7.19(m,2H),7.69(m,2H).对溴苯甲腈(Ⅱj):白色固体,mp:113~114 ℃,1H NMR(500 MHz,CDCl3):δ7.54(d,J=8.5 Hz,2H),7.65(d,J=8.5 Hz,2H).
2结果与分析
通过对不同的金属催化剂考察以及其他反应条件的优化,我们筛选得到了最佳的催化剂,并在此催化剂条件下探索到了最优的反应条件.
在之前已有的报道中,有出现过在无氮源存在时,铜盐/TEMPO体系能催化氧化苄醇类底物顺利得到醛类产物[7-8].此外,也有醛类和氮源缩合得到亚胺类中间产物最终转化为腈类的报道[9].结合上述报道研究的反应机理,我们推测此氧化氨化反应的可能机理为:首先将醇在催化下氧化为醛,然后再由醛和氮源缩合得到亚胺中间产物,之后继续经含铜化合物催化氧化得到氰基产物.
相较于前人的工作,本路线完全无需使用有机配体,反应仅在室温下即可进行,条件温和,环境友好.并且节约了成本,更加有利于工业化的应用.
2.1不同种类金属盐催化剂对反应的影响
为了探究苄醇的氨氧化反应转化为腈类化合物具有更好的催化活性的催化剂,我们首先以苯甲醇为反应底物,乙醇作为溶剂,氧气球的氛围下,对可变价的金属化合物进行了活性的考察,考察的结果如表1所示.由表1中可以得出:1) 含铜化合物与TEMPO合用的催化效果明显优于其他金属化合物.其中,一价含铜化合物的效果优于二价含铜化合物,反应收率更高(表1中序号为1,3,4,5);2) 二价含铜化合物中Cu(OH)2的催化效果明显优于除碘化亚铜外的其他一价含铜化合物(表1中序号为2).由于Cu(OH)2较为廉价,综合考量催化活性和价格因素,选择其为催化剂.
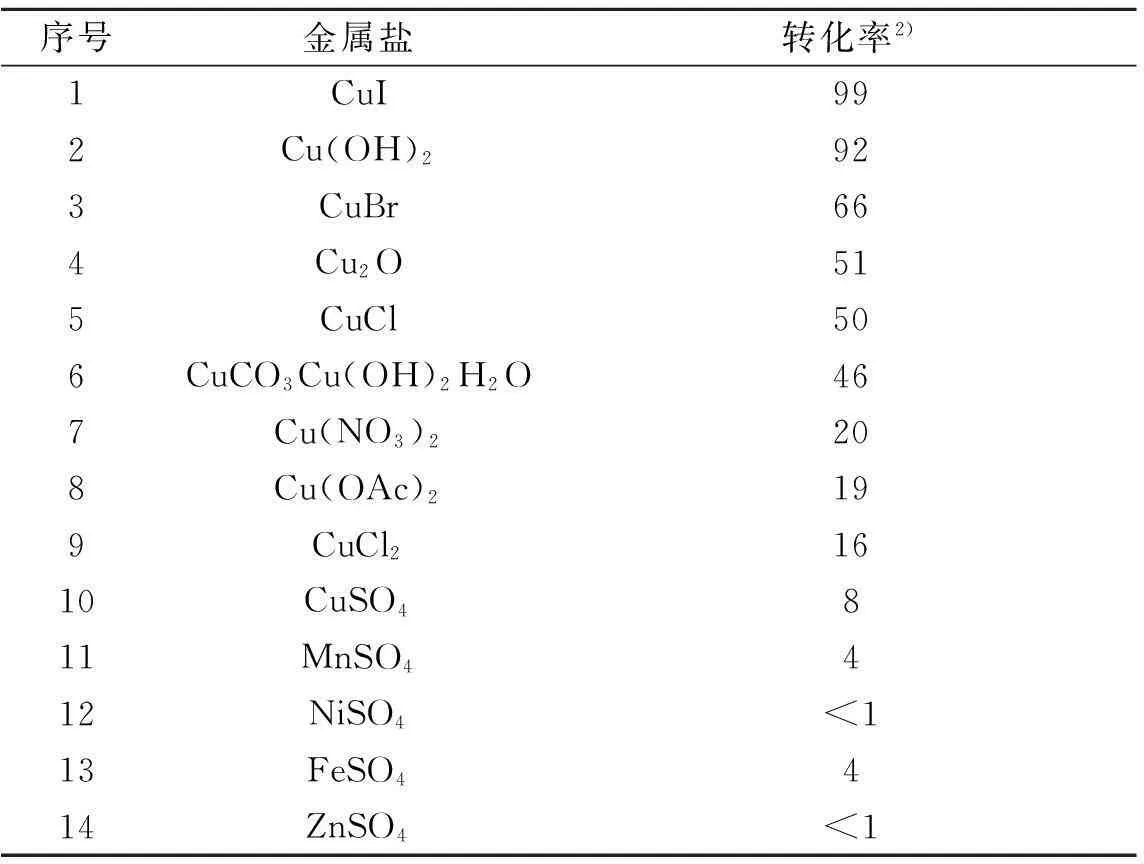
表1 不同催化剂对反应的影响 1)
注:1) 反应条件:0.05 mmol催化剂,0.05 mmol TEMPO, 1 mmol 苯甲醇, 0.5 mL乙醇, 0.5 mL 25 %氨水在室温下套氧气球反应5 h.;2) 反应产物采用气相检测,与苯甲醇以及苯甲腈的标准样品对照,转化率用面积归一法计算而得,产物选择性大于99%,如无特殊说明,以下转化率的检测方法相同.
2.2Cu(OH)2催化剂用量对反应的影响
如表2所示,通过对不同用量的Cu(OH)2催化剂的添加对反应转化率进行考察,可以看出,随着催化剂Cu(OH)2的用量的不断增加至0.05 mmol,反应的转化率显著提高,但继续增加至0.10 mmol后对反应无明显促进作用(表2中序号为1~4).通过比较添加其他的碱性化合物的结果后发现:Cu(OH)2的催化作用在本催化体系中与其自身的碱性并没有明显的关系,而且KOH和NaOH等强碱物质的加入反而一定程度上抑制了氨氧化反应的进行(表2中序号为3,5,6),因此选择0.05 mmol Cu(OH)2为最佳的催化剂用量.
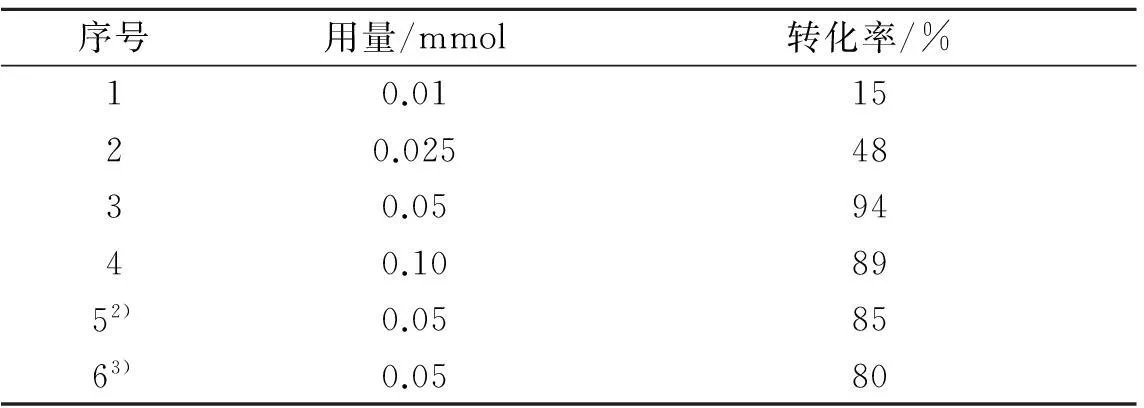
表2 Cu(OH) 2用量对反应的影响 1)
注:1) 反应条件:Cu(OH)2,0.05 mmol TEMPO, 1 mmol苯甲醇,0.5 mL乙醇,0.5 mL 25%氨水在室温下套氧气球反应24 h.;2) 加0.05 mmol NaOH.3) 加0.05 mmol K3PO4.
2.3温度和反应时间对反应的影响
之后,我们又对反应的温度和时间进行了考察.如表3所示,此反应在一定程度上受温度的影响,30 ℃为反应的最佳温度.在相同的时间内,反应温度升高到50 ℃和60 ℃后(表3中序号为6,7),反应的转化率反而稍低于反应温度为30 ℃和40 ℃的结果(表3中序号为4,5).可能原因为过高的温度会加快溶剂的挥发,并据文献报道过高温度会降低反应的选择性,而过低的温度将减慢反应进程,故30 ℃为最佳选择.综合考量24 h为最合适的反应时间,产物的转化率能够达到理想值.

表3 温度和反应时间对反应的影响 1)
注:1) 反应条件:0.05 mmol Cu(OH)2, 0.05 mmol TEMPO,1 mmol苯甲醇,0.5 mL乙醇,0.5 mL 25%氨水套氧气球.
2.4不同溶剂对反应的影响
最后我们对催化体系的溶剂的选择和用量进行考察.从表4可以看出:溶剂对反应的转化率和选择性有显著影响,其中丙酮与氯仿分别作溶剂时反应的转化率和选择性皆不理想(表4中序号为3,7);甲醇,THF,DMSO,DMF分别作溶剂时反应转化率较高,但选择性差,通过其与标准样品的对照发现反应液中都有不少量的苯甲醛产生(表4中序号为2,5,8,9).而乙醇,乙腈,叔丁醇分别作溶剂时反应在转化率和选择性两方面都得到较良好的结果,其中乙醇为最佳选择.

表4 不同溶剂对反应的影响 1)
注:1) 反应条件:0.05 mmol Cu(OH)2,0.05 mmol TEMPO,1 mmol苯甲醇,0.5 mL溶剂,0.5 mL 25%氨水套氧气球.在30 ℃下反应;2) 反应产物用气相检测,与苯甲醇、苯甲醛、苯甲腈的标准样品对照,转化率和选择性用面积归一法计算得到.
2.5不同苄醇类底物通过氨氧化合成苯腈
我们用以上筛选优化后的条件(催化剂Cu(OH)2用量为0.05 mmol,TEMPO的用量为0.05 mmol)对不同的苄醇类底物进行氨氧化催化,反应结果如表5所示.该氨氧化反应的反应式为

表5 苄醇在Cu(OH) 2/TEMPO体系下的催化氨氧化 1)

序号取代基产物编号产率2)/%1R1=H,R2=H,R3=HⅡa932R1=H,R2,R3=CH3Ⅱb953R1=H,R2,R3=OCH3Ⅱc964R1,R3=OCH3,R2=HⅡd955R1,R2=H,R3=NO2Ⅱe756R1,R3=H,R2=NO2Ⅱf867R1=Cl,R2,R3=HⅡg668R1,R3=Cl,R2=HⅡh609R1,R2=H,R3=FⅡi6810R1,R2=H,R3=BrⅡj73
注:1) 反应条件:0.05 mmol Cu(OH)2,0.05 mmol TEMPO, 1 mmol 底物, 0.5 mL乙醇, 0.5 mL 25% 氨水在30 ℃下套氧气球反应24 h;2) 分离收率.
从表5中可知:各类芳香醇中,芳香环上不带有任何基团或者带有给电子基团时,反应的收率较高(表5中序号为1~4);当芳香环上带有吸电子基团时,反应相对较为困难,其中单取代产物中又以邻位氯代所得到的产物收率最低(表5中序号为5~10);而当芳香环上带有多个吸电子基团时,反应的收率将会变得更低(表5中序号为7~8).综上所述,本优化的催化体系对大部分的芳香基醇类底物普遍适用,能很好地氨氧化催化得到腈类化合物.
3结论
以Cu(OH)2/TEMPO/O2体系对催化氨氧化反应进行了研究和优化,探索出最佳的反应条件,得出苄醇类化合物可以通过氨氧化法,以0.05 mmol Cu(OH)2/0.05 mmol TEMPO/一个大气压O2作为催化体系,氨水作为氮源,室温下可合成得到苯腈类化合物.反应的转化率和选择性都非常理想.此路线条件温和,无须使用有机配体,为工业化的生产应用提供了选择.
参考文献:
[1]严国兵,于健,张玲.过渡金属催化C-CN键偶联反应的研究进展[J].有机化学,2012,32(2):294-303.
[2]ZHOU S, ADDIS D, DAS S, et al. New catalytic properties of iron complexes: dehydration of amides to nitriles[J]. Chemical Communications,2009(32):4883-4885.
[3]SCHUMPERLI M T, HAMMOND C, Hermans I. Developments in the aerobic oxidation of amines[J]. ACS Catalysis,2012,2(6):1108-1117.
[4]HOOVER J M, STAHL S S. Highly practical copper(I)/TEMPO catalyst system for chemoselective aerobic oxidation of primary alcohols[J]. Journal of American Chemical Society,2011,133(42):16901-16910.
[5]CDAPDEVIELLE P, LAVIGNE A, MAUMY M. Simple and efficient copper-catalyzed one-pot conversion of aldehydes into nitriles[J]. Synthesis,1989(6):451-452.
[6]YIN W, WANG C, HUANG Y. Highly practical synthesis of nitriles and heterocycles from alcohols under mild conditions by aerobic double dehydrogenative catalysis[J]. Organic Letters,2013,15(8):1850-1853.
[7]SHI F, TSE M K, CUI X, et al. Copper-catalyzed alkylation of sulfonamides with alcohols[J]. Angewandte Chemie International Edition,2012,48(22):5912-5915.
[8]LIAO S, YU K, LI Q, et al. Copper-catalyzed C-alkylation of secondary alcohols and methyl ketones with alcohols employing the aerobic relay race methodology[J]. Organic & Biomolecular Chemistry,2012,10(15):2973-2978.
[9]LI Q, FAN S, SUN Q, et al. Copper-catalyzed N-alkylation of amides and amines with alcohols employing the aerobic relay race methodology[J]. Organic & Biomolecular Chemistry,2012,10(15):2966-2972.
(责任编辑:刘岩)

