替莫唑胺、紫杉醇对神经胶质瘤U87细胞增殖的联合作用效果观察
梁会娟,梁海乾,涂悦,程世翔,周欣,姬文杰,魏向阳,苏景良,张赛( 天津医科大学研究生院,天津300070;武警后勤学院附属医院)
替莫唑胺、紫杉醇对神经胶质瘤U87细胞增殖的联合作用效果观察
梁会娟1,梁海乾2,涂悦2,程世翔2,周欣2,姬文杰2,魏向阳2,苏景良2,张赛2
( 1天津医科大学研究生院,天津300070;2武警后勤学院附属医院)
摘要:目的探讨替莫唑胺( TMZ)、紫杉醇( PTX)对神经胶质瘤U87细胞增殖的联合作用效果。方法将不同浓度的PTX或TMZ作用U87细胞24 h,确定两药的半数抑菌浓度( IC50)。PTX( IC50)、TMZ( IC50)单药及联合作用于体外培养神经胶质瘤U87细胞24、48、72 h,采用CCK-8试剂盒检测各时间点细胞生长抑制率。结果PTX的IC50为0.5 ng/mL,TMZ的IC50为5 μg/mL。与PTX或TMZ单药作用24、48 h比较,PTX + TMZ作用下细胞生长抑制率均降低( P均<0.01) ;与TMZ单药作用72 h比较,PTX + TMZ作用下细胞生长抑制率升高( P<0.05)。结论
TMZ联合PTX作用于神经胶质瘤U87细胞48 h内,两药表现为拮抗作用。作用72 h,与TMZ单药作用相比,两药联合有协同作用;但与PTX单药比较,该协同作用不明显。
关键词:神经胶质瘤;替莫唑胺;紫杉醇;协同作用;拮抗作用
神经胶质瘤是脑部最常见的恶性肿瘤[1],目前主要采用手术同步放化疗方案治疗,但总体有效率不高。替莫唑胺( TMZ)为胶质瘤化疗方案中一线用药,但随着治疗时间的延长,其疗效降低,耐药现象严重。紫杉醇( PTX)曾广泛应用于乳腺癌、卵巢癌、淋巴瘤等治疗,但长期用药出现的剂量相关的毒性反应及过敏现象严重。研究发现,TMZ、PTX耐药均与p53有关[2,3]。但两药联合是否能够发挥协同作用,目前尚不确定。2012年10月~2013年1月,本研究观察了TMZ、PTX对神经胶质瘤U87细胞增殖的联合作用效果。
1 材料与方法
1.1材料神经胶质瘤U87细胞(天津医科大学总医院),DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),PTX、TMZ(美国Sigma公司),CCK-8试剂盒(武汉博士德公司)。
1.2细胞培养U87细胞在含10%胎牛血清的HDMEM培养基中,置于5% CO2、37℃培养箱中培养;以0.25%胰蛋白酶消化传代,2~3 d传代1次。
1.3 TMZ、PTX半数抑菌浓度( IC50)确定及细胞增殖情况检测①IC50确定:取对数生长期U87细胞,按1×103/孔接种于96孔培养板。培养24 h后,加入配置好的不同浓度PTX( 1、0.5、0.25、0.125、0.062 5、0.031 25 ng/mL)或TMZ( 10、5、2.5、1.25、0.625、0.312 5 μg/mL)处理细胞24 h。每个浓度设5个复孔。5% CO2、37℃培养箱中共培养24 h后,每孔加入CCK-8溶液( 5 mg/mL) 10 μL,使终体积达到100 μL,移入37℃孵箱中继续孵育1 h。以仅含U87细胞孔为对照孔,仅含培养液孔为空白孔。采用全自动酶标仪,在波长450 nm下测定每孔光密度( OD)值,计算细胞生长抑制率。生长抑制率( %) = ( OD对照-OD药物)/( OD对照-OD空白)× 100%。采用SPSS11.0统计软件推算PTX、TMZ的IC50。②细胞生长抑制率计算:以1×103/孔接种细胞于96孔培养板,培养24 h,分别加入PTX、TMZ、PTX + TMZ处理细胞,PTX、TMZ浓度均为IC50。每个浓度设5个复孔。5% CO2、37℃培养箱中共培养24、48、72 h后,每孔加入CCK-8溶液( 5 mg/mL) 10 μL,使终体积达到100 μL,移入37℃孵箱中继续孵育1 h。采用全自动酶标仪在波长450 nm下测定每孔OD值,计算细胞生长抑制率。
1.4统计学方法采用SPSS11.0统计软件。计量资料采用珋x±s表示,比较采用配对t检验(双侧)。P<0.05为差异有统计学意义。
2 结果
PTX的IC50为0.5 ng/mL,TMZ的IC50为5 μg/mL。PTX、TMZ、PTX + TMZ作用24、48、72 h后细胞生长抑制率比较见表1。
3 讨论
TMZ、PTX是胶质瘤术后临床常用化疗药物。PTX是一种水溶性分子,在胞外以被动扩散的形式通过细胞膜作用于微管系统,通过与微管蛋白N端
31位和217~231位氨基酸结合,诱导和稳定微管蛋白,使细胞周期阻滞于G2/M期[4],诱导细胞凋亡。TMZ是一种脂溶性药物,它是一种前体药物,在体内不需要经过肝脏代谢,正常生理条件下即可经过非酶解途径转化为活性化合物,直接发挥甲基化DNA的作用,使细胞周期停滞于G2期[5]。
表1 PTX、TMZ、PTX + TMZ作用24、48、72 h细胞生长抑制率比较( %,±s)
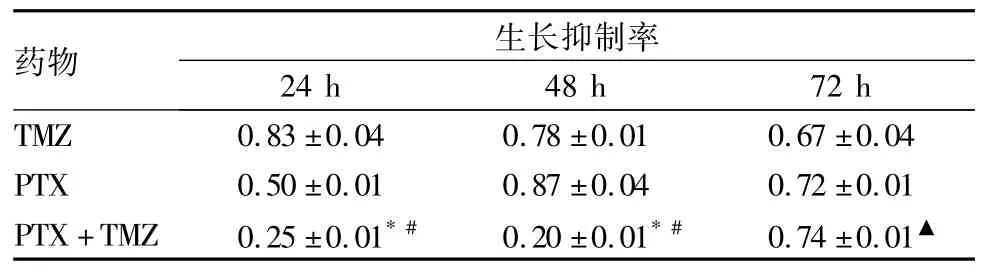
表1 PTX、TMZ、PTX + TMZ作用24、48、72 h细胞生长抑制率比较( %,±s)
注:与TMZ或PTX单独作用24 h比较,*P<0.01;与TMZ或PTX单独作用48 h比较,#P<0.01;与TMZ单独作用72 h比较,▲P <0.05。
药物 生长抑制率24 h 48 h 72 h TMZ 0.83±0.04 0.78±0.01 0.67±0.04 PTX 0.50±0.01 0.87±0.04 0.72±0.01 PTX +TMZ 0.25±0.01* # 0.20±0.01* # 0.74±0.01▲
本研究中PTX的IC50为0.5 ng/mL、TMZ的IC50为5 μg/mL,5 μg/mL TMZ作用24 h的细胞生长抑制率较0.5 ng/mL PTX大。产生机制:①TMZ 比PTX的细胞外浓度高,膜内外浓度梯度大,渗透作用更强;②TMZ直接作用于DNA,发挥杀伤作用; PTX不能直接作用于DNA,而是首先作用于微管系统,进一步诱导Raf-1的级联反应,进而发挥促凋亡作用[6]。
PTX进入细胞以后,诱导Raf-1/Bcl-2磷酸化,其丝氨酸的270位点被认为是PTX诱导Bcl-2磷酸化的主要位点,该位点被丙氨酸取代后,显著抑制Bcl-2、上调p53[7]。TMZ发生甲基化作用后,O6-甲基鸟嘌呤( O6-mG)主要被MGMT修复,N3甲基腺嘌呤、N7甲基鸟嘌呤主要被N7甲基鸟嘌呤-N3-甲基腺嘌呤-DNA-转葡糖激酶( MPG)修复,是细胞内碱基切除修复途径( BER)的始动因素,且不依赖于MGMT的存在。TMZ还可作用于葡萄糖调节蛋白78 ( GRP78),它能够维持肿瘤细胞内内质网的稳定性,抵抗TMZ诱导的凋亡[8]。研究表明,MPG和MGMT均可上调p53[9]。在G1期,p53可以调控p21WAF/C1P1基因,与一系列Cyclin-cdk复合物结合,抑制蛋白激酶激活,使高磷酸化的Rb蛋白堆积,引起E2F转录调节因子抑制,细胞阻滞在G1期[10];在G2/M期,p53通过下调Cyclin B1,使细胞不能进入M期[11];最终导致细胞生长停滞,修复损伤,减少凋亡率。在p53的多聚体中,存在有能够和DNA结合的结构域,这些结构域本身具有核酸内切酶的活性,可以修复错配的核苷酸,调节核苷酸的内切修复因子XPB和XPD活性;此外,它还可以通过与P21WAF1基因以及CDK1基因结合,调节细胞周期进展[12]。
本研究发现,TMZ联合PTX作用于神经胶质瘤U87细胞48 h内,两药表现为拮抗作用。作用72 h时,与TMZ单药作用相比,两药联合有协同作用;但与PTX单药比较,该协同作用不明显。但是,本研究未观察两药联用的不良发应,今后将进一步探讨。
参考文献:
[1]Erin M,Siegel L,Burton Nabors,et al.Prediagnostic body weight and survival in high grade glioma[J].J Neurooncol,2013,114 ( 1) : 79-84.
[2]Kojima K,Fujita Y,Nozawa Y,et al.Mi 34a attenuates paclitaxel-resistance of hormone-refractory prostate cancer PC3 cells through direct and indirect mechanisms[J].Prostate,2010,70 ( 14) : 1501-1512.
[3]Martin S,Janouskova H,Dontenwill M.Integrins and p53 pathways in glioblastoma resistance to temozolomide[J].Front Oncol,2012,( 2) : 157.
[4]Zhang C,Xu YG,Duan XN,et al.Role of granulocyte colonystimulating factor in paclitaxel-induced intestinal barrier breakdown and bacterial translocation in rats[J].Chin Med J ( Engl),2011,124( 12) : 1870-1875.
[5]章龙珍,赵丽,刘美艳,等.替莫唑胺对人胶质瘤细胞系U251细胞的增殖影响[J].山东医药,2009,49( 25) : 29-31.
[6]Eum KH,Lee M.Crosstalk between autophagy and apoptosis in the regulation of paclitaxel-induced cell death in v-Ha-ras-transformed fibroblasts[J].Mol Cell Biochem,2011,348( 1-2) :61-68.
[7]Wang EY,Gang HY,Aviv Y,et al.p53 mediates autophagy and cell death by a mechanism contingent on bnip3[J].Hypertension,2013,62( 1) : 70-77.
[8]Song SS,Xing GC,Yuan L,et al.N-methylpurine DNA glycosylase inhibits p53-mediated cell cycle arrest and coordinates with p53 to determine sensitivity to alkylating agents[J].Cell Res,2012,22( 8) : 1285-1303.
[9]Kitange GJ,Mladek AC,Carlson BL,et al.Inhibition of histone deacetylation potentiates the evolution of acquired temozolomide resistance linked to MGMT upregulation in glioblastoma xenografts [J].Clin Cancer Res,2012,18( 15) : 4070-4079.
[10]Zhou Q,Zhu M,Zhang H,et al.Disruption of the p53-p21 pathway inhibits efficiency of the lytic-replication cycle of herpes simplex virus type 2 ( HSV-2)[J].Virus Res,2012,169( 1) : 91-97.
[11]Hoffmann TK,Trellakis S,Okulicz K,et al.Cyclin B1 expression and p53 status in squamous cell carcinomas of the head and neck [J].Anticancer Res,2011,31( 10) : 3151-3157.
[12]史惠荣,张瑞涛.P53、P21WAF1和CDK1在卵巢上皮性癌组织中的表达及意义[J].癌症杂志2009,28( 8) : 882-885.
·临床研究·
收稿日期:( 2014-10-24)
文章编号:1002-266X( 2015) 28-0034-02
文献标志码:A
中图分类号:R739.4
doi:10.3969/j.issn.1002-266X.2015.28.012

