靶向PDGFR-α mRNA的RNA干扰抑制实验性增生性玻璃体视网膜病变
孟 竹,彭燕一,秦贤杰
·实验论著·
靶向PDGFR-α mRNA的RNA干扰抑制实验性增生性玻璃体视网膜病变
孟竹1,彭燕一2,秦贤杰1
Inhibition of targeted platelet-derived growth factor receptor-α RNA interference into vitreous cavity for experimental proliferative vitreoretinopathy
Citation:Meng Z, Peng YY, Qin XJ.Inhibition of targeted platelet-derived growth factor receptor α RNA interference into vitreous cavity for experimental proliferative vitreoretinopathy.GuojiYankeZazhi(IntEyeSci) 2016;16(1):24-27
摘要
目的:观察血小板源性生长因子-α受体(platelet-derived growth factor receptor,PDGFR-α)mRNA的RNA干扰抑制实验性增生性玻璃体视网膜病变(proliferative vitreoretinopathy, PVR)的效果。
方法:选择PDGFR-α shRNA/lip2000比值1∶1、1∶2、1∶3(其中PDGFR-α shRNA分别为2μg、3μg和4μg)制备复合物转染至人视网膜色素上皮细胞(human retinal pigment epithelium,HRPE)中,24h后分别取0.1mL注射到家兔玻璃体腔。选取健康成年有色家兔40只随机分为平衡盐溶液(balanced salt solution, BSS)组(N组),含lipofectamineTM2000的HRPE细胞稀释液组(A组),取最佳转染效率的1.0、1.5与2.0μmol/L含PDGF-α受体的shRNA及lipofectamineTM2000的HRPE细胞稀释液组(B、C和D组),每组8眼,右眼为实验眼。间接眼底镜观察PVR程度,免疫组织化学染色进行切片着色情况观察及组织病理学观察眼底改变。
结果:PDGFR-α shRNA/lip2000比值1∶2时,HRPE细胞最佳转染效率;B组、C组和D组PVR程度、组织病理学改变、免疫组织化学染色PDGFR-α浓度低于A组,D组比B组和C组更低。
结论:PDGF-α受体mRNA的RNA干扰对实验性PVR形成有抑制作用。
关键词:视网膜色素上皮细胞;增生性玻璃体视网膜病变;PDGF-α受体;RNA干扰
引用:孟竹,彭燕一,秦贤杰.靶向PDGFR-α mRNA的RNA干扰抑制实验性增生性玻璃体视网膜病变.国际眼科杂志2016;16(1):24-27
0引言
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是在巨大视网膜裂孔、多发视网膜裂孔、眼外伤以及眼内炎症等因素作用下视网膜或玻璃体表面形成增殖纤维膜继而收缩、牵拉引起视网膜脱离的一种严重眼病。近年来随着玻璃体手术的普及,各种复杂的视网膜脱离虽然能达到解剖复位,但阻止其再发生却很难。因此,如何有效诊治PVR成为眼科医生的难题。基因治疗是日渐兴起的一种行之有效的方法,RNA干扰(RNA interference,RNAi)技术的日趋成熟完善为PVR提供了基因治疗的可能性。目前国内甚少见到靶向血小板源性生长因子-α(platelet-derived growth factor, PDGF-α)受体RNA干扰治疗PVR的临床和实验报道,因此我们拟构建PDGF-α受体具有转录功能的短发卡RNA(shRNA),观察其对PVR发生、发展的抑制作用。
1材料和方法
1.1材料
1.1.1实验动物与分组有色体健家兔40只,雄性,无眼疾史,体质量2.0~2.5kg,桂林医学院实验动物中心提供。右眼为实验眼,常规饲养。随机分为5组,每组8只:N组(正常对照组)玻璃体内注射 0.1mL的平衡盐溶液(balanced salt solution, BSS);A组(空白对照组)玻璃体内注射0.1mL含lipofectamineTM2000 HRPE细胞稀释液的HRPE细胞;B、C、D组(实验组)玻璃体内分别注射0.1mL的1.0、1.5、2.0μmol/L PDGFR-α shRNA及lipofectamineTM2000 HRPE细胞稀释液。
1.2方法
1.2.1细胞传代与培养在37℃、CO2体积分数为5%的培养箱中,HRPE细胞采用加10%血清及1%抗青霉素、链霉素的DMEM培养基传代培养,倒置显微镜观察,细胞贴壁后2d换液,每隔2~3d以2.5g/L胰酶消化、传代。
1.2.2细胞转染取对数生长期细胞接种于6孔板中,调整细胞浓度至每孔0.5×106个,待细胞生长至90%以上融合时转染,具体转染方法见参考文献[1],选取最佳PDGFR-α shRNA/lip2000转染比值。细胞分为1.0、1.5和2.0μmol/L三个PDGFR-α shRNA浓度组及空白对照组,转染4~6h后换液,1d后将6孔板置于荧光显微镜下观察,转染率达60%以上的细胞可用于注射。将上述细胞浓度调整为2.0×106个/mL,分别用一次性1mL无菌注射器取0.1mL HRPE细胞稀释液于30min内进行玻璃体内注射。
1.2.3动物眼内注射按1.1.1分组中方法注射,氯霉素滴眼液于术前3d滴眼,6次/d;托吡卡胺充分散瞳;爱尔卡因滴眼液滴眼进行眼表面麻醉,在颞上象限角巩膜缘后4~5mm处用一次性1mL注射器向玻璃体中央刺入,进针深度约为5mm,分别注入不同浓度的HPRE细胞稀释液或BSS 0.1mL,出针后无菌棉签按压针孔5~10s,术后及术后3d用妥布霉素地塞米松滴眼液点眼6次/d,防止感染。分别观察术后1、2、3、4wk家兔实验眼玻璃体有无感染、出血等并发症,若玻璃体内出现絮状增殖条带,并且增多发生牵拉,甚至发生视网膜脱离则表明PVR形成。
1.2.4临床PVR分级观察用复方托吡卡胺滴眼液充分散瞳后,直接检眼镜分别于术前和术后1、2、3、4wk进行检查,记录实验眼PVR的级别,PVRⅢ~Ⅴ级为发生牵拉性视网膜脱离(traction retinal detachment,TRD),计算TRD发生率。按Fasternburg分级原则将PVR分为5个级别[2]:Ⅰ级:玻璃体内可见增殖条带;Ⅱ级: 局灶性牵拉等;Ⅲ级:髓线处的局部视网膜脱离及视网膜局部皱褶;Ⅳ级:髓线处视网膜完全脱离,视盘周围视网膜局部脱离;Ⅴ级:视网膜裂孔形成及全部脱离。
1.2.5 HE染色观察视网膜病理形态学变化眼内注射后4wk每组在耳缘静脉注入空气各处死2只家兔,迅速将眼球取出,于角巩膜缘环形剪开,流水冲洗,放入4%多聚甲醛溶液固定,乙醇脱水、二甲苯、石蜡包埋,作角膜至视乳头的连续矢状切片,石蜡切片脱蜡、水化后,HE染色,光学显微镜下观察病理组织切片染色情况。
1.2.6免疫组织化学观察PDGF-α的表达用上述方法制作眼球标本,石蜡切片、烤片1h,常规脱蜡、水化,柠檬酸抗原修复液高压修复,3% H2O2孵育10min,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3min×3次;弃PBS,滴入兔抗人PDGF-α多克隆抗体(1∶200),孵育1h,PBS冲洗;滴入二抗,25℃环境下孵育20min,PBS冲洗;DAB显色,流水充分冲刷,苏木素复染,封片。光学显微镜下分析切片染色情况。

2结果
2.1 HRPE细胞转染观察PDGFR-α shRNA与阳性脂质体比值为1∶2(即3μg:6μL)时转染率高于其他实验组(图1①);PDGFR-α shRNA能被lip2000成功转染进HRPE细胞(分为1.0、1.5和2.0μmol/L浓度组),转染1d后,荧光显微镜同一视野下荧光观察及普通明场观察细胞内转染情况,用染核染料统计细胞总数,选取4个视野,计算每一个视野转染成功的细胞比例,取平均值,计算转染率为65%~75%(图1②)。
2.2 PVR分级结果术前各组玻璃体、视网膜结构均正常;A、B、C、D组注射后2~3d,玻璃体内可见明显的雾状混浊,眼底隐约可见视网膜位置、颜色正常;7d后雾状混浊部分消散,并出现灰白色条带;注射后14d玻璃体内出现不同程度的增粗条索状物;注射后14~21d,依稀看到条带状增殖膜牵拉视网膜微凸出;注射28d后,正常对照组兔眼玻璃体、视网膜结构未见变化;A组兔眼玻璃体内可见大量絮状物及视网膜脱离,B、C组和D组严重度低于A组(图2)。注入后不同时间点各组PVR分级情况见表1,1wk后,A组形成PVR个数与B、C组和D组均无统计学差异(即均Pb1、Pc1、Pd1>0.05);注射后2、3、4wk,A组形成PVR个数与B、C组和D组均有统计学差异(均P<0.05)。注射后4wk,B组TRD发生率(50.0%)、C组(37.5%)和D组TRD发生率(25%)与A组(100%)相比,有统计学差异(P=0.04);D组与B、C组相比,无统计学差异(P>0.05)。

图1荧光显微镜检查①:质粒与脂质体不同比值时转染效率(×100,比值为1∶2时转染率最高)A:1∶1;B:1∶2;C:1∶3。②:转染率达65%时同一视野下不同视场转染效果(×200)A:荧光观察细胞内转染情况;B:普通明视场观察细胞内转染情况。
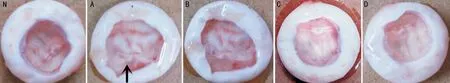
图2注射4wk后,N组兔眼玻璃体、视网膜结构正常;空白对照组兔眼玻璃体内可见大量视网膜脱离(箭头部分);B、C和D组可见不同程度的絮状物及视网膜牵拉脱离,严重程度低于A组N:正常对照组;A:空白对照组;B:1.0μmol/L PDGFR-α shRNA浓度组;C:1.5μmol/L PDGFR-α shRNA浓度组;D:2.0μmol/L PDGFR-α shRNA浓度组。

图3HE染色示N组内外核层、神经节细胞排列整齐,全层结构基本正常;空白对照组兔眼视网膜内、外核层细胞排列杂乱,神经节细胞数量减少,外丛状层消失; B、C组和D组严重程度低于A组(×400)N:正常对照组;A:空白对照组;B:1.0μmol/L PDGFR-α shRNA浓度组;C:1.5μmol/L PDGFR-α shRNA浓度组;D:2.0μmol/L PDGFR-α shRNA浓度组。

图4免疫组化示N组兔眼视网膜神经节细胞隐约可见微量棕黄色PDGF-A阳性颗粒;注射后4wk,空白对照组兔眼视网膜纤维组织可见大量棕黄色PDGF-α阳性表达颗粒;B、C、D组兔眼视网膜纤维组织结构清晰,阳性表达颗粒较A组少,且B、C、D组随着注入细胞浓度的增加其阳性表达颗粒依次减少(×400)N:正常对照组;A:空白对照组;B:1.0μmol/L PDGFR-α shRNA浓度组;C:1.5μmol/L PDGFR-α shRNA浓度组;D:2.0μmol/L PDGFR-α shRNA浓度组。
2.3视网膜病理形态学变化注射后28d正常对照组兔眼视网膜完整,内外核层、神经节细胞分列有序,全层结构未见明显变化;A组兔眼视网膜内、外核层细胞排列杂乱,神经节细胞数量减少,外丛状层消失;B、C组和D组严重度低于A组(图3)。
表1各组各观察时间点形成PVR个数情况
±s,分)
注:注射后1wk,A组形成PVR个数与B、C和D组均无统计学差异(即Pb1、Pc1、Pd1均>0.05);注射后2、3、4wk,A组与其他组均有统计学差异(P值均<0.05);A:空白对照组;B:1.0μmol/L PDGFR-α shRNA浓度组;C:1.5μmol/L PDGFR-α shRNA浓度组;D:2.0μmol/L PDGFR-α shRNA浓度组。
2.4免疫组织化学染色结果PDGF-α在视网膜及玻璃体的免疫组织化学染色阳性表现为细胞内棕黄色颗粒,正常对照组兔眼视网膜神经节细胞隐约可见微量棕黄色PDGF-α阳性颗粒;注射后4wk,A组兔眼视网膜纤维组织可见大量棕黄色PDGF-α阳性表达颗粒;B、C、D组兔眼视网膜纤维组织结构清晰,阳性表达颗粒较A组少,且B、C、D组随着注入细胞浓度的增加其阳性表达颗粒依次减少(图4)。
3讨论
PVR形成的病理过程主要是由于RPE细胞、神经胶质细胞、肌纤维母细胞等在细胞外基质及生长因子的作用下,在PDGF、纤维连接蛋白或由于自分泌的PDGF等血浆中的成分作用下大量增殖、迁移,从而产生恶性循环导致PVR的形成。本次实验采用PDGF转染过的HRPE细胞进行兔玻璃体腔注射,术后观察4wk,即出现显著的PVR。
PVR动物模型的建立是本次实验的关键,选择简易可靠的方法显得尤为重要。田苗等[2]研究发现通过Dispase和RPE细胞可以成功构建的动物PVR模型,是一种极为便捷可靠的方法。玻璃体注射时进针位置的选定上,选在角巩膜缘后2~3mm处进针居多,但我们发现这个位置造模成功率低,因为兔眼晶状体相对较大且呈球形,若从此处进针易损伤晶状体而发生白内障,以致无法造模成功。本实验在角巩膜缘后4~5mm处,沿玻璃体后部进针5mm,减少了对晶状体损害的同时,直接检眼镜观察对视网膜也无损害,安全稳当。
大量研究证实PDGF与PVR形成关系紧密。司艳芳等[3]研究发现PDGF促进色素上皮细胞的增生和移行,说明PDGF可能对PVR的形成有一定的影响。同时,许迅等[4]研究发现PDGF在PVR患者视网膜中呈较强浓度。并且PDGF只有与其受体结合后,才能发挥相应的生物学作用。因此,阻断 PDGF受体也能抑制PVR的发展。PDGF受体有α和β两种,熊蕾等[5]研究发现特异性地阻断PDGF-α受体的表达比阻断PDGF-β受体的表达在抑制兔视网膜脱离的形成中更为显著,提示PDGFR-α与PVR更具关联性。彭燕一等[6]研究发现PDGF参与了PVR的全过程,同时在众多因子中被证实是最有前景的一种方法。PDGFR-α在视网膜增生性疾病治疗中有可能成为新的研究方向,阻断 PDGF-α受体的表达可能为治疗PVR提供一条新思路。
目前RNAi技术在视网膜增殖性疾病的基因治疗方面已获得了较好的进展[7]。秦贤杰等[8]通过研究证实PDGFR-α shRNA可抑制人视网膜色素上皮细胞增生。周国义等[9]采用向小鼠PVR模型玻璃体腔注射PKCα siRNA的方法,研究其对PVR形成的抑制作用。结果证实,PKCα siRNA对PVR的发生确实有一定的抑制作用。刘矫连[10]通过往小鼠玻璃体腔注入构建慢病毒介导的靶向Netrin-1的小发夹状RNA,研究表明靶向Netrin-1的shRNA可明显控制视网膜新生血管形成,为视网膜增殖性病变的基因诊治提供了新的方向。目前很多学者已致力于抑制PVR的研究,国外有研究表明,核心蛋白聚糖,一种天然的TGF-β1抑制剂,Nassar等[11]在PVR兔眼模型中应用它辅助玻璃体切割手术,发现可阻碍纤维增殖和视网膜脱离的进展。此外,法舒地尔可通过抑制TGF-β下游的Rho激酶显著地抑制PVR发展[12]。由此可见,更多抑制PVR发生、发展的临床研究是不可缺少的。
前已述及PDGF在PVR形成中起着关键作用,RPE细胞亦可诱导小鼠PVR模型,同时RNAi技术已较成熟地用于眼科疾病治疗中。本研究通过RNAi技术沉默PDGF-α受体,将其注入兔眼玻璃体腔内,免疫荧光检查显示PDGFR-α shRNA脂质体成功转染至RPE细胞内,直接检眼镜检查显示玻璃体内注射RPE细胞能导致PVR发生,当细胞转入了PDGFR-α shRNA脂质体时PVR显著减轻,降低了TRD的发生率,并在一定范围内随浓度的增加,病变减轻。免疫组织化学染色结果说明PDGF-α在PVR中高表达,对其RNA进行干扰从而抑制PVR形成,并在一定范围内随其浓度增加,抑制作用增强。
综上所述,PDGF-α受体的RNA干扰对PVR的发生、发展有明显抑制作用。本次实验选择不同浓度梯度,实验结果显示,1~2μmol/L的浓度范围对PVR的抑制程度随着浓度升高而增强,但是要确定最佳浓度范围还需进一步的研究,以保证最低的浓度达到最好的抑制效果。然而PDGFR-α shRNA在玻璃体内的应用是否具有视网膜毒性,与PVR的发生是否有一定关联,尚缺乏实验研究,有待继续深层次的研究。本研究针对PDGF-α受体shRNA设计研究PVR的治疗方法,为今后临床基因治疗PVR提供良好的实验基础。
参考文献
1李林,徐剑容,王咏针,等.微小RNA-7对人视网膜色素上皮细胞增生和迁移的影响.眼科新进展2014;34(2):122-126
2田苗,彭绍民.Dispase与RPE细胞联合诱导的小鼠PVR模型的建立.哈尔滨医科大学学报 2011;45(6):556-559
3司艳芳,王君,关娟,等.血小板来源的生长因子通过ERK/p38/PI3K促进人视网膜色素上皮细胞的增殖、迁移. 现代生物医学进展 2012;12(34):6628-6632
4许迅,王方,胡宏慧,等.PDGF受体、TGF-β_1及其受体在视网膜下液中的表达.眼科新进展 2002;22(1):9-11
5熊蕾,权颜龙,郑玉萍,等.血小板源性生长因子受体α在兔增殖性玻璃体视网膜病变中的作用(英文). 国际眼科杂志 2008;8(1):6-9
6彭燕一,李光辉,秦程,等. PDGFR-α ASODN玻璃体内注射对视网膜的毒性作用.实用医学杂志 2015; 31(14):2264-2267
7秦贤杰,彭燕一. RNA干扰技术与眼科疾病.国际眼科杂志 2014;14(5):849-851
8秦贤杰,彭燕一,孟竹,等. RNA干扰抑制PDGF-α受体对人视网膜色素上皮细胞增殖的影响.实用医学杂志 2015;31(10):1580-1582
9周国义,张海容,林丹丹.蛋白激酶Cα小干扰RNA体内抑制鼠增生性玻璃体视网膜病变的实验研究.全科医学临床与教育 2015;13(2):125-127,116
10刘矫连.慢病毒介导的Netrin-1小发夹状RNA在视网膜新生血管形成中的调控作用.中南大学 2011
11 Nassar K,Luke J,Luke M,etal. The novel use of decorin in prevention of the development of proliferative vitreoretinopathy (PVR).GraefesArchClinExpOphthalmol2011;2449(11):1649-1660
12 Kita T. Molecular mechanisms of preretinal membrane contraction in proliferative vitreoretinal diseases and ROCK as a therapeutic target.NihonGankaGakkaiZasshi2010;114(11):927-934
Zhu Meng1, Yan-Yi Peng2, Xian-Jie Qin1
Foundation items:Natural Science Foundation of Guangxi Zhuang Autonomous Region (No.2012GXNSFAA053103);the Open Project of Guangxi Medical Scientific Experiment Center (No.KFJJ2011-11)
1Guilin Medical University, Guilin 541004,Guangxi Zhuang Autonomous Region,China;2Department of Ophthalmology, Affiliated Hospital of Guilin Medical University, Guilin 541001,Guangxi Zhuang Autonomous Region, China
Correspondence to:Yan-Yi Peng.Department of Ophthalmology, Affiliated Hospital of Guilin Medical University, Guilin 541001,Guangxi Zhuang Autonomous Region, China.yypeng_7@hotmail.com
Received:2015-09-14Accepted:2015-12-10
Abstract
•AIM:To observe the therapeutic effect of platelet-derived growth factor receptor-α RNA interference on inhibiting experimental proliferative vitreoretinopathy(PVR).
•METHODS:Different concentrations of PDGFR-α shRNA were blended with lip2000,and the final scale of PDGFR-α shRNA/lip2000 complex was 1∶1, 1∶2 and 1∶3 respectively(the concentration of PDGFR-α shRNA was respectively 2μg, 3μg and 4μg).All the complexes were cultivated in human retinal pigment epithelium(HRPE) for 24h after transfection and then respectively injected 0.1mL to rabbit vitreous cavity.Forty healthy adult rabbits were seleceted in this study and randomly divided into colored balanced salt solution (BSS) group (N), comprising lipofectamineTM2000 HRPE cell dilution group (group A). The highest transduction efficiency of 1.0, 1.5 and 2.0μmol/L containing PDGFR-α receptors shRNA, lipofectamineTM2000 of HRPE cell dilution were selected (respectively group B, C and D) with 8 eyes each, the right eyes as the experimental eye. The extent of PVR was observed by indirect ophthalmoscope;and slice staining situation was observed by immunohistochemistry.The fundus changes were observed by histopathology.
•RESULTS:The highest transduction efficiency of PDGFR-αshRNA/lip2000 ratio was 1∶2.The extent of PVR, the histopathology changes and the immunohistochemistry of PDGFR-α in group B,C and group D were significantly lower than that in group A, while group D was much lower than those of group B and C.
•CONCLUSION:PDGFR-αRNA interference could inhibit the formation of experimental PVR.
KEYWORDS:•retinal pigment epithelium cell;proliferative vitreoretinopathy;platelet-derived growth factor receptor-α;RNA interference
DOI:10.3980/j.issn.1672-5123.2016.1.06
收稿日期:2015-09-14 修回日期: 2015-12-10
通讯作者:彭燕一,教授,主任医师,研究方向:白内障、眼底病.yypeng_7@hotmail.com
作者简介:孟竹,女,在读硕士研究生,研究方向:眼底病。
基金项目:广西自然科学基金项目(No.2012GXNSFAA053103);广西医学科学实验中心开放课题项目(No.KFJJ2011-11)
作者单位:`1(541004)中国广西壮族自治区桂林市,桂林医学院;`2(541001)中国广西壮族自治区桂林市,桂林医学院附属医院

