联二萘酚衍生手性磷酸在亚胺不对称转移氢化反应中的应用研究进展*
李 珍,冯翠兰,黑莉楹,桂建舟,刘道胜(.辽宁石油化工大学化学与材料科学学院,辽宁抚顺 3000; .商丘师范学院化学化工学院,河南商丘 476000)
联二萘酚衍生手性磷酸在
亚胺不对称转移氢化反应中的应用研究进展*
李珍1,2,冯翠兰2,黑莉楹1,2,桂建舟1,刘道胜1
(1.辽宁石油化工大学化学与材料科学学院,辽宁抚顺113000; 2.商丘师范学院化学化工学院,河南商丘476000)
摘要:综述了BINOL衍生手性磷酸在亚胺不对称转移氢化反应中的应用研究进展。根据亚胺不对称转移氢化反应中三类不同的氢供体——Hantzsch酯类氢源、2-取代苯并噻唑啉类氢源及其他氢源,对BINOL衍生手性磷酸催化的亚胺不对称转移氢化反应进行了重点介绍。参考文献53篇。
关键词:联二萘酚;手性磷酸;亚胺;不对称转移氢化;综述
教师资助计划(2011GGJS-157)
通信联系人:冯翠兰,博士,副教授,E-mail:fengcuilanfan@163.com;刘道胜,博士,副教授,E-mail:dsliu05@126.com
联二萘酚(BINOL)衍生的手性磷酸(1和2,Chart 1)是一类催化性能优异的Brϕnsted酸催化剂,通过3,3'-位取代基的改变,可对其催化性能进行微调,使其适应不同的催化反应[1-2]。因此,BINOL衍生的手性磷酸在亚胺的不对称氢化[3-7]、Friedel-Crafts反应[8-11]、Mannich反应[12-15]、Pictet-Spengler反应[16-19]及Diels- Alder[20-23]等多种反应中均有良好的催化效果,是一类应用广泛的有机小分子催化剂。
与过渡金属催化剂相比较,手性磷酸具有来源方便、价格低廉、毒性小及无重金属残留等优点。因而,手性磷酸在催化领域的应用受到研究者的持续关注,最近已有多篇文献对手性磷酸研究进展进行了详细的综述[1,24-26]。

Chart 1
亚胺不对称转移氢化反应是制备手性胺类化合物的有效途径之一,其氢供体通常为2-取代苯并噻唑啉和Hantzsch酯等类化合物。本文综述了近年来BINOL衍生手性磷酸在亚胺不对称转移氢化反应中的应用研究进展。根据不同氢供体——Hantzsch酯类氢源、2-取代苯并噻唑啉类氢源及其他氢源,对BINOL衍生手性磷酸催化的亚胺不对称转移氢化反应进行了重点介绍。
1 Hantzsch酯类氢源
Hantzsch酯类化合物是最早用作不对称转移氢化反应有机氢供体的主要化合物之一,因此,Hantzsch酯类化合物作氢源,手性磷酸催化亚胺不对称转移氢化反应方面的研究成果较多。其中,周永贵课题组[27-30]在BINOL衍生手性磷酸催化的喹啉、异喹啉及其衍生物的不对称转移氢化方面的研究富有成效,仅2014年就发表了三篇文章报道这方面的研究成果。
Chen等[27]报道了Hantzsch酯(3)作氢源,BINOL衍生手性磷酸(R)-2a催化的2,3-双取代喹啉不对称转移氢化反应,以高收率和高对映选择性得到多个三手性中心的四氢喹啉衍生物(Scheme 1)。
Cai等[3]报道了关于BINOL衍生手性磷酸(S)-1a催化的3-位氨基取代喹啉不对称转移氢化反应(Scheme 2)。研究发现,3-位氨基若不进行保护直接进行反应,产物的收率很低(<5%),且NH2的保护基团对反应也有影响,当以Ts为保护基时,收率和ee值最高。初步的机理研究显示该反应为主要通过形成环内的亚胺中间体,再进一步进行动态动力学拆分的过程。
周永贵等[31]还通过手性磷酸负离子与酰氯活性底物之间的离子复分解反应,实现了异喹啉化合物的不对称转移氢化反应。手性磷酸(R)-2b在碱Na2CO3存在下,失去羟基上的氢,得到手性磷酸负离子(R)-2b-Na,异喹啉底物在氯甲酸三氯乙酯活化下形成正离子,两者形成的手性离子对在Hantzsch酯(4)为有机负氢供体的条件下实现了异喹啉化合物的不对称转移氢化反应,手性1-取代-1,2-二氢异喹啉产物的分离收率高达95%,对映体过量值最高为79%(Scheme 3)。
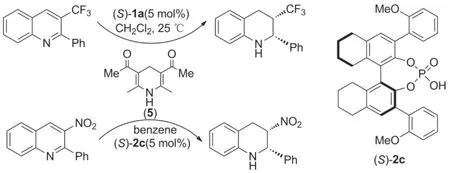
此外,周永贵等[28-29]还以Hantzsch酯类似物(5)为氢源,BINOL衍生手性磷酸(S)-1a,(S)-2c分别作催化剂,实现了3-位三氟甲基及3-位硝基取代喹啉的不对称转移氢化(Scheme 4)。
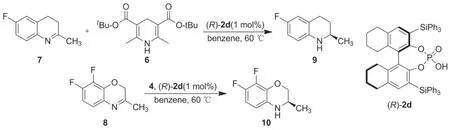
除此之外,还有较多有关BINOL衍生手性磷酸催化的亚胺不对称转移氢化的研究。例如,Rueping课题组[32]以Hantzsch酯类化合物为氢源,以BINOL衍生手性磷酸(R)-2d为催化剂,通过含氟喹啉(7)和含氟苯并噁嗪(8)的不对称转移氢化反应合成了抗生素氟喹诺酮类原料药的关键中间体(9和10,Scheme 5),ee值分别为97% 和93%。由9和10出发分别经过三步无金属催化剂的反应即可合成药物(R)-氟甲喹和(R)-左氧氟沙星。

Scheme 1

Scheme 2

Scheme 3
Scheme 4
Scheme 5
非保护的N-H亚胺的氢化一直是不对称催化研究领域的一个挑战。Wang课题组[33]则首先报道了BINOL衍生手性磷酸(S)-1b催化N-H未保护的邻羟基烷基酮亚胺不对称转移氢化反应,在优化条件下,当R=Me,R1=4-Me时,手性胺的收率和ee值分别为93%和96%(Scheme 6)。
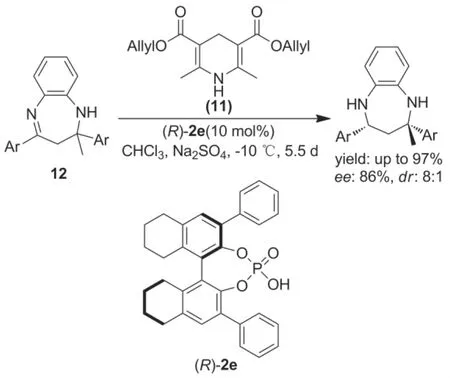
龚流柱等[34]研究了手性磷酸(R)-2e催化Hantzsch酯(11)作氢源的2-甲基-2,4-二芳基-2,3-二苯并[1,4]二氮杂卓(12)动态动力学不对称转移氢化反应,产物1,3-手性二胺衍生物主要和次要的非对映体ee值分别为86%和94%,dr为8/1(Scheme 7)。

Scheme 6
Scheme 7
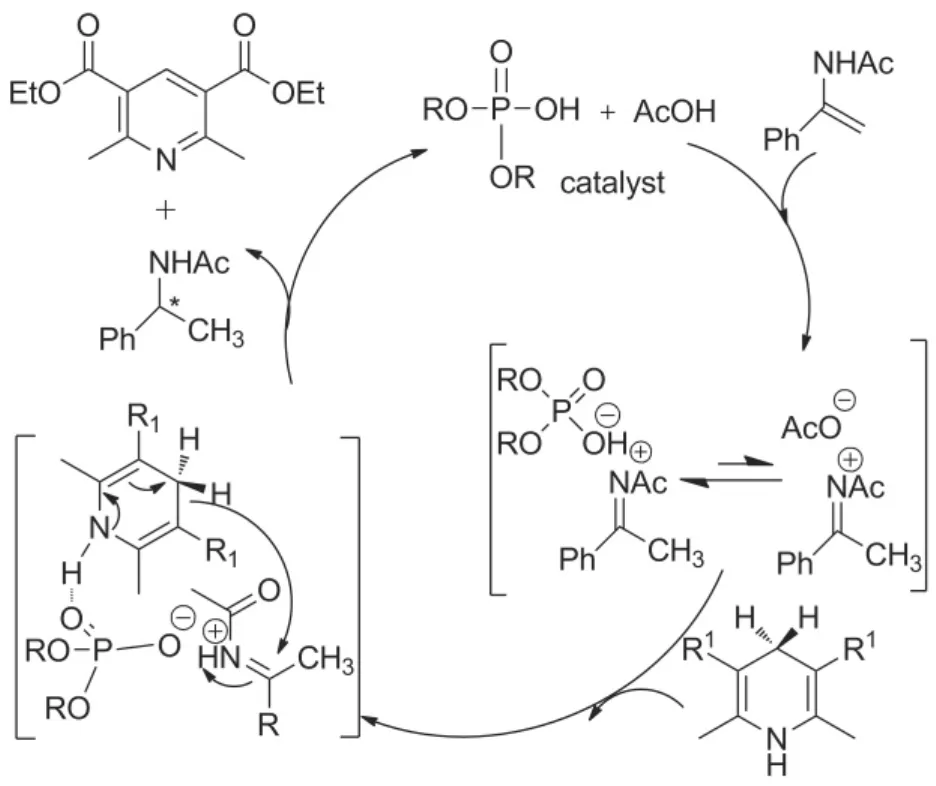
2009年,Antilla课题组[35]采用Hantzsch酯13作氢源,在手性磷酸(S)-1c和乙酸协同催化下实现了芳基烯酰胺的不对称转移氢化反应。当Ar为苯基时,仅用1 mol%手性磷酸(S)-1c和10 mol%乙酸,即以91%的ee值和95%的收率获得相应的手性胺产物(Scheme 8)。研究者以多种芳基烯酰胺为底物,对照了加入乙酸和不加乙酸催化体系中手性胺产物收率和ee值的区别,研究发现:加入乙酸的双酸催化体系,产物的收率普遍高于不加乙酸的催化体系,且加入乙酸的双酸催化体系中,产物的ee值与不加乙酸催化体系的相当(Scheme 8)。对此现象,研究者从反应机理上进行了解释:手性磷酸与乙酸协同催化的芳基烯酰胺不对称转移氢化反应以Scheme 9所示机理进行,其中芳基烯酰胺在酸性条件形成亚胺离子中间体是反应循环的限速步骤,廉价的乙酸可以加速亚胺离子中间体的形成,但不能活化亚胺离子的氢转移反应,该步反应由催化量的强Brϕnsted酸——手性磷酸(S)-1c活化,确保产物具有高的对映选择性。反应过程中乙酸与手性磷酸协同配合,使反应快速、高立体选择性的顺利进行。

Scheme 8
Scheme 9

Scheme 10
然而,以Hantzsch酯、2-芳基苯并噻唑啉等化合物作为有机供氢体时,通常需要加入大于当量氢源,不符合原子经济性的要求,也限制了该类反应的工业化进程,因此研究开发可再生仿生氢源具有重要实际意义。
周永贵课题组[4]发现钌配合物在氢气存在下可以还原Hantzsch吡啶为Hantzsch酯,实现Hantzsch酯的再生。基于这一发现,研究者利用催化量的Hantzsch吡啶(14)为氢源,在手性磷酸(S)-1d与1.25 mol%钌配合物接力催化下,顺利实现了苯并恶嗪酮的不对称转移氢化反应,ee值高达99%(Scheme 10)。该课题组[36]还发现二氢菲啶(DHPD)可作为一种新型更易于再生的氢源,使得C=N键的不对称转移氢化反应在更温和的条件下进行,从而有利于实现更多底物的高对映选择性还原(Scheme 11)。同样以DHPD为可再生氢源,Gong[37]课题组也以手性磷酸与钌配合物为催化剂,在温和条件下实现了含氮杂环化合物的不对称转移氢化反应。最近,周永贵课题组[30]发现吡咯并[1,2-a]喹喔啉(15)可在更温和的条件下加氢还原(Scheme 12),且催化量的还原产物16可作为手性磷酸催化的不对称转移氢化反应可再生氢源,保证反应的顺利进行。

Scheme 11
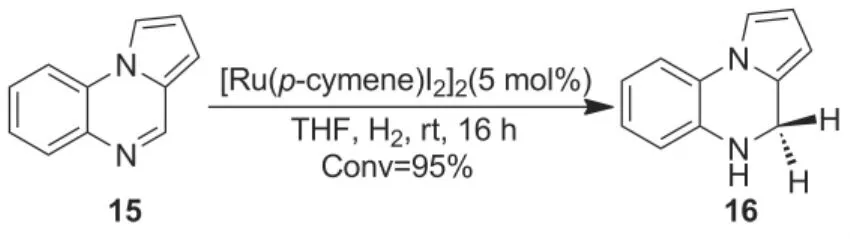
Scheme 12
2 2 -取代苯并噻唑啉类氢源
2009年,Akiyama课题组[5]首次采用抗氧化剂2-取代苯并噻唑啉作为氢源,实现了对手性磷酸催化的亚胺不对称转移氢化反应。研究者对实验条件进行了优化,发现以手性磷酸(R)-1a为催化剂、2-(2-萘基)苯并噻唑啉为氢源时,手性胺的ee值和收率分别高达98%和90%。研究者还以原位生成2-(2-萘基)苯并噻唑啉(17)为氢源,应用于相同的反应,产物的收率和ee值也分别达到了80%和96%。在优化条件,12例不同亚胺不对称转移氢化反应产物的ee值均在95%以上(Scheme 13)。

Scheme 13
Scheme 14

Scheme 15

Scheme 16
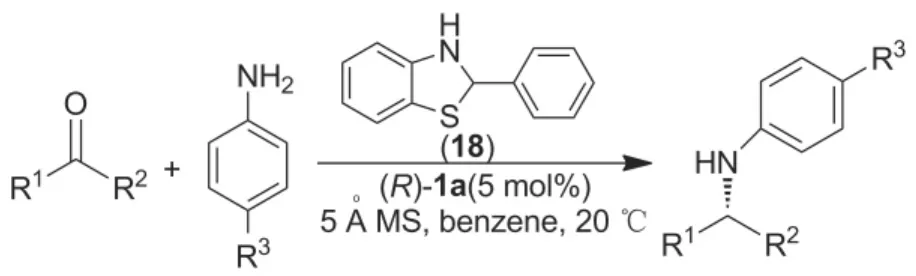
2012年,Akiyama课题组[38]以2-苯基苯并噻唑啉(18)为氢源,研究了BINOL衍生手性磷酸对原位生成亚胺不对称转移氢化反应的催化作用。结果表明,手性磷酸(R)-1a的催化效果最佳,且5Å分子筛对反应的顺利进行起着至关重要的作用,若体系中不加入5Å分子筛,反应不能进行,而加入5Å分子筛后,手性胺的收率和ee值分别提高到99%和98%(Scheme 14)。但研究者对5Å分子筛是怎么影响反应的没有作深入研究。
2014年,Akiyama课题组[6]以手性磷酸(R)-1a催化的乙基酮亚胺不对称转移氢化为模型反应,考察氢源对反应的影响(Scheme 15)。实验结果表明:当以2-取代苯并噻唑啉(19)作氢源时,手性胺产物的ee值(最高98%)远高于以Hantzsch酯(20)作氢源时的ee值(最高54%)。对此研究者通过计算机模拟计算的方法给予了说明,Hantzsch酯的取代基R不能有效的阻止反应中间体构型的转变,而2-取代苯并噻唑啉中2-位芳基的空间位阻效应明显,可使中间体保持某一种优势构型,从而高对映选择性地得到反应产物。
2013年Yamanaka小组[7]采用密度泛函数理论(DFT)计算,对2-苯基苯并噻唑啉(18)作氢源时,手性磷酸(R)-1a催化亚胺不对称转移氢化反应机理进行了研究。结果表明,手性磷酸在活化亚胺的同时与氢供体以氢键结合,形成环状过渡态(Scheme 16),与文献报道的Hantzsch酯作氢源时亚胺不对称转移氢化反应的机理[39-40]类似。
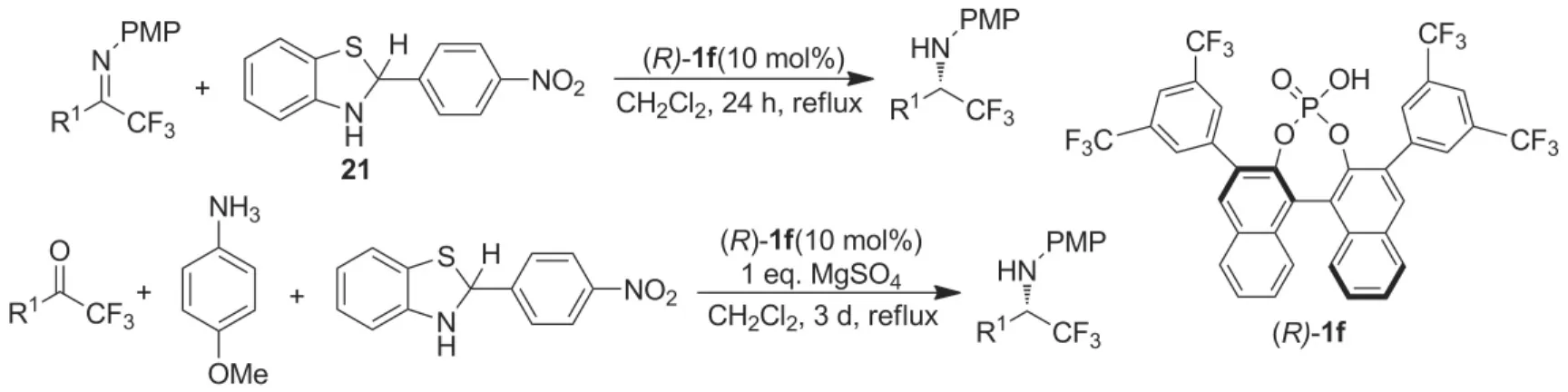
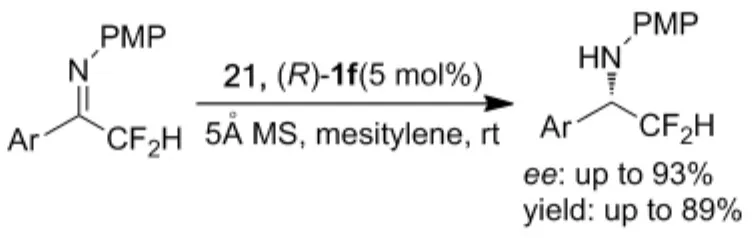
含氟亚胺的不对称转移氢化反应[41-42]和亚胺的不对称氘转移反应[43]是合成含有手性胺的具有特殊生理活性药物或功能分子的有效方法。例如:2011年Akiyama课题组[41]以2-(4-硝基苯基)苯并噻唑啉(21)为氢源,研究了手性磷酸(R)-1f催化三氟甲基酮亚胺的不对称转移氢化反应(Scheme 17)。结果表明:9种不同三氟甲基酮亚胺不对称转移氢化反应的产物ee值均大于96%。手性磷酸(R)-1f还可催化三氟甲基酮与芳胺原位生成亚胺的不对称转移氢化反应,但是需要比较长的反应时间(Scheme 17)[41]。利用该方法所合成的手性胺(22),经过两步无金属参与的反应即可高效、高立体选择性的得到拟钙药NPS R-568的类似化合物(S)-4(Scheme 18)。若用2-氘代-2-(4-硝基苯基)苯并噻唑啉(23)作为氘源,则可以得到同时含有三氟甲基和氘原子的手性胺分子,但是反应需要进行三天的时间,才可达到84%的收率、97%的ee值(Scheme 19)。2013年Akiyama课题组[42]同样以2-(4-硝基苯基)苯并噻唑啉(21)为氢源,手性磷酸(R)-1f催化条件下对二氟甲基酮亚胺的不对称转移氢化反应进行了研究,在温和的条件下,第一次合成了高对映选择性二氟手性胺(Scheme 20)。Akiyama课题组[43]随后对含氘原子手性胺的合成进行了系统研究,利用2-氘代-2-(萘基)苯并噻唑啉(24)为氘源,手性磷酸配体(R)-1a可在温和条件下,较短时间内高效催化酮亚胺和α-亚氨酯的不对称氘转移反应,氘代手性胺的最高收率和ee值均达到了99%以上(Scheme 21)。
Scheme 17

Scheme 18

Scheme 19
Scheme 20
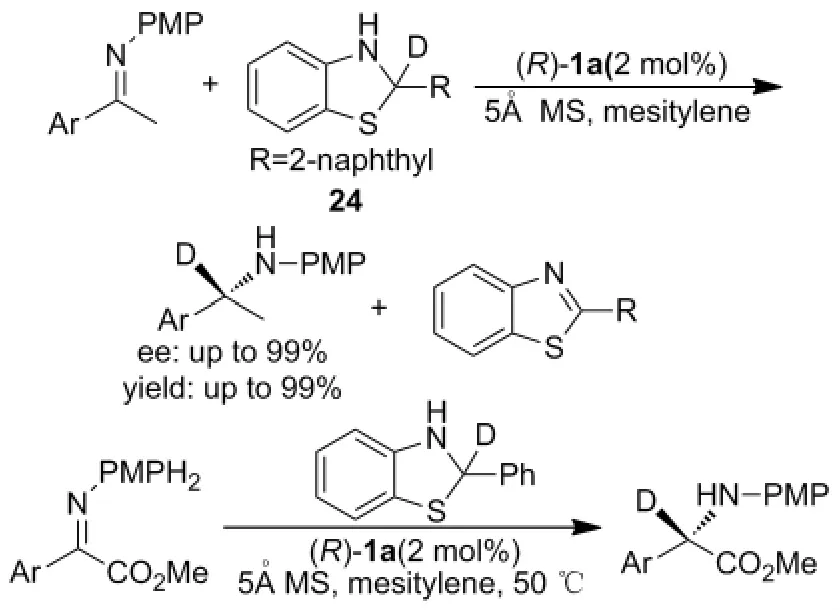
Scheme 21
3 其他氢源
通过外消旋仲醇脱氢动力学拆分生产前手性的酮和手性仲醇被称为氧化动力学拆分[44],相比之下,伴随着氧化亚胺过程仲胺的氧化动力学拆分有许多难点需要克服,首先,N原子很容易被氧化;其次,路易斯胺类底物容易使过渡金属催化剂失活。2013年,Akiyama课题组[45]用手性磷酸(R)-1a催化亚胺的不对称转移氢化反应中实现了2-取代二氢吲哚衍生物(25)的氧化动力学拆分。在整个反应过程中,S构型的二氢吲哚脱氢被氧化,R构型的产物得到富集,获得良好的收率和优秀的立体选择性(ee>99%)(Scheme 22)。
2014年,Akiyama课题组[46]在手性磷酸(R)-1a的催化下利用2-芳基二氢吲哚(26)作氢源,高立体选择性地实现了芳香酮亚胺的氢化(ee>99%)和脂肪酮的还原氨化(ee 97%),值得一提的是在整个反应中,2-芳基二氢吲哚可以通过2-芳基吲哚加氢实现循环再生,在锡粉和浓盐酸条件下,乙醇为溶剂,于80℃反应3 h,以92%的收率得到二氢吲哚(Scheme 23)。手性磷酸催化转移加氢过程中作为氢供体的2-芳基二氢吲哚比苯并噻唑啉更加稳定。
2011年周永贵和樊红军[47]共同发现了一个新颖的不对称歧化反应的收敛现象,在手性磷酸(S)-1c和钌配合物接力催化体系中,氢气存在条件下,喹喔啉(27)在0.5 mol%钌配合物催化加氢还原制得中间体二氢喹喔啉(28),二氢喹喔啉在手性磷酸(S)-1d催化剂下发生不对称歧化反应,最终手性产物四氢喹喔啉(29)的收率和ee值分别达到98%和94%。反应的高对映选择性归结于主反应的速率k2明显大于钌催化的副反应速率k3(Scheme 24)。该反应以氢气作为氢源,是一个原子经济性反应。
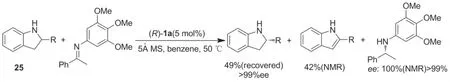
Scheme 22

Scheme 23

Scheme 24

Scheme 25
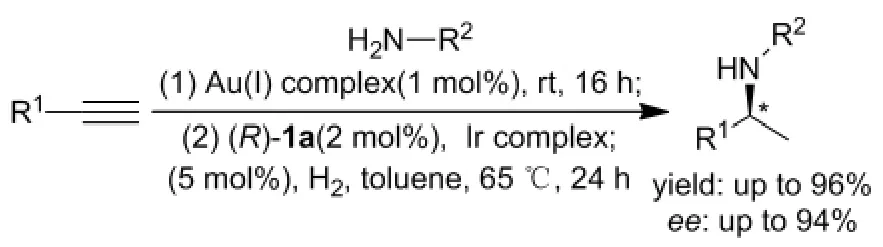
Scheme 26
2014年Zhao课题组[48]开发了一种新的在手性铱化合物和手性磷酸(R)-1a共同催化下实现醇及醇胺的氨基化的方法。该方法利用叔戊醇(30)作氢源同时作溶剂,回流条件下,合成高对映选择性的手性苯胺类化合物以及N-杂环化合物,获得高达98%的收率和97%的ee值(Scheme 25)。另外,实验结果也表明手性铱化合物是决定手性胺产物构型的决定性因素。
2012年Beller课题组[49]利用手性磷酸(R)-1a,在H2作还原剂,甲苯作溶剂,于65℃直接有效的实现端炔和伯胺的原位氢胺化反应,以94% 的ee值和96%的收率分离得到相应的手性胺产物(Scheme 26)。实验表明,脂肪族胺类和苯胺类邻位有吸电子集团时,在最优条件下不反应,而且二级胺同样只能得到产率25%的外消旋产物。
4 总结
由此可见,近年来BINOL衍生手性磷酸在亚胺的不对称转移氢化取得了长足发展,各种新的不对称催化方法和策略被开发并得到成功应用,各种特殊及挑战性亚胺底物的氢化也获得突破性进展。然而,亚胺的不对称转移氢化反应依然存在着手性磷酸催化剂的用量通常较大和氢源供体用量大等问题。因此,设计开发高活性的手性磷酸催化剂,降低其用量,是今后的研究方向之一;手性磷酸与金属催化剂结合,是近年来发展的一种高效、高选择性的不对称催化新方法,科研人员们在这方面已经作出开创性的工作[16,50-53],研究开发可高效催化亚胺的不对称转移氢化反应的手性磷酸-金属催化体系以及实现该类催化剂的分离回收、循环使用,也是非常有意义的一个研究方向;开发高效、再生氢源,也是未来亚胺不对称转移氢化反应的一个研究方向。
参考文献
[1]Parmar D,Sugiono E,Raja S,et al.Complete field guide to asymmetric BINOL-phosphate derived Brϕnsted acid and metal catalysis:History and classifi cation by mode of activation; Brϕnsted acidity,hydrogen bonding,ion pairing,and metal phosphates[J].Chem Rev,2014,114:9047-9153.
[2]苏亚军,史福强.手性磷酸在不对称反应中的应用[J].有机化学,2010,30(4):486-498.
[3]Cai X F,Guo R N,Feng G S,et al.Chiral phosphoric acid-catalyzed asymmetric transfer hydrogenation of quinolin-3-amines[J].Org Lett,2014,16:2680-2683.
[4]Chen Q A,Chen M W,Yu C B,et al.Biomimetic asymmetric hydrogenati on:In situ regenerable hantzsch esters for asymmetric hydrogenati on of benzoxazinones [J].J Am Chem Soc,2011,133:16432-16435.
[5]Zhu C,Akiyama T.Reducing agent for the enantioselective organocatalytic transfer hydrogenation of ketimines[J].Org Lett,2009,11(18):4180-4183.
[6]Saito K,Horiguchi K,Shibata Y,et al.Chiral phosphoric-acid-catalyzed transfer hydrog enation of ethyl ketimine derivatives by using benzothiazoline[J].Chem Eur J,2014,20:7616-7620.
[7]Shibata Y,Yamanaka M.DFT study of the mechanism and origin of enantioselectivity in chiral binol-phosphoric acid catalyzed transfer hydrogenation of ketimine and α-imino ester using benzothiazoline[J].J Org Chem,2013,78:3731-3736.
[8]He Y W,Lin M H,Li Z M,et al.Direct synthesis of chiral 1,2,3,4-tetrahydropyrrolo[1,2-a]pyrazines via a catalytic asymmetric intramolecular aza-friedel crafts reaction[J].Org Lett,2011,13(17):4490-4493.
[9]Zhang J W,Xu Z,Gu Q,et al.Chiral counteraniondirected silver-catalyzed asymmetric synthesis of 1,2-dihydroisoquinolines by friedel-crafts alkylation reactions[J].Tetrahedron,2012,68:5263-5268.
[10]Osorio-Planes L,Rodrguez-Escrich C,Pericàs M A.Enantioselective continuous-flow production of 3-indolylmethanamines mediated by an immobilized phosphoric acid catalyst[J].Chem Eur J,2014,20:2367-2372.
[11]Fu A P,Meng W,Li H L,et al.A density functional study of chiral phosphoric acid-catalyzed direct arylation of trifluoromethyl ketone and diarylation of methyl ketone:Reaction mechanism and the important role of the CF3group[J].Org Biomol Chem,2014,12:1908-1918.
[12]Li G L,Kaplan M J,Wojtas L,et al.Chiral phosphoric acid catalyzed addition of dihydropyrans to nacyl imines:Stereocontrolled access to enantioenriched spirocyclic oxazoletetrahydropyrans with three contiguous stereocenters[J].Org Lett,2010,12(9):1960-1963.
[13]Kashikura W,Mori K,Akiyama T.Chiral phosphoric acid catalyzed enantioselective synthesis of β-amino-α,α-aifluoro carbonyl compounds[J].Org Lett,2011,13(7):1860-1863.
[14]Zhang H,Wen X J,Gan L H,et al.Highly efficient asymmetric mannich reaction of dialkyl α-diazomethylphosphonates with n-carbamoyl imines catalyzed bychiral brϕnsted acids[J].Org Lett,2012,14(8):2126-2129.
[15]Abels F,Lindemann C,Koch E,et al.A general organocatalytic approach toward the enantioselective total synthesis of indolizidine based alkaloids[J].Org Lett,2012,14(23):5972-5975.
[16]Cai Q,Liang X W,Wang S G,et al.Ring-closing metathesis/isomerization/pictet spengler cascade via ruthenium/chiral phosphoric acid sequential catalysis [J].Org Lett,2012,14(19):5022-5025.
[17]Gregory A W,Jakubec P,Turner P,et al.Gold and BINOL-phosphoric acid catalyzed enantioselective hydroamination/n-sulfonyliminium cyclization cascade [J].Org Lett,2013,15(17):4330-4333.
[18]Aillaud I,Barber D M,Thompson A L,et al.Enantioselective Michael addition/iminium ion cyclization cascades of tryptamine-derived ureas[J].Org Lett,2013,15(12):2946-2949.
[19]Cai Q,Liang X W,Wang S G,et al.An olefin isomerization/asymmetric pictet-spengler cascade via sequential catalysis of ruthenium alkylidene and chiral phosphoric acid[J].Org Biomol Chem,2013,11:1602-1605.
[20]Momiyama N,Konno T,Furiya Y,et al.Design of chiral bis-phosphoric acid catalyst derived from(R)-3,3'-di(2-hydroxy-3-arylphenyl)binaphthol:Catalytic enantioselective diels alder reaction of α,β-unsaturated aldehydes with amidodienes[J].J Am Chem Soc,2011,(133):19294-19297.
[21]He L,Bekkaye M,Retailleau P,et al.Chiral phosphoric acid catalyzed inverseelectron-demand azadiels alder reaction of isoeugenol derivatives[J].Org Lett,2012,14(12):3158-3161.
[22]He L,Laurent G,Retailleau P,et al.Highly enantioselective aza-diels-alder reaction of 1-azadienes with enecarbamates catalyzed by chiral phosphoric acids [J].Angew Chem Int Ed,2013,52:11088-11091.
[23]Tian X,Hofmann N,Melchiorre P.Asymmetric vinylogous Diels-Alder reactions catalyzed by a chiral phosphoric acid[J].Angew Chem Int Ed,2014,53:2997-3000.
[24]Zheng C,You S L.Transfer hydrogenation with Hantzsch esters and related organic hydride donors[J].Chem Soc Rev,2012,41:2498-2518.
[25]Yu Z K,Jin W W,Jiang Q B.Brϕnsted acid activation strategy in transition-metal catalyzed asymmetric hydrogenation of n-unprotected imines,enamines,and n-heteroaromatic compounds[J].Angew Chem IntEd,2012,51:6060-6072.
[26]冯翠兰,徐海云,耿凤华.BINOL衍生手性磷酸在傅克反应中的应用进展[J].广州化工,2011,39(11):16-18.
[27]Chen M W,Cai X F,Chen Z P,et al.Facile construction of three contiguous stereogenic centers via dynamic kinetic resolution in asymmetric transfer hydrogenation of quinolines[J].Chem Commun,2014,50:12526-12529.
[28]Guo R N,Chen Z P,Cai X F,et al.Asymmetric transfer hydrogenation of 3-(trifluoromethyl)quinolines[J].Synthesis,2014,46:2751-2756.
[29]Cai X F,Chen M W,Ye Z S,et al.Asymmetric transfer hydrogenation of 3-nitroquinolines:Facile access to cyclic nitro compounds with two contiguous stereocenters[J].Chem Asian J,2013,8:1381-1385.
[30]Chen Z P,Chen M W,Guo R N,et al.4,5-Dihydropyrrolo[1,2-a]quinoxalines:A tunable and regenerable biomimetic hydrogen source[J].Org Lett,2014,16:1406-1409.
[31]时磊,姬悦,黄文学,等.基于手性负离子置换策略的异喹啉不对称转移氢化研究[J].化学学报,2014,72:820-824.
[32]Rueping M,Stoeckel M,Sugiono E,et al.Asymmetric metal-free synthesis of fluoroquinolones by organocatalytic hydrogenation[J].Tetrahedron,2010,66:6565-6568.
[33]Nguyen T B,Bousserouel H,Wang Q,et al.Chiral phosphoric acid-catalyzed enantioselective transfer hydrogenation of ortho-hydroxyaryl alkyl n-h ketimines [J].Org Lett,2010,12(20):4705-4707.
[34]Han Z Y,Xiao H,Gong L Z.Dynamic kinetic asymmetric transfer hydrogenation of racemic 2,4-diaryl-2,3-dihydrobenzo[b][1,4]diazepines catalyzed by chiral phosphoric acids[J].Bioorg Med Chem Lett,2009,19:3729-3732.
[35]Li G L,Antilla J C.Highly enantioselective hydrogenation of enamides catalyzed by chiral phosphoric acids[J].Org Lett,2009,11(5):1075-1078.
[36]Chen Q A,Gao K,Duan Y,et al.Dihydrophenanthridine:A new and easily regenerable nad(p)h model for biomimetic asymmetric hydrogenation[J].J Am Chem Soc,2012,134:2442-2448.
[37]Shi F,Gong L Z.Relay catalysis enables hydrogen gas to participate in asymmetric organocatalytic hydrogenation[J].Angew Chem Int Ed,2012,51:11423-11425.
[38]Saito K,Akiyama T.Enantioselective organocatalytic reductive amination of aliphatic ketones by benzothiazoline as hydrogen donor[J].Chem Commun,2012,48:4573-4575.
[39]Simoón L,Goodman J M.Theoretical study of the mechanism of Hantzsch ester hydrogenation of imines catalyzed by chiral binol-phosphoric acids[J].J Am Chem Soc,2008,130:8741-8747.
[40]Marcelli T,Hammar P,Himo F.Origin of enantioselectivity in the organocatalytic reductive amination of a-branched aldehydes[J].Adv Synth Catal,2009,351:525-529.
[41]Henseler A,Kato M,Mori K,et al.Chiral phosphoric acid catalyzed transfer hydrogenation:Facile synthetic access to highly optically active trifluoromethylated amines[J].Angew Chem Int Ed,2011,50:8180-8183.
[42]Sakamoto T,Horiguchi K,Saito K,et al.Enantioselective transfer hydrogenation of difluoromethyl ketimines using benzothiazoline as a hydrogen donor in combination with a chiral phosphoric acid[J].Asian J Org Chem,2013,2:943-946.
[43]Sakamoto T,Mori K,Akiyama T.Chiral phosphoric acid catalyzed enantioselective transfer deuteration of ketimines by use of benzothiazoline as a deuterium donor:synthesis of optically active deuterated amines [J].Org Lett,2012,14(13):3312-3315.
[44]张月成,赵姗姗,米国瑞,等.仲醇的氧化动力学拆分[J].化学进展,2012,24(2/3):212-224.
[45]Saito K,Shibata Y,Yamanaka M,et al.Chiral phosphoric acid-catalyzed oxidative kinetic resolution of indolines based on transfer hydrogenation to imines[J].J Am Chem Soc,2013,135:11740-11743.
[46]Saito K,Miyashita H,Akiyama T.Asymmetric transfer hydrogenation of ketimines by indoline as recyclable hydrogen donor[J].Org Lett,2014,16:5312-5315.
[47]Chen Q A,Wang D S,Zhou Y G,et al.Convergent asymmetricdisproportionationreactions:Metal/brϕnsted acid relay catalysis for enantioselective reduction of quinoxalines[J].J Am Chem Soc,2011,133:6126-6129.
[48]Zhang Y,Lim C S,Sim D S B,et al.Catalytic enantioselective amination of alcohols by the use of borrowing hydrogen methodology:Cooperative catalysis by iridium and a chiral phosphoric acid[J].Angew Chem Int Ed,2014,53:1399-1403.
[49]Fleischer S,Werkmeister S,Zhou S L,et al.Consecutive intermolecular reductive hydroamination:Cooperativetransition-metal and chiral brϕnsted acid ca-talysis[J].Chem Eur J,2012,18:9005-9010.
[50]Wu H,He Y P,Gong L Z.Direct access to enantioenriched spiroacetals through asymmetric relay catalytic three-component reaction[J].Org Lett,2013,15:3460-463.
[51]Liu B,Liu T Y,Luo S W,et al.Asymmetric hetero -Diels-Alder reaction of diazenes catalyzed by chiral silver phosphate:Water participates in the catalysis and stereocontrol[J].Org Lett,2014,16:6164-6167.
[52]Tao Z L,Zhang W Q,Chen D F,et al.Pd-catalyzed asymmetric allylic alkylation of pyrazol-5-ones with allylic alcohols:The role of the chiral phosphoric acid in C-O bond cleavage and stereocontrol[J].J Am Chem Soc,2013,135:9255-9258.
[53]Han Z Y,Chen D F,Wang Y Y,et al.Hybrid metal/organo relay catalysis enables enynes to be latent dienes for asymmetric Diels-Alder reaction[J].J Am Chem Soc,2012,134:
Research Progress on Asymmetric Transfer Hydrogenation of Imines Catalyzed by Chiral BINOL-Phosphoric Acid
LI Zhen1,2,FENG Cui-lan2,HEI Li-ying1,2,GUI Jian-zhou1,LIU Dao-sheng1
(1.College of Chemistry and Material Science,Liaoning University of Petroleum&Chemical
Technology,Fushun 113000,China; 2.College of Chemistry and Chemical Engineering,Shangqiu Normal University,Shangqiu 476000,China)
Abstract:Research progress on asymmetric transfer hydrogenation of imines catalyzed by chiral BINOL-phosphoric acid were reviewed with 53 references.Based on the difference of three organic hydrogen donors——Hantzsch ester hydrogen source,2-substituted benzothiazole moiety hydrogen source and other hydrogen source,asymmetric transfer hydrogenation reactions of imines catalyzed by phosphoric acids were discussed in detail.
Keywords:BINOL; chiral phosphoric acid; imine; asymmetric transfer hydrogenation; review
作者简介:李珍(1988-),女,汉族,河南周口人,硕士研究生,主要从事绿色有机催化反应研究。E-mail:lizhenyjhx@163.com
基金项目:国家自然科学基金资助项目(21102087);河南省科技厅科技攻关项目(112102210477);河南省高等学校青年骨干
收稿日期:2014-12-25;
修订日期:2015-08-20
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.11.1074 *
文献标识码:A
中图分类号:O622.6

