在烟草中过量表达大豆SGF14a增强转基因烟草对铝胁迫的耐受性
在烟草中过量表达大豆SGF14a增强转基因烟草对铝胁迫的耐受性
杨志丽, 郭传龙, 刘蕾, 武孔焕, 王琳, 李昆志, 赵艳, 陈丽梅
(昆明理工大学生命科学与技术学院生物工程技术研究中心,昆明650500)
摘要为了验证铝耐受型丹波黑大豆根尖14-3-3a基因(soybean 14-3-3a,SGF14a)在植物应答铝胁迫中的作用,本研究利用35S组成型启动子和大豆SGF14a的编码区构建植物表达载体pK-35S-SGF14a,在野生型(wild type,WT)烟草中过量表达SGF14a获得3个转基因株系(S11、S19和S23);并用50 μmol/L铝处理WT和转基因烟草,分析过量表达SGF14a对烟草铝耐受性的影响.结果表明:过量表达SGF14a的转基因烟草经铝胁迫处理后根的相对生长量比WT高约30%~40%;此外,在没有铝胁迫的正常生长条件下,3株转基因烟草根中可溶性蛋白的含量都比WT高,而用50 μmol/L铝胁迫24 h后WT烟草和3株转基因烟草根中可溶性蛋白的含量都下降,但转基因烟草根中可溶性蛋白含量仍显著高于WT,并且过量表达SGF14a还可显著提高过氧化物酶、过氧化氢酶以及抗坏血酸过氧化物酶的活性,降低铝胁迫下烟草根中过氧化氢(H2O2)的积累以及氧化胁迫的水平;同时,转基因烟草在低酸土壤中的生长状况也明显优于WT。这说明过量表达SGF14a可增强烟草对铝胁迫的耐受性及其适应酸性土壤生长的能力。
关键词14-3-3蛋白; 过量表达; 转基因烟草; 铝胁迫; 耐铝性
中图分类号Q 786文献标志码A
基金项目:国家自然科学基金(30970263)。
收稿日期(Received):2014-09-28;接受日期(Accepted):2015-02-03;网络出版日期(Published online):2015-05-19

Overexpression of soybeanSGF14aenhanced tolerance of transgenic tobacco plants to aluminum stress. Journal of ZhejiangUniversity(Agric. & LifeSci.), 2015,41(3):285-292
Yang Zhili, Guo Chuanlong, Liu Lei, Wu Konghuan, Wang Lin, Li Kunzhi, Zhao Yan, Chen Limei*(BiotechnologyResearchCenter,FacultyofLifeScienceandTechnology,KunmingUniversityofScienceandTechnology,Kunming650500,China)
SummaryApproximately 30% of the global arable land in the world is acidic soils (pH<5) and China’s acidic soil accounts for more than 21% of the area. Aluminum (Al) toxicity is a major limiting factor which limited crop production in acid soils. Al firstly inhibits the growth and development of plant roots. Consequently, it decreased the absorption of water and nutrients, which results in poor growth and production of plants. Therefore, in recent years, many researchers dedicated to study Al tolerance mechanisms and bred high Al-tolerant and acid soil-resistant crops by genetic engineering. 14-3-3 proteins are a group of highly conserved regulatory proteins found in eukaryotic cells, and have roles in regulating plant development and stress responses. A lot of 14-3-3 gene family members are isolated in different plants. 14-3-3 proteins regulate various physiological activities and functions by interacting with phosphorylated or non-phosphorylated target proteins in plants. The expression levels of certain 14-3-3 gene isoforms can be adjusted directly by environmental stimuli.
Our previous study showed that Al stress induced the expression of 14-3-3a (SGF14a) in the Al resistant soybean (Glycinemax) root tips. In order to further validate the role ofSGF14ain response to Al stress in plants, plant expression vectors ofSGF14awere constructed. Now, the 35S constitutive promoter was used to overexpressSGF14a. We constructed pK-35S-SGF14aplant expression vectors using gateway technology, then introduced theSGF14aexpression vectors intoAgrobacteriumpMP105, which was transformed into tobacco plants via transformation method. The plants were selected by genomic polymerase chain reaction (PCR), reverse transcriptase-PCR and Western blot analysis. Finally we got three transgenic lines (S11, S19, and S23). The wild type (WT) and transgenic tobacco plants (S11, S19, S23) were treated with 50 μmol/L Al to analyze the effect ofSGF14aoverexpression on the Al-resistance of tobacco. Changes of the relative root growth, H2O2, malondialdehyde (MDA), soluble protein contents as well as antioxidant enzyme activities in transgenic plants were compared.
The results showed that the relative root growth of the transgenic plants increased approximately 1.5-fold as compared with the WT. Moreover, the soluble protein contents in the transgenic tobacco roots increased significantly compared with the WT plants, and antioxidant enzyme activities (peroxidase, catalase, and ascorbate peroxidase) in roots of transgenic tobacco plants also increased when exposed to 50 μmol/L Al. Moreover, the H2O2accumulation and oxidative stress level in transgenic tobacco roots were reduced under the Al stress. The growth status of the transgenic tobacco was better than that of WT when grown in acidic soil.
In summary, the evidences suggest that overexpression ofSGF14aan enhance the Al-tolerance of transgenic tobacco and its ability to adapt to acidic soil.
Key words14-3-3 protein; overexpression; transgenic tobacco; aluminum stress; aluminum tolerance
14-3-3蛋白能与磷酸化的靶蛋白相互作用从而调节很多生物过程,如代谢、生长、发育和信号传导途径[1]。很多研究结果证明植物14-3-3蛋白通过参与赤霉素(gibberellin)、脱落酸(abscisic acid)和乙烯(ethylene)等激素信号通路来调控植物生长发育过程[1]。14-3-3蛋白对植物体内物质代谢也有重要的调控作用,它通过调节硝酸还原酶(nitrate reductase)、蔗糖磷酸合成酶(sucrose phosphate synthase)和谷氨酰胺合成酶(glutamine synthetase)等代谢酶的活性来调控植物体内碳氮代谢过程[2]。此外,14-3-3蛋白还通过调节质膜中的K+泵和质膜H+-ATP酶(plasma membrane H+-ATPase,PM H+-ATPase)的活性来维持细胞内外电化学梯度,调控植物体内的物质运输和气孔开闭等[1]。
很多研究发现环境胁迫的刺激能直接改变14-3-3基因的某一个特异异构型的表达水平,因此14-3-3蛋白能够参与植物对盐、磷缺乏、干旱、冷害和重金属等多种非生物胁迫和病原菌侵染等生物胁迫的应答[3]。ukaszewicz等[4]通过基因工程的手段改变14-3-3蛋白的表达来研究其功能,结果表明在马铃薯中过量表达14-3-3蛋白能够改变脂类、氨基酸和矿物质的组成,并且提高其抗氧化胁迫的能力,而抑制14-3-3蛋白的表达则出现相反的结果。在水稻中过量表达玉米的14-3-3基因(ZmGF14-6)后能够增强水稻的抗旱能力[5],在棉花中过量表达拟南芥的14-3-3基因(GF14λ)后能够使棉花保持“常青”的表型并增强棉花对干旱胁迫的耐受性[6]。通过反义技术抑制拟南芥14-3-3蛋白的表达,可促进叶片中淀粉的积累并增加转基因植物的生长[7]。
全世界大约有30%的可耕地属于酸性土壤,铝毒是酸性土壤中限制作物生长的主要因素之一[8]。铝毒早期最明显的症状是抑制根尖细胞生长和细胞分裂,从而抑制根的生长,导致根系损伤,影响水分和养分的吸收,限制植物的生长。低磷和铝胁迫均诱导拟南芥、羽扇豆、蚕豆和大豆中某些14-3-3异构型的表达[9-11]。本课题组[11]前期研究表明铝胁迫可诱导耐铝型丹波黑大豆(resistant soybean,RB)根尖14-3-3a基因(SGF14a)的表达,为了验证SGF14a在植物应答铝胁迫中的作用,本研究通过通路克隆技术(Gateway)构建SGF14a的植物表达载体,转化烟草产生SGF14a过量表达株系,考察过量表达大豆SGF14a对烟草铝耐受性的影响,为提高植物耐铝能力的基因工程手段操作提供基因资源和操作策略。
1材料与方法
1.1烟草的培养
野生型(wild type,WT)烟草种子(Nicotianatabacumcv. Xanthi)消毒后,播种于MS固体培养基(Murashige-Skoog media)中,待种子发芽后进行继代培养,获得无菌烟草幼苗用于转基因操作。
1.2植物表达载体的构建
本研究利用通路(Gateway)克隆技术构建目的基因SGF14a的植物表达载体,构建策略如图1所示。首先根据GenBank数据库上发表的大豆14-3-3a基因(SGF14a)的cDNA编码区序列设计上游特异引物P1:5′-AAGCTTATGTCGGATTCTTCTC GGGAGGAG-3′(含HindⅢ酶切位点)和下游特异引物P2:5′-CTCGAGCTATTCACCTGGTTGTT GCTTAGAT-3′(含XhoⅠ酶切位点),然后提取RB大豆根总RNA,反转录为cDNA。以反转录的cDNA为模板,用带有合适酶切位点的SGF14a基因上、下游引物进行PCR扩增,获得SGF14a基因cDNA编码区全长DNA片段,然后亚克隆于TA克隆载体pMD18-T(大连宝生物有限公司)中获得pMD18T-SGF14a载体,对获得的阳性克隆进行测序,检测外源基因SGF14a是否发生突变,再用HindⅢ和XhoⅠ双酶切pMD18T-SGF14a和Gateway的入门载体pENTR(购于美国Invitrogen公司),将SGF14a基因cDNA编码区亚克隆到pENTR载体上,产生入门克隆载体pENTR-SGF14a。最后进行LR反应,(含有attL的入门克隆和attR位点的目的载体DNA分子发生重组反应),在LR重组酶的作用下,入门克隆载体pENTR-SGF14a和表达载体pK2GW7(购自比利时VIB/Gent公司)进行LR反应,发生重组反应产生SGF14a的植物表达载体,简称pK-35S-SGF14a。LR反应按照LR反应试剂盒(LR ClonaseTMplus enzyme mix)(Invitrogen公司)说明书进行,反应混合液混匀后于25 ℃反应过夜,转化大肠埃希菌感受态细胞DH5(购于天根生化科技有限公司),在含有50 μg/mL大观霉素(spectinomycin,Spe)的LB平板上筛选重组克隆,获得植物表达载体pK-35S-SGF14a。
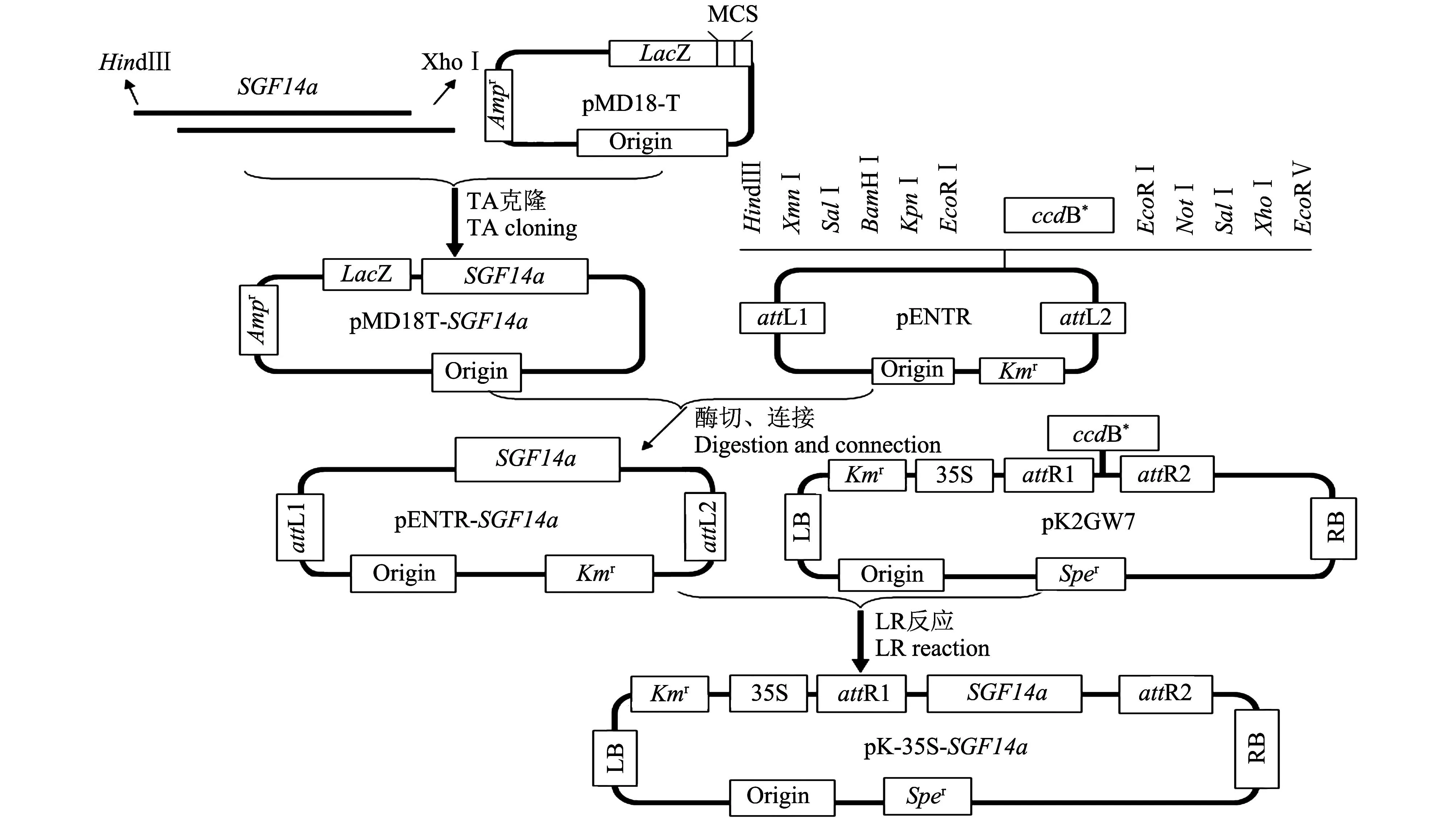
pMD18-T:TA克隆载体;pENTR:入门载体;pK2GW7:植物表达载体;(HindⅢ,XhoⅠ,XmnⅠ,SalⅠ,BamHⅠ,KpnⅠ,ExoRⅠ,NotⅠ,SalⅠ,EcoRⅤ):限制性酶切位点;(Amp r,Km r,Spe r):筛选标记基因;LacZ:报告基因;Origin:起始位点;35S:组成型启动子;(attR1、attR2和attL1、attL2):附着点(attachment site,att)的重组位点;ccdB *:负选择细菌病毒性基因;(RB和LB):右边界序列和左边界序列. pMD18-T: TA cloning vector; pENTR: Entry vector; pK2GW7: Plant expression vector; (HindⅢ, XhoⅠ, XmnⅠ,SalⅠ, BamHⅠ, KpnⅠ, ExoRⅠ, NotⅠ, SalⅠ, EcoRⅤ): Restriction enzyme sites; (Amp r, Km r, Spe r): Marker genes for plant selection; LacZ: Reporter gene; Origin: Initiation sites; 35S: Constitutive promoter; (attR1,attR2 and attL1, attL2): att recombination sites; ccdB *: Bacterial toxin gene for negative selection; (RB and LB): Right border sequence and left border sequence, respectively. 图1 植物表达载体pK-35S-SGF14a构建示意图 Fig.1 Diagram of the construction of plant expression vector pK-35S-SGF14a
1.3烟草的转化及转基因烟草的筛选
通过电转化法将植物表达载体pK-35S-SGF14a转入农杆菌中,在含有Spe的平板上筛选得到阳性克隆,经菌液PCR检测证实含有pK-35S-SGF14a的阳性克隆用于烟草的转化。通过农杆菌介导的叶盘转化法转染WT烟草,将转染后的叶片转移到含有卡那霉素(kanamycin,Km)和头孢噻肟钠(cefotaxine,Cef)的芽诱导培养基(MS4)上诱导外植体发芽,约15 d继代1次。待芽长大后从外植体上切下转入含Km和Cef的生根培养基上诱导根的生长,得到抗Km的烟草植株。
1.4转基因烟草的基因组PCR和逆转录PCR检测
用CTAB法从烟草叶片中提取基因组DNA作为模板,分别用SGF14a的上、下游特异引物进行PCR扩增,检测SGF14a在转基因烟草基因组中的整合情况。用试剂TRIzol®提取烟草根的总RNA,取3 μg的总RNA用逆转录酶(moloney murine leukemia virus reverse transcriptase,M-MLVRT)反转录合成cDNA,用SGF14a的上、下游特异引物进行逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR),以检测SGF14a的转录水平(TRIzol®试剂和M-MLVRT均购于大连宝生物有限公司)。
1.5蛋白质印迹法(Western blot)分析
用蛋白抽提液Tris-HCl 50 mmol/L,10%甘油,β-巯基乙醇10 mmol/L,苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)1 mmol/L,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)2 mmol/L,10%不溶性聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)提取烟草根的可溶性蛋白,通过考马斯亮蓝法(Bradford)测定蛋白含量,通过聚丙烯酰胺凝胶电泳(SDS-PAGE:12%分离胶和4%浓缩胶,每个泳道上样量为50g)分离蛋白,用半干式转膜仪将SDS-PAGE分离的蛋白转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用5%的脱脂奶粉常温封闭1 h,然后用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗PVDF膜3次,每次10 min;接着加入10L大豆14-3-3a蛋白兔抗体,与PVDF膜在常温下孵育2~3 h;用PBS清洗PVDF膜3次后,加入偶联有辣根过氧化物酶的羊抗兔二抗,常温孵育1 h;最后用高灵敏度化学发光检测试剂盒显示结果(羊抗兔二抗和高灵敏度化学发光检测试剂盒均购于康为世纪生物科技有限公司)。
1.6烟草的处理和根相对生长量测定
铝对植物的毒害作用最典型的症状表现在对根生长的抑制作用,因此通过测定根的生长量来分析烟草的铝耐受能力。WT和转基因烟草的组培苗水培2周,用pH 4.3的0.5 mmol/L CaCl2预处理过夜,记录根的长度,然后置于0和50 μmol/L的AlCl3溶液(含有0.5 mmol/L CaCl2,pH 4.3)中处理24 h,记录处理后的根长度,每个株系6个重复。根相对生长量/%=(处理后根长度-处理前根长度)/(对照处理后的根长度-对照处理前的根长度)×100。
1.7丙二醛和H2O2含量的测定
收集铝胁迫处理后烟草根组织,在液氮中磨碎后用Tirs-HCl(1 mol/L,pH 7.5)抽提,离心收集上清液。丙二醛(malondialdehyde,MDA)含量的测定参考Gurel等[12]的方法;H2O2含量的测定参考Gay等[13]的方法。
1.8抗氧化酶活性的测定
冻存的根尖用液氮充分研磨后,用蛋白抽提缓冲液(50 mmol/L Tris-HCl pH 7.4,甘油10%,巯基乙醇10 mmol/L,PMSF 1 mmol/L, EDTA 2 mmol/L,不溶性PVP 10%)提取可溶性蛋白,采用考马斯亮蓝法测定可溶性蛋白的含量。过氧化物酶(peroxidase,POD)活性测定参照Britton等[14]的愈创木酚方法。过氧化氢酶(catalase,CAT)活性测定按照Abei[15]的方法进行。抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性的测定采用Nakano等[16]的方法。
1.9烟草植株在低酸性土壤中的生长情况分析
将生长状况一致的WT和转基因烟草幼苗移栽到装有1 000 g(干质量)的酸性土壤(pH 4.8)中,每周浇水2次,在光照时间为12 h、光照强度约为1 200mol/(m2·s)的温室中培养3个月后观察生长状况并拍照。
1.10数据分析
所有的生理生化指标分析均进行3次重复。用ANOVA SPSS 17.0软件进行统计学和差异显著性分析。
2结果与分析
2.1SGF14a过量表达产生的转基因烟草株系
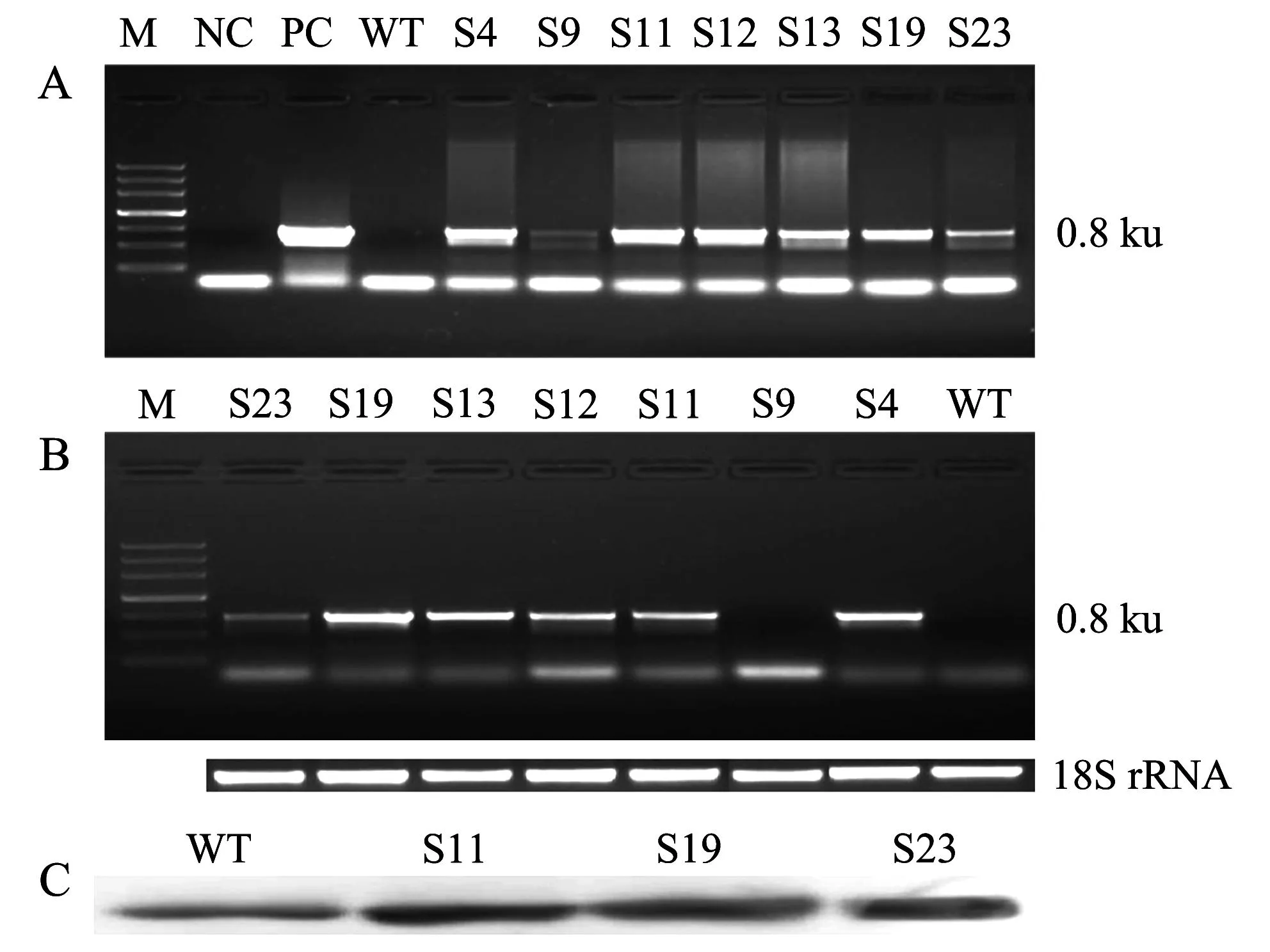
M:DNA分子标志物;NC:负对照(PCR体系中用去离子水进行PCR扩增);PC:正对照(以pK-35S-SGF14a质粒作为PCR模板);WT:野生型烟草;(S4、S9、S11、S12、S13、S19、S23):获得的不同转基因烟草株系编号;18S rRNA:内参基因. M: DNA marker; NC: Negative control (with deionized water as template for PCR ); PC: Positive control (with pK-35S-SGF14a as template for PCR); WT: Wild type tobacco plants; (S4, S9, S11, S12, S13, S19, S23): Serial numbers of transgenic tobacco plants; 18S rRNA: Internal reference gene. 图2 转基因烟草基因组PCR(A)、RT-PCR(B)和蛋白质印迹法(C)检测SGF14a基因的插入情况和转录水平 Fig.2 Genomic PCR (A), RT-PCR (B) and Western blot (C) analysis for detection of SGF14a integration and transcriptional levels in transgenic and wild type tobacco lines
利用大豆SGF14a的编码区构建植物表达载体pK-35S-SGF14a(图1),用pK-35S-SGF14a转化烟草获得具有Km抗性的转基因株系23个,以基因组DNA为模板,用SGF14a基因的特异性引物进行基因组PCR扩增,检测SGF14a基因在转基因烟草中的插入情况(图2A)。结果表明,在7个(S4、S9、S11、S12、S13、S19和S23)具有Km抗性的转基因烟草株系中能够扩增出与正对照相同的DNA片段(0.8 ku),而在负对照和WT中不能扩增出与正对照相同的DNA片段,说明在这7个转基因株系的基因组中有SGF14a基因插入。RT-PCR分析结果(图2B)表明,在WT中不能扩增出0.8 ku的SGF14acDNA片段,而在6个转基因株系中除S9株系外都扩增出0.8 ku的SGF14acDNA,说明在这5个转基因植株(S4、S11、S13、S19和S23)中SGF14a能够正常转录。选择3个(S11、S19和S23)转基因株系提取根的可溶性蛋白进行蛋白印迹法分析(Western blot)(图2C),结果在WT烟草中也检测出14-3-3蛋白的条带。这可能是因为WT烟草中本身的14-3-3蛋白与大豆14-3-3蛋白的同源性非常高,所以大豆14-3-3蛋白的抗体也能识别烟草的14-3-3蛋白所致。3个转基因株系14-3-3蛋白的表达量明显比WT烟草高,其中S11的表达量最高,S19和S23的表达量次之,说明在这3个转基因株系中有SGF14a的过量表达。
2.2过量表达SGF14a对转基因烟草铝耐受性的影响
为了考察转基因烟草对铝胁迫的耐受性,用50 μmol/L AlCl3处理S11、S19、S23转基因株系和WT无菌苗的根24 h后分析烟草根相对生长量(图3A),结果显示3个转基因烟草根相对生长量比WT的高30%~40%,说明SGF14a基因的过量表达能够增加烟草对铝胁迫的耐受性。可溶性蛋白的含量能够反映植物耐受环境非生物胁迫的程度,植物中可溶性蛋白含量越高,说明其耐受胁迫能力越强。从图3B可以看出:在没有铝胁迫的正常生长条件下,3个转基因烟草根中可溶性蛋白含量都比WT高,这说明过量表达SGF14a能够增加烟草根中可溶性蛋白的积累;在50 μmol/L铝胁迫24 h后,WT烟草和3个转基因烟草根中可溶性蛋白含量都下降,但3个转基因烟草根中可溶性蛋白含量仍然显著高于WT,说明在烟草中过量表达SGF14a能够增加可溶性蛋白的积累。
MDA含量反映了植物受胁迫后质膜的氧化程度,H2O2含量反映了胁迫后细胞内活性氧的积累。从图3D可以看出:在没有铝胁迫的正常生长条件下,WT烟草和3个转基因烟草根中MDA含量没有明显差别;50 μmol/L铝胁迫24 h使WT烟草和转基因烟草根中MDA含量上升,但3个转基因烟草根中MDA含量仍然低于WT烟草。从图3C可以看出:在正常生长条件下,转基因烟草根中H2O2的含量明显低于WT烟草,在铝胁迫后WT烟草和转基因烟草根中H2O2的积累都有所增加,但转基因烟草根中H2O2含量明显低于WT烟草。这说明在烟草中过量表达SGF14a可显著降低烟草根中H2O2的含量,减轻在铝胁迫下烟草根中H2O2的积累和膜脂肪过氧化程度。
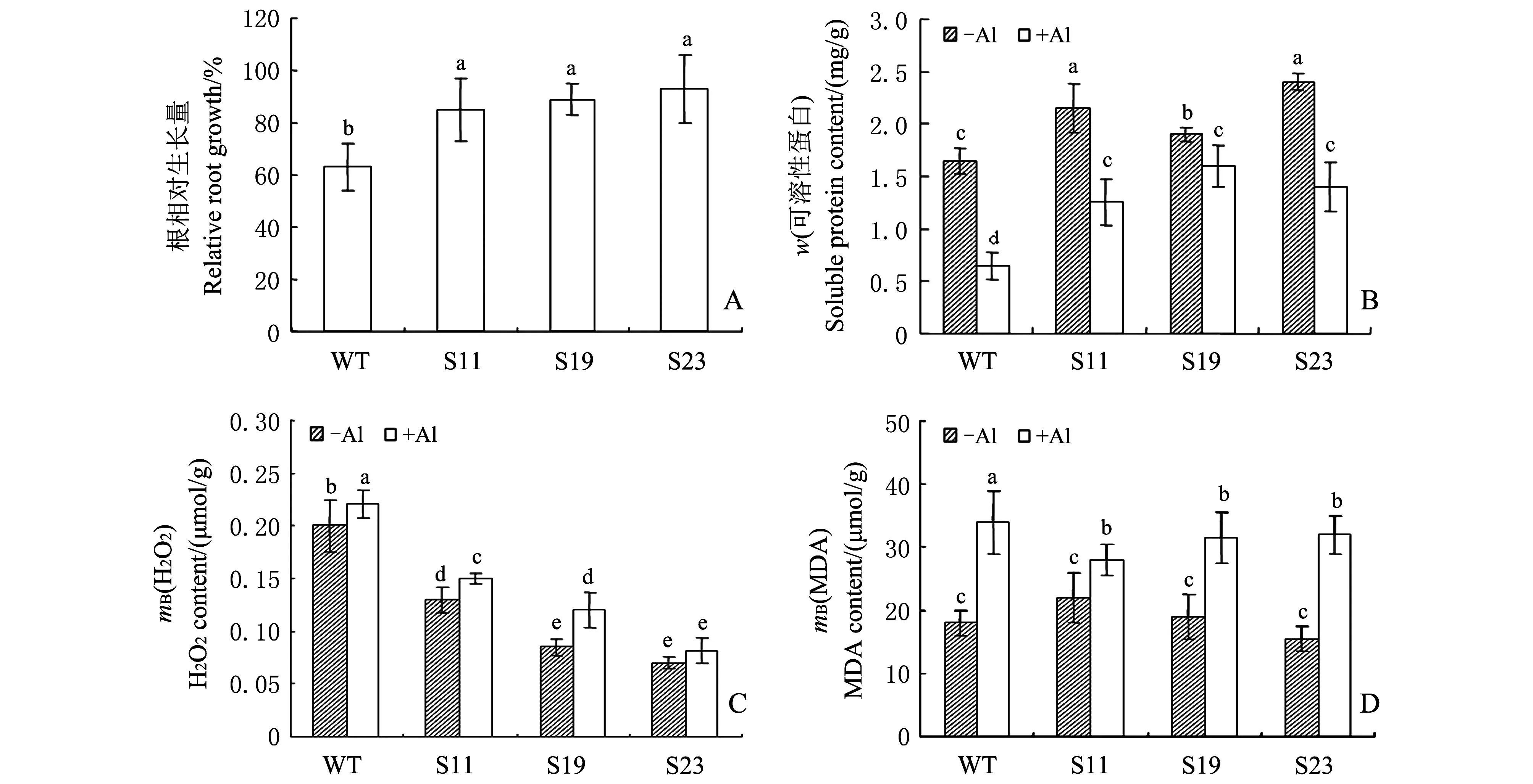
-Al:无铝处理组;+Al:50 μmol/L铝处理组。柱状图上不同小写字母表示在P<0.05水平差异有统计学意义. -Al: Without Al treatment; +Al: 50 μmol/L Al treatment. Different lowercase letters above bar graph indicate statistically significant differences at the 0.05 probability level. 图3 铝胁迫下WT和转基因烟草根中根相对生长量、可溶性蛋白、H 2O 2和MDA含量 Fig.3 Relative root growth and the contents of soluble protein, H 2O 2 and MDA in WT and transgenic tobacco lines under Al stress
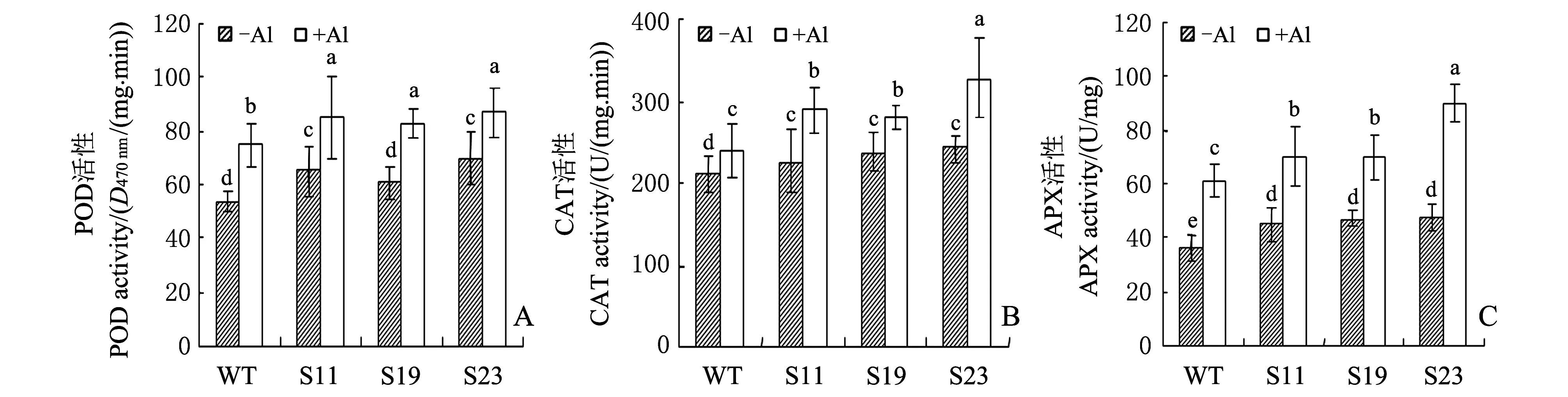
-Al:无铝处理组;+Al:50 μmol/L铝处理组。柱状图上不同小写字母表示在P<0.05水平差异有统计学意义. -Al:Without Al treatment; +Al: 50 μmol/L Al treatment. Different lowercase letters above bar graph indicate statistically significant differences at the 0.05 probability level. 图4 铝胁迫下WT和转基因烟草根中POD、CAT和APX活性 Fig.4 Activity of POD, CAT and APX in WT and transgenic tobacco lines under Al stress
2.3过量表达SGF14a对转基因烟草抗氧化酶活性的影响
14-3-3蛋白对抗氧化酶活性的调控作用已经在研究中得到证实[17],POD、CAT和APX是清除活性氧最重要的抗氧化物酶类,在植物抗氧化系统中发挥着重要作用。为考察过量表达SGF14a在铝胁迫下转基因烟草抗氧化酶活性的影响,测定了50 μmol/L铝胁迫24 h后转基因和WT烟草根中POD(图4A)、CAT(图4B)、APX(图4C)的活性。结果表明,在没有铝胁迫条件下,SGF14a过表达植株S11、S19、S23根中POD、CAT、APX活性均高于WT。铝胁迫导致WT和3个转基因株系根中POD、CAT、APX活性都升高,但3个转基因株系中这3种抗氧化酶活性都显著高于WT,这说明过量表达SGF14a能显著增加转基因烟草在铝胁迫下根中抗氧化酶的活性。
2.4过量表达SGF14a对烟草适应酸性土壤能力的影响
铝毒是酸性土壤中植物生长的重要限制因素,将S11、S19、S23转基因株系和WT的无菌苗移栽到酸性土壤中栽培,观察转基因植物生长表型的变化,结果发现3个转基因株系在酸性壤上的生长情况明显优于WT(图5)。在酸性土壤上生长的早期,3个转基因烟草植株的高度比WT高20%(图5A),在接近开花期,3个转基因烟草植株的高度比WT高25%~30%(图5B),说明在烟草中过量表达SGF14a可增加转基因烟草适应酸性土壤生长的能力。

图5 WT烟草和转基因烟草在酸性土壤中生长30 d(A)和90 d(B)的状况 Fig.5 Growth performance of WT and transgenic tobacco lines after 30 days (A) and 90 days (B) in the acidic soil
3讨论
以往的研究[7]表明大麦叶片14-3-3蛋白结合蛋白中有谷胱甘肽还原酶、抗氧化酶Mg-SOD、POD、APX等。在高等植物中,14-3-3蛋白与抗氧化酶APX的互作在植物应答盐胁迫过程中发挥重要作用,如在拟南芥中过量表达番茄的14-3-3蛋白TFT7可提高转基因植物APX的活性,在盐胁迫下转基因植物H2O2和MDA的含量显著低于WT,转基因植物抗盐能力显著增强[18]。在转基因水稻中通过RNAi干扰技术沉默14-3-3基因GF14e的表达,使抗氧化酶基因POX22.3的表达增强,过氧化物酶相关防御反应被激活,细胞壁物质的交联作用增强,限制病原体侵染,因而提高水稻对白叶枯病菌的抗性[19],这说明14-3-3蛋白对抗氧化酶的表达和活性有调控作用。植物体内H2O2含量的变化与抗氧化酶的表达水平或活性及抗氧化物质的含量有关,本研究在转基因烟草中过量表达RB的14-3-3蛋白使铝胁迫下转基因烟草根中3种清除H2O2的抗氧化酶活性显著高于WT,因此H2O2和MDA含量显著低于WT。这说明在转基因烟草根中过量表达RB的SGF14a可通过调控抗氧化酶的活性来降低根中H2O2的含量,由此提高烟草抗铝胁迫的能力。
本研究还观察到过量表达SGF14a可影响转基因烟草根中可溶性蛋白的含量。在无铝胁迫下,过量表达大豆SGF14a的转基因烟草根中积累的可溶性蛋白显著高于WT。Schoonheim等[7]的研究表明在大麦叶片14-3-3蛋白的结合蛋白中有核糖体结合蛋白、蛋白质翻译的起始因子6和延伸因子1a等,说明14-3-3蛋白参与了蛋白质合成的调控。可溶性蛋白的含量和植物的耐铝能力有关,有些耐铝植物在铝胁迫下通过增加可溶性蛋白的合成来缓解铝的毒性。过量表达14-3-3蛋白的转基因烟草在铝胁迫下根内积累的可溶性蛋白显著高于WT,这可能是转基因烟草耐铝能力增强的另一原因之一。
参考文献(References):
[1]Sehnke P C, DeLille J M, Ferl R J. Consummating signal transduction the role of 14-3-3 proteins in the completion of signal-induced transitions in protein activity.ThePlantCell, 2002,14:339-354.
[2]Comparot S, Lingiah G, Martin T.Function and specificity of 14-3-3 proteins in the regulation of carbohydrate and nitrogen metabolism.JournalofExperimentalBotany, 2003,54(382):595-604.
[3]Janicka-Russak M,Klobus G. Modification of plasma membrane and vacuolar H+-ATPase in response to NaCl and ABA.JournalofPlantPhysiology, 2007,164:295-302.
[5]Campo S, Peris-Peris C, Montesinos L,etal. Expression of the maizeZmGF14-6 gene in rice confers tolerance to drought stress while enhancing susceptibility to pathogen infection.JournalofExperimentalBotany, 2012,63(2):983-999.
[6]Yan J Q, He C X, Wang J,etal. Overexpression of theArabidopsis14-3-3 protein GF14λ in cotton leads to a “stay-green” phenotype and improves stress tolerance under moderate drought conditions.PlantandCellPhysiology, 2004,45(8):1007-1014.
[7]Schoonheim P J, Veiga H, da Costa Pereira D,etal. A comprehensive analysis of the 14-3-3 interactome in barley leaves using a complementary proteomics and two-hybrid approach.PlantPhysiology, 2007,143(2):670-683.
[8]Ma J F, Furukawa J. Recent progress in the research of external Al detoxification in higher plants: A minireview.JournalofInorganicBiochemistry, 2003,97(1):46-51.
[9]Tomasi N, Kretzschmar T, Espen L,etal. Plasma membrane H+-ATPase-dependent citrate exudation from cluster roots of phosphate-deficient white lupin.Plant,Cell&Environment, 2009,32(5):465-475.
[10]Chen Q, Guo C L, Wang P,etal. Up-regulation and interaction of the plasma membrane H+-ATPase and the 14-3-3 protein are involved in the regulation of citrate exudation from the broad bean (ViciafabaL.) under Al stress.PlantPhysiologyandBiochemistry, 2013,70:504-511.
[11]Guo C L, Chen Q, Zhao X L,etal. Al-enhanced expression and interaction of 14-3-3 protein and plasma membrane H+-ATPase is related to Al-induced citrate secretion in an Al-resistant black soybean.PlantMolecularBiologyReporter, 2013,31(4):1012-1024.
[12]Gurel A, Coskun O, Armutcu F,etal. Vitamin E against oxidative damage caused by formaldehyde in frontal cortex and hippocampus: Biochemical and histological studies.JournalofChemicalNeuroanatomy, 2005,29(3):173-178.
[13]Gay C A, Gebicki J M. Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method.AnalyticalBiochemistry, 2003,315(1):29-35.
[14]Britton C, Maehly A C. Assay of catalase and peroxidase.MethodsinEnzymology, 1955,59(2):764-775.
[15]Abei H.Catalaseinvitro.MethodsinEnzymology, 1984,105:121-126.
[16]Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts.PlantandCellPhysiology,1981,22(5):867-880.
[17]Lukaszewicz M, Matysiak-Kata I, Aksamit A,etal. 14-3-3 protein regulation of the antioxidant capacity of transgenic potato tubers.PlantScience, 2002,163:125-130.
[18]Xu W F, Shi W M. Mechanisms of salt tolerance in transgenicArabidopsisthalianaconstitutively overexpressing the tomato 14-3-3 protein TFT7.PlantandSoil, 2007,301(1/2):17-28.
[19]Manosalva P M, Bruce M, Leach J E. Rice 14-3-3 protein (GF14e) negatively affects cell death and disease resistance.ThePlantJournal, 2011,68(5):777-787.
*通信作者(Corresponding author):陈丽梅,Tel:+86-871-65920213;E-mail:chenlimeikm@126.com
第一作者联系方式:韩双,E-mail:sshuanghan@163.com
URL:http://www.cnki.net/kcms/detail/33.1247.s.20150519.1316.007.html

