实时荧光定量聚合酶链反应检测核桃根际土壤生防菌Bacillus amyloliquefaciens和Trametes versicolor的定殖
实时荧光定量聚合酶链反应检测核桃根际土壤生防菌Bacillusamyloliquefaciens和Trametesversicolor的定殖
郑磊, 张静, 彭燕, 麻文建, 朱天辉*
(四川农业大学林学院,四川 雅安 625014)
摘要以铁核桃根腐病为研究对象,运用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)扩增技术,分别对铁核桃根际土壤中解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和白腐菌(Trametes versicolor)2种生防菌及腐皮镰刀菌(Fusarium solani)病原菌的数量动态变化进行研究。结果表明:2种生防菌在接种后短期内都能够迅速生长繁殖,B. amyloliquefaciens相对含量在第20天达到峰值,20 d后呈下降趋势,40 d后趋于稳定,而T. versicolor在各时期的相对含量变化均较前者延迟10 d;60 d后,在施入B. amyloliquefaciens和T. versicolor的根际土壤中F. solani的相对含量极显著降低;在生防菌的相对含量达到峰值时,B. amyloliquefaciens与其对照组相比差异有统计学意义(P<0.05),T. versicolor则差异有高度统计学意义(P<0.01);定殖稳定后,B. amyloliquefaciens与其对照组相比差异无统计学意义(P>0.05),T. versicolor对照组与其相比差异有统计学意义(P<0.05),2种生防菌在铁核桃根际土壤中均有很强的生防效果和定殖能力,生防效果为B. amyloliquefaciens>T. versicolor,定殖能力为B. amyloliquefaciens>T. versicolor。该研究为由腐皮镰刀菌引起的病害实时监测提供了重要参考,同时为2种生防菌在土壤中的定殖检测提供了有力的技术支持。
关键词实时荧光定量聚合酶链反应; 腐皮镰刀菌; 解淀粉芽孢杆菌; 白腐菌
中图分类号Q 936; S 763.1文献标志码A
基金项目:国家自然科学基金(31260063;31260297)。
收稿日期(Received):2014-10-08;接受日期(Accepted):2015-02-03;网络出版日期(Published online):2015-05-19

Detection of real-time fluorescence quantitative polymerase chain reaction for colonization ofBacillusamyloliquefaciensandTrametesversicolorinJuglanssigllataDode rhizosphere soil. Journal of ZhejiangUniversity(Agric. & LifeSci.), 2015,41(3):277-284
Zheng Lei, Zhang Jing, Peng Yan, Ma Wenjian, Zhu Tianhui*(CollegeofForestry,SichuanAgriculturalUniversity,Ya’an625014,Sichuan,China)
SummaryJuglanssigllataDode, is widely planted in Liangshan Prefecture of southwest China for its nuts and wood. Liangshan Prefecture is a major traditional growing area ofJ.sigllataand has unique advantages for walnut industrial development because of its good soil, climate, and availability of water. Currently there are 2.7 million hectares of walnut, contributing important incomes for farmers. In April 2013, numerousJ.sigllatawere found to be infected with root rot in the Muli County of Liangshan Prefecture. Symptoms included dried leaves, dead branches, and even death. According to the cultural characteristics, the fungus was primarily identified asFusariumsolaniand it could cause the root rot on many industrial crops.Fusariumsolanicould be significantly antagonized byBacillusamyloliquefaciensandTrametesversicolor.
In order to control the plant diseases caused byF.solani,B.amyloliquefaciensandT.versicolorwere chosen for testing the efficiency of the colonization in rhizosphere soil ofJ.sigllata. With the development of real-time fluorescence quantitative polymerase chain reaction (PCR) technology, more attention was paid on this issue. It was highly efficient, sensitive and specific technology and had been widely used in various fields of scientific research. For the research of the root rot ofJ.sigllata, the dynamic changes of two kinds of biocontrol strains and the pathogen in rhizosphere soil were studied through the method of real-time fluorescence quantitative PCR.
The results showed that biocontrol strains multiplied rapidly after inoculation, and the relative content ofB.amyloliquefaciensreached the peak at the 20th day. Then, the relative content ofB.amyloliquefacienswas declined, and kept stable after the 40th day. But the time when the relative content ofT.versicolorshowed the growth peak and stabilization at each stage was delayed for 10 d as compared withB.amyloliquefaciens. After 60 days, the relative contents ofF.solaniin rhizosphere soil inoculated withB.amyloliquefaciensandT.versicolorwere reduced significantly when the relative content of biocontrol strains reached the peak. The difference in the content ofB.amyloliquefacienswas significant between the treatment with or without inoculatingB.amyloliquefaciens, while more distinctions of the content ofT.versicolorbetween the treatment with or without inoculatingT.versicolor. When the colonization was stabilized, the content ofB.amyloliquefacienshad no significant difference compared with the control, while the content ofT.versicolorwas significant between the two treatments.
All above indicate that the biocontrol efficiency and the colonization ability ofB.amyloliquefaciensare superior thanT.versicolor. This study can provide real-time monitoring of diseases caused byF.solaniand support the detection of the colonization ofB.amyloliquefaciensandT.versicolorin rhizosphere soil.
Key wordsreal-time fluorescence quantitative polymerase chain reaction;Fusariumsolani;Bacillusamyloliquefaciens;Trametesversicolor
腐皮镰刀菌(Fusariumsolani)可引起油橄榄根腐病[1]、黄豆根腐病[2]、菜豆根腐病[3]、龙蒿根腐病[4]、蓝莓根腐病[5]、甘薯根腐病[6]、芦荟根腐病[7]、乌拉尔甘草根腐病[8]等,还可引起一些植物的果实腐烂,如甜辣椒果腐病[9]。笔者于2013年4月在四川省凉山州木里县铁核桃(JuglanssigllataDode)种植区内发现由F.solani引起的大面积铁核桃根腐病,受到病原菌侵染的植株出现叶片干枯、枝条死亡,甚至有些2~3年生植株死亡[10]。目前,对于根腐病的防治主要以轮作换茬法、抗病育种法以及运用最为普遍的药剂防治法。由于我国土地资源紧缺,抗病品种的抗病能力维持时间不定且品种抗性与优质、丰产也未统一,最为广泛运用的药剂防治产生环境污染、农药残留以及农药抗性等问题也十分令人担忧,迄今为止还未找到有效地防治根腐病发生、发展的方法,因此,筛选有效的生防菌实用生物防治方法势在必行。
生防菌株的根际定殖情况直接影响到防治根腐病发生、发展的效果。近年来,实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)技术得到长足发展[11-12],并且在定量检测土壤微生物定殖研究领域得到广泛运用。Hagn等[13]根据木霉核糖体内源转录间隔区(internal transcribed spacers,ITS)序列进行比对分析的结果,设计出了木霉特异性引物,以此建立了木霉的实时荧光定量PCR检测体系,并利用该体系高效稳定地检测出土壤环境样品的木霉含量。Klein等[14]利用实时荧光定量的方法研究链霉菌属(Streptomycesspp.),发现其对镰刀属真菌病害具有良好的抑制作用。本研究采用实时荧光定量PCR技术检测了解淀粉芽孢杆菌(Bacillusamyloliquefaciens)和白腐菌(Trametesversicolor)在核桃根际土壤中定殖的动态变化以及对病原菌F.solani的防治效果,同时也为其他土传病害生防菌在土壤中的定殖检测研究提供技术支持。
1材料与方法
1.1菌株收集
T.versicolor于四川省广元市铁核桃苗圃土壤中分离纯化得到;B.amyloliquefaciens于四川省广元市铁核桃苗圃的铁核桃根内分离纯化得到;F.solani分离自四川省凉山州木里县铁核桃根内;其他供试菌株由本实验室提供。
1.2菌液的制备
B.amyloliquefaciens菌悬液:将已活化的B.amyloliquefaciens接种于营养琼脂(NA)固体培养基上培养24 h,用无菌水冲洗得到B.amyloliquefaciens的菌苔液,然后接种3 mL菌苔液于已灭菌的装有100 mL牛肉膏蛋白胨(LB)液体培养基的300-mL锥形瓶中,在25 ℃下140 r/min振荡培养72 h,后将其制成含菌量为2×105CFU/mL的菌悬液,待用。
F.solani和T.versicolor孢子悬液:将已活化的F.solani和T.versicolor接种于PDA培养基上,25 ℃培养7 d,收集分生孢子,用无菌水稀释成3×105CFU/mL的孢子悬液,待用。
1.3生防菌在核桃根际土壤中的定殖
供试所使用的健康、无病害、长势相同的铁核桃幼苗均购自四川省雅安园林花卉公司,盆栽于直径40 cm塑料盆内,2周后统一采用根部刺伤法接种病原菌孢子悬液使其染病,选取感病指数相同的铁核桃植株进行实验。生防菌株(T.versicolor和B.amyloliquefaciens)对铁核桃根际的侵染定殖采用灌根接种法[15]。分别取100 mL含菌量为3×105CFU/mL的B.amyloliquefaciens菌悬液和T.versicolor孢子悬液,在离土层3 cm处,从上到下,顺根茎浇灌发病和未发病的健康铁核桃植株根部,并以浇灌等量无菌水的感病植株为对照,每组处理10次重复。
1.4土壤取样
参照Yu等[16]的方法进行铁核桃根际土的取样。分别于引入生防菌后1、10、20、30、40、50和60 d取样。将不同处理的植株根从土壤中取出,用灭菌玻璃棒将大颗粒土壤去除,随后用力抖落根部附着土,将土样装入无菌密封袋中,每次土样约50 g,保存于4 ℃冰箱。
1.5DNA的提取和PCR扩增
1.5.1DNA的提取真菌的基因组DNA使用Biomiga公司生产的真菌DNA提取试剂盒(吸附柱型)提取。
细菌的基因组DNA提取使用Omega公司生产的细菌DNA提取试剂盒(吸附柱型)。
土壤总DNA的提取:将备用根际土按不同处理各自混匀,称取1 g土壤,使用美国Mpbio公司生产的土壤DNA提取试剂盒(吸附柱型)进行土壤总DNA提取。
1.5.2PCR扩增和测序F.solani和T.versicolor的PCR扩增:选用ITS1/ITS4(TCCGTAGG TGAACCTGGGG/TCCTCCGCTTATTGATATG C)[13]为引物,进行PCR扩增。反应体系:2×TaqPCR MasterMix 12.5 μL(TaKaRa),引物(200 nmol/L)ITS1/ITS4 0.25 μL,模板DNA 1 μL,用ddH2O补足体积至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸90 s,共进行30个循环;72 ℃延伸5 min。使用离心柱型琼脂糖凝胶DNA回收试剂盒(TaKaRa)对PCR产物纯化,并对PCR产物进行克隆测序。
B.amyloliquefaciensPCR扩增:选用细菌核糖体(16S)rDNA的通用引物27F/1492R(AGAGTTT GATCCTGGCTCAG/GGTTACCTTGTTACGACTT)进行PCR反应。反应体系同上,PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸90 s,共进行30个循环;72 ℃延伸8 min。PCR产物用PCR纯化试剂盒(TaKaRa)纯化、测序。
1.6实时荧光定量PCR
1.6.1引物设计根据1.5.2节的测序结果,用Primer Premier 5.0软件设计实时荧光定量PCR引物(表1),并用Oligo 7.0软件进行评价。内参选用Denman等[17]设计的总菌Generalbacteria特异性引物。引物由大连宝生物工程有限公司合成。
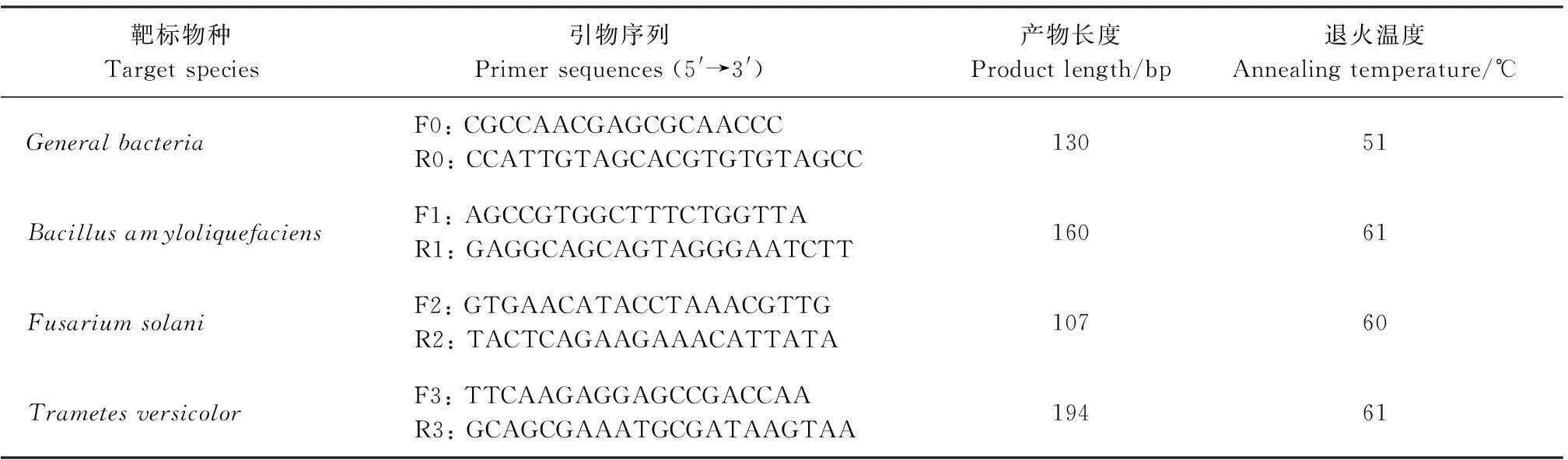
表1 引物设计信息
1.6.2特异性检测及标准曲线的建立以土壤总DNA为模板,利用表1所设计的特异性引物,进行总菌Generalbacteria、B.amyloliquefaciens、F.solani、T.versicolor的特异性扩增。PCR反应体系:SYBR®PremixExTaqTMⅡ 7.5 μL,上、下游引物各0.6 μL,DNA模板1.2 μL,用ddH2O补足体积至15 μL。PCR反应条件:95 ℃预变性30 s;95 ℃,5 s,各引物特异退火温度10 s,40个循环;以0.5 ℃/10 s的速度从65 ℃缓慢递增到95 ℃。所用实时荧光定量PCR系统为CFX96 System(Bio-Rad公司)。将PCR产物进行纯化,连接至pUC18T载体上,转化至大肠埃希菌中,挑取转化后平板上的白色单克隆提取质粒DNA。测定质粒DNA浓度,绘制标准曲线。
用所设计的特异性引物F1/R1、F2/R2、F3/R3对供试菌株(表2)的基因组DNA进行常规PCR以及实时荧光定量PCR扩增,进行特异性检测。
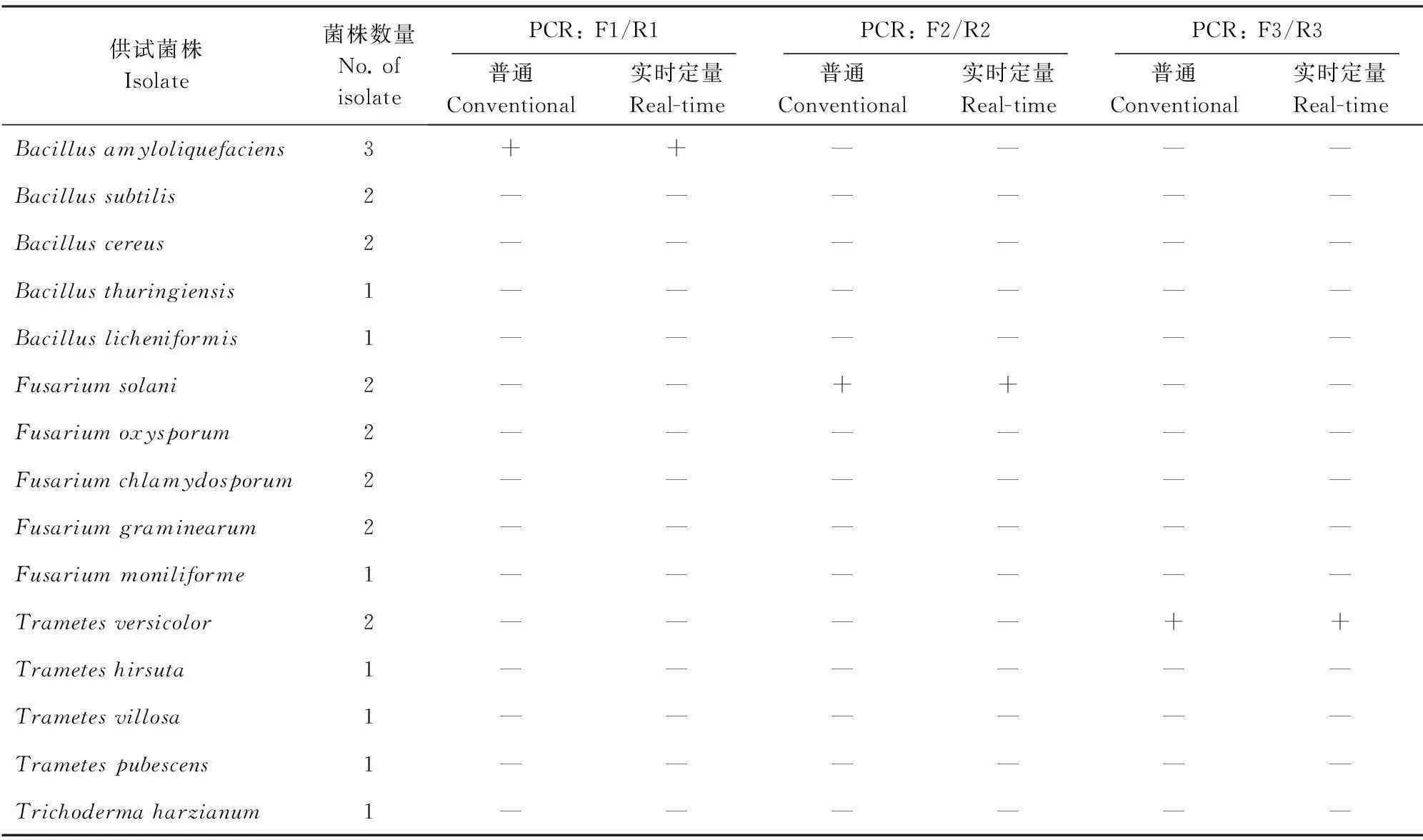
表2 供试菌株及各引物的特异性检测
+:阳性;—:阴性.
+: Positive; —: Negative.
1.6.3定量PCR扩增以所提取的土壤总DNA为模板,采用表1所设计的荧光定量引物进行PCR扩增,实验重复3次。反应体系与条件同1.6.2节。
1.7定量数据分析
荧光定量PCR结果用Bio-Rad IQTM5软件的比较CT法(2-ΔΔCT法)进行分析,并计算各目标菌株在根际土壤中的相对含量,采用SPSS 17.0软件进行显著性分析。
2结果
2.1特异性检测
用所设计的特异性引物F1/R1、F2/R2和F3/R3对供试菌株(表2)的基因组DNA进行常规PCR以及实时荧光定量PCR扩增,结果表明:B.amyloliquefaciens、F.solani和T.versicolor分别扩增出约160、110和190 bp的特异性条带,其他供试菌株均无扩增产物(表2),这说明所设计引物具有较强的特异性,可用于实时荧光定量PCR检测。
2.2标准曲线的建立
F.solani、B.amyloliquefaciens和T.versicolor的实时荧光定量PCR扩增曲线均为一组典型的倒S型曲线,扩增曲线基线平整,指数区明显且陡度大,平台区能汇于一起,线性范围较宽(图1A,B,C)。各个标准曲线的线性决定系数R2分别为0.996、0.999和0.998,具有较好的线性关系,扩增效率E分别为99.3%、95.1%和100.4%,在0.9~1.1之间,扩增效率理想;另外病原菌及生防菌的实时荧光定量PCR溶解曲线分别在60 ℃、61 ℃、61 ℃左右出现单一熔解峰,无引物二聚体及非特异性产物,曲线平稳,峰尖且窄,这说明各浓度质粒的熔解温度均一,扩增产物特异性好,以此为基础进行定量是可靠的。
内参Generalbacteria的实时荧光定量PCR扩增曲线为一组典型的倒S曲线,扩增曲线基线平整,指数区明显且陡度大,平台区能汇于一起,线性范围较宽(图1D)。该标准曲线的线性决定系数为0.999,具有较好的线性关系,扩增效率为92.0,在0.9~1.1之间,扩增效率理想。
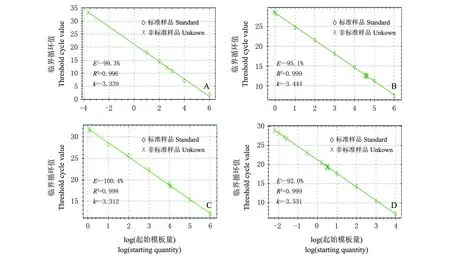
图1 F. solani (A)、B. amyloliquefaciens (B)、 T. versicolor (C)及内参(D)荧光定量PCR标准曲线 Fig.1 Standard curve chart of F. solani (A), B. amyloliquefaciens (B), T. versicolor (C) and General bacteria (D)
2.3生防菌对病原菌的影响及定殖
由图2可知,施入B.amyloliquefaciens后,铁核桃根际土壤中F.solani的相对含量随着时间的推移而显著降低(P<0.05);在10~30 d期间F.solani相对含量下降极为显著(P<0.01),即抑制作用最为明显;60 d后,F.solani的相对含量极显著降低,而不施入生防菌的根际土壤中F.solani的相对含量趋于平衡。由图3可知,将B.amyloliquefaciens的菌悬液施入感病植株与健康植株后,B.amyloliquefaciens在0~20 d繁殖迅速,20 d达到最高值,20 d 后呈下降趋势,40 d后稳定;在第10天和第20天处理组与对照组相比根际土壤中B.amyloliquefaciens的相对含量差异有统计学意义(P<0.05),而其他时间差异无统计学意义(P>0.05)。在定殖稳定后,B.amyloliquefaciens在感病与健康铁核桃根际土中相对含量大致相同。说明在有F.solani的土壤环境对其定殖影响较小。
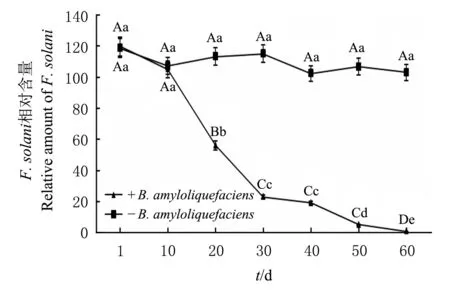
不同大、小写字母分别表示在P<0.01和P<0.05水平差异有统计学意义. Different capital and lowercase letters above the line graph indicate statistically significant differences at the 0.01 and 0.05 probability levels, respectively. 图2 B. amyloliquefaciens 对F. solani病原菌的影响 Fig.2 Effect of B. amyloliquefaciens on the amount of F. solani
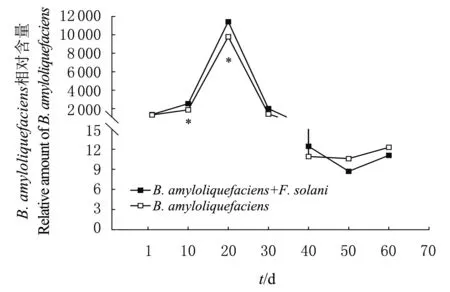
*表示在P<0.05水平差异有统计学意义。 Single asterisk (*) indicate statistically significant difference at the 0.05 probability level. 图3 B. amyloliquefaciens的数量变化 Fig.3 Amount change of B. amyloliquefaciens
由图4可知,施入T.versicolor后,土壤中F.solani的相对含量随着时间的推移而显著降低,在20~40 d期间T.versicolor相对含量变化极为明显(P<0.01),即对病原菌抑制作用最为有效,在60 d后,F.solani的相对含量极显著降低,而不施入T.versicolor的土壤中F.solani的相对含量维持在90~120之间,差异无统计学意义(P>0.05)。由图5可知,在感病植株与健康植株的根际土壤中施入T.versicolor的孢子悬液,T.versicolor的相对含量在0~20 d迅速增长,并在第30天达到最高水平,30 d后呈下降趋势,50 d后稳定;在第20、40、50、60天,T.versicolor的相对含量差异有统计学意义(P<0.05),在第30天差异有高度统计学意义(P<0.01),而其他时间差异无统计学意义(P>0.05)。在定殖稳定后,T.versicolor的相对含量在感病植株与健康植株的根基土壤中差异有统计学意义(P<0.05),且在健康植株根际土壤中T.versicolor的相对含量是感病植株根际土壤中的2.6倍,这说明在有F.solani的土壤环境对T.versicolor的定殖有较大影响。
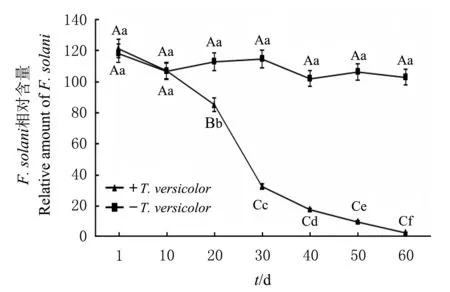
不同大、小写字母分别表示在P<0.01和P<0.05水平差异有统计学意义. Different capital and lowercase letters above the line graph indicate statistically significant differences at the 0.01 and 0.05 probability levels, respectively. 图4 T. versicolor对F. solani病原菌的影响 Fig.4 Effect of T. versicolor on the amount of F. solani
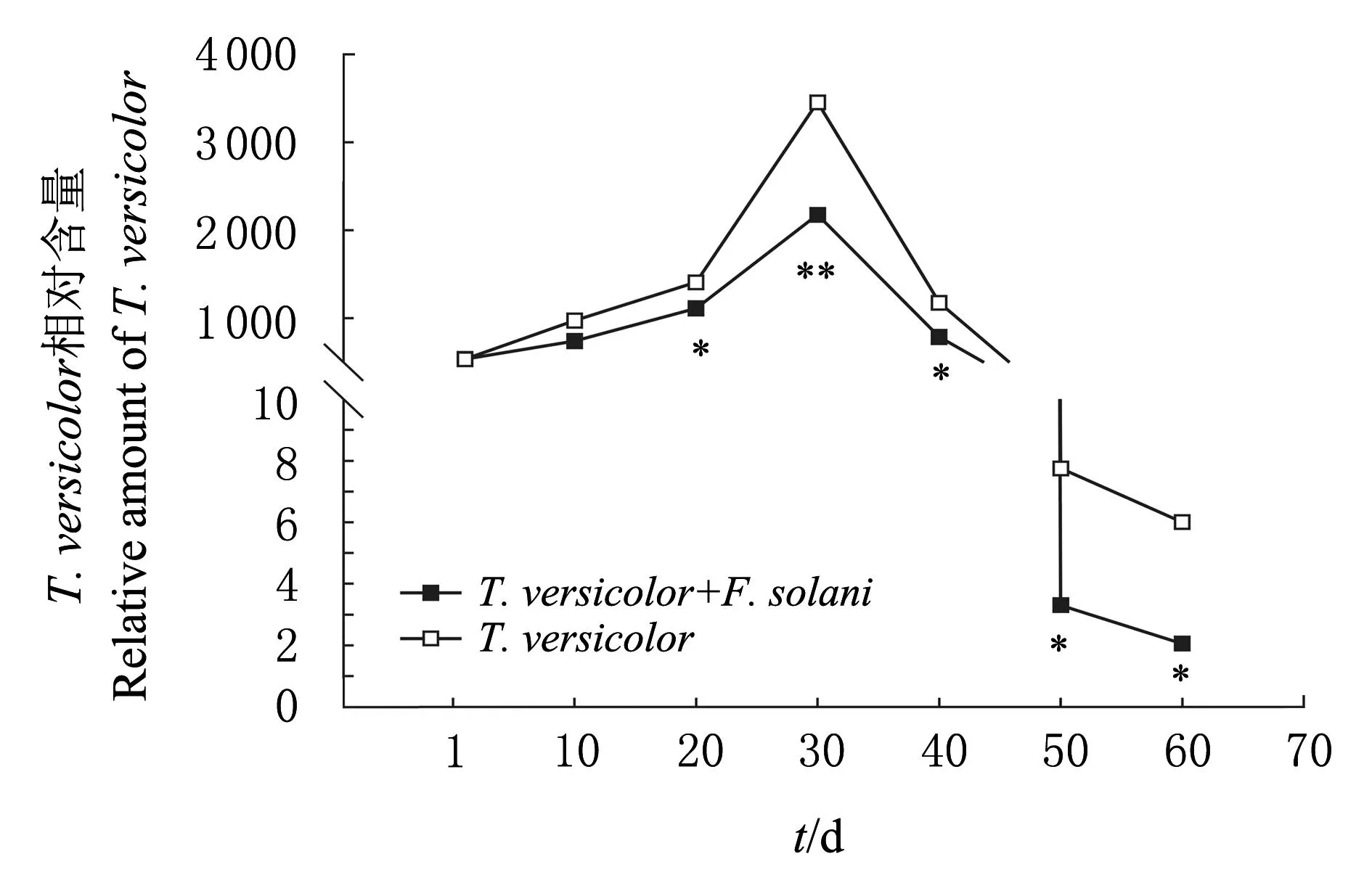
*,**分别表示在P<0.05和P<0.01水平差异有统计学意义。 Single and double asterisks (*,**) indicate statistically significant differences at the 0.05 and 0.01 probability levels, respectively。 图5 T. versicolor 的数量变化 Fig.5 Amount change of T. versicolor
由图2~5可知,在施入B.amyloliquefaciens和T.versicolor60 d后,铁核桃根际土壤中F.solani的相对含量极显著降低,然而施入B.amyloliquefaciens比施入T.versicolor根际土壤中F.solani的相对含量降低幅度更大.由此可知:生防效果:B.amyloliquefaciens>T.versicolor;定殖稳定后,B.amyloliquefaciens与对照组相比差异无统计学意义(P>0.05),而T.versicolor施于健康植株的相对含量比施于感病植株的相对含量高,大致维持在2.6倍,定殖能力:B.amyloliquefaciens>T.versicolor。
3讨论
在生防真菌中研究较多的有木霉属真菌(Trichoderma)、丛枝菌根真菌(Arbuscularmycorrhize)、非致病镰刀菌(F.oxysporum)、淡紫拟青霉[Paecilomyceslilacinus(Thorn.) Samson]等,其拮抗机制多种多样,主要包括抗生、竞争、重寄生和溶菌,主要抗生机制是产生几丁质酶、β-1,3-葡聚糖酶和蛋白质酶消解病原菌细胞壁,从而杀灭病原菌[18-20];而在生防细菌研究方面,目前发现有18个属的细菌在植物土传病害生物防治上有潜力,生防细菌的抑菌机制主要包括营养基质的竞争、生态位的排斥、产生嗜铁素和抗生素等,细菌在其生长环境中能分泌胞外活性物质,细菌素是其中的一大类,它具有很强的拮抗专化性。本文通过前期拮抗实验发现B.amyloliquefaciens、T.versicolor都对腐皮镰刀菌具有较为明显的拮抗作用,是具有开发潜力的生防菌。所筛选出的B.amyloliquefaciens为核桃内生菌,研究表明,该类菌通过非核糖体途径合成热稳定性好、相对分子质量小、含有D-氨基酸、耐受蛋白酶水解以及有机溶剂作用的脂肽类抗生素[21];该菌可通过产生低分子质量抗生素以及抗菌蛋白或多肽等活性物质而抑制植物病原菌,并且可作为根围细菌促进植物生长[22],其产抗真菌物质主要有解淀粉酶、伊枯草菌素、抗真菌蛋白、几丁质酶等。而T.versicolor这类真菌可分泌木质素降解酶,其中包括木质素过氧化物酶、漆酶等[23],主要用于造纸工业,利用T.versicolor这类菌进行植物病害的生物防治研究较少。
土壤微生物的定量检测技术主要有平板计数法和分子检测法。平板计数法具有操作简单、有效等优点,是一种经典的计数方法,但是该方法对没有选择性培养基或不能人工培养的微生物不能进行有效的研究,并且该技术的灵敏度较低,很难对土壤中微生物含量低于1×102CFU/g的样品进行检测。生防菌分子检测法的研究主要集中在抗性标记、外源基因标记、免疫学标记和发光标记等方面,但这些技术在一定程度上都存在局限性[24]。实时荧光定量PCR技术可以根据基因水平上的差异特性,定量检测土壤微生物生长繁殖状况,相对于竞争定量PCR[25]和倍比稀释法PCR[26]拥有操作更加简便、快速、准确、灵敏等优点,现已经广泛运用到土壤微生物的检测当中。Cordier等[27]通过实时荧光定量PCR对深绿木霉T1进行检测,并与传统的平板稀释法相比较,动态检测结果表明实时荧光定量PCR技术具有更高的准确性和灵敏度,可以作为有效的手段对土壤中微生物的含量进行研究。
本研究利用实时荧光定量PCR技术成功地对2种生防菌(T.versicolor和B.amyloliquefaciens)在铁核桃根际土壤中的定殖情况及病原菌F.solani的数量消长动态进行了研究。生防菌T.versicolor和B.amyloliquefaciens在铁核桃根际土壤中均有很强的定殖能力和很好的生防效果。施入生防菌后,铁核桃根际病原菌F.solani数量得到明显降低,在2个月后病原菌也维持在较低水平。本试验表明,2种生防菌生防效果:B.amyloliquefaciens强于T.versicolor;在铁核桃根际土壤中的定殖能力:B.amyloliquefaciens强于T.versicolor。造成此结果的原因可能是,生防菌的定殖能力往往受到土壤环境的影响,如土壤温度、盐浓度、渗透性、pH值等[28-29],并且由于生防菌菌种的不同,其生长所需条件也不相同。本研究用盆栽实验为2种生防菌设定了相同的生存环境,并且B.amyloliquefaciens的生防作用可能主要以分泌拮抗物质而发挥作用,更适合在特定的环境中生存;然而T.versicolor可能是以竞争为主来发挥作用,受环境影响更大。即实验的环境条件可能会对本实验结果有所影响。因此,我们将继续对生防菌进行大田实验,进一步监测2种生防菌的定殖能力和铁核桃根腐病的生防效果。
利用实时荧光定量PCR技术监测重要生防菌是一种简单、实用且灵敏度高的方法,相对于其他检测方法如传统的稀释平板法和先进的抗性标记、外源基因标记、发光标记系统等,更为省时省力,且具有高准确性和高灵敏度。另外,本研究通过建立腐皮镰刀菌的实时荧光定量检测体系,可有效地实时监测该病原菌的动态变化,对病害的早期诊断和防治具有重要意义。
参考文献(References):
[1]Pérez B A, Farinon O M, Berretta M F。 First report ofFusariumsolanicausing root rot of olive in Southeastern Argentina.PlantDisease, 2011,95(11):1476.
[2]Lozovaya V V, Lygin A V, Zernova O V,etal. Lignin degradation byFusariumsolanif. sp.glycines.PlantDisease, 2006,90(1):77-82.
[3]Li Y P, You M P, Barbetti M J. Species ofPythiumassociated with seedling root and hypocotyl disease on common bean (Phaseolusvulgaris) in Western Australia.PlantDisease, 2014,98(9):1241-1247.
[4]Koike S T. Fusarium crown and root rot of tarragon in California caused byFusariumsolani.PlantDisease, 2011,95(6):768.
[5]Pérez B A, Murillo F, Divo de Sesar M,etal. Occurrence ofFusariumsolanion blueberry in Argentina.PlantDisease, 2007,91(8):1053.
[6]da Silva W L, Clark C A. Infection of sweetpotato byFusariumsolaniandMacrophominaphaseolinaprior to harvest.PlantDisease, 2013,97(12):1636-1644.
[7]Ji G, Wei L, He Y,etal. First report of aloe root and stem rot in China caused byFusariumsolani.PlantDisease, 2007,91(6):768.
[8]Cao X M, Cai J, Li S B,etal.FusariumsolaniandFusariumoxysporumassociated with root rot ofGlycyrrhizauralensisin China.PlantDisease, 2013,97(11):1514.
[9]Ramdial H A, Rampersad S N. First report ofFusariumsolanicausing fruit rot of sweet pepper in Trinidad Rampersad.PlantDisease, 2010,94(11):1375.
[10]Zheng L, Peng Y, Zhang J,etal. First report ofFusariumsolanicausing root rot ofJuglanssigllatadode in China.PlantDisease, 2015,99(1):159.
[11]闫佳会,骆勇,潘娟娟,等.应用real-time PCR定量检测田间小麦条锈菌潜伏侵染的研究.植物病理学报,2011,41(6):618-625.
Yan J H, Luo Y, Pan J J,etal. Quantification of latent infection of wheat stripe rust in the fields using real-time PCR.ActaPhytopathologicaSinica, 2011,41(6):618-625. (in Chinese with English abstract)
[12]康振辉,黄俊丽.土壤中烟草根黑腐病菌的实时定量PCR检测技术研究.植物病理学报,2010,40(2):210-213.
Kang Z H, Huang J L. Detection ofThielaviopsisbasicolain soil with real-time quantitative PCR.ActaPhytopathologicaSinica, 2010,40(2):210-213. (in Chinese with English abstract)
[13]Hagn A, Wallisch S, Radl V,etal. A new cultivation independent approach to detect and monitor commonTrichodermaspecies in soils.JournalofMicrobiologicalMethods, 2007,69:86-92.
[14]Klein E, Ofek M, Katan J,etal. Soil suppressiveness toFusariumdisease: Shifts in root microbiome associated with reduction of pathogen root colonization.Phytopathology, 2013,103(1):23-33.
[15]周林,程萍,喻国辉,等.枯草芽孢杆菌TR21在香蕉体内及根际的定殖动态.中国农学通报,2010,26(19):392-396.
Zhou L, Cheng P, Yu G H,etal. Colonization ofBacillussubtilisstrain TR21 in banana plant and rhizosphere.ChineseAgriculturalScienceBulletin, 2010,26(19):392-396. (in Chinese with English abstract)
[16]Yu X, Liu X, Zhu T H,etal. Isolation and characterization of phosphate-solubilizing bacteria from walnut and their effect on growth and phosphorus mobilization.BiologyandFertilityofSoils, 2011,47:437-446.
[17]Denman S E, McSweeney C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen.FEMSMicrobiologyEcology, 2006,58:572-582.
[18]Hervas A, Landa B, Datnoff L E,etal. Effects of commercial and indigenous microorganisms onFusariumwilt development in chickpea.BiologicalControl, 1998,13(3):166-176.
[19]孙虎,杨丽荣,全鑫,等.木霉生防机制及应用的研究进展.中国农学通报,2011,27(3):242-246.
Sun H, Yang L R, Quan X,etal. Research advances on mechanism of biological control and application aboutTrichodermaspp.ChineseAgriculturalScienceBulletin, 2011,27(3):242-246. (in Chinese with English abstract)
[20]柳春燕,郭敏,林学政,等.拟康氏木霉和枯草芽孢杆菌对黄瓜枯萎病的协同防治作用.中国生物防治,2005,21(3):206-208.
Liu C Y, Guo M, Lin X Z,etal. The synergistic efficacy ofTrichodermapseudokoningiiandBacillussubtilisagainst cucumber wilt.ChineseJournalofBiologicalControl, 2005,21(3):206-208. (in Chinese with English abstract)
[21]Yoshida S, Hiradate S, Tsukamoto T,etal. Antimicrobial activity of culture filtrate ofBacillusamyloliquefaciensRC-2 isolated from mulberry leaves.Phytopathology, 2001,91:181-187.
[22]Chen X H, Koumoutsi A, Scholz R,etal. Comparative analysis of the complete genome sequence of the plant growth-promoting bacteriumBacillusamloliquefaciensFZB42.NatureBiotechnology, 2007,25:1007-1014.
[23]Ohkuma M, Maeda Y, Johjima T,etal. Lignin degradation and roles of white rot fungi: Study on an efficient symbiotic system in fungus-growing termites and its application to bioremediation.RikenReviews, 2001,42:39-42.
[24]张炳欣,张平.影响引入微生物根部定殖的因素.应用生态学报,2000,11(6):951-953.
Zhang B X, Zhang P. Factors affecting colonization of introduced microorganisms on plant roots.ChineseJournalofAppliedEcology, 2000,11(6):951-953. (in Chinese with English abstract)
[25]Mauchline T H, Kerry B R, Hirsch P R. Quantification in soil and the rhizosphere of the nematophagous fungusVerticilliumchlamydosporiumby competitive PCR and comparison with selective plating.AppliedandEnvironmentalMicrobiology, 2002,68(4):1846-1853.
[26]Rosado A S, Seldin L, Wolters A C,etal. Quantitative 16S rDNA-targeted polymerase chain reaction and oligonucleotide hybridization for the detection ofPaenibacillusazotofixansin soil and the wheat rhizosphere.FEMSMicrobiologyEcology, 1996,19(3):153-164.
[27]Cordier C, Edel-Hermann V, Martin-Laurent F,etal. SCAR-based real time PCR to identify a biocontrol strain (T1) ofTrichodermaatrovirideand study its population dynamics in soils.JournalofMicrobiologicalMethods, 2007,68(1):60-68.
[28]Hagvar S, Klanderud K. Effect of simulated environmental change on alpine soil arthropods.GlobalChangeBiology, 2009,15:2972-2980.
[29]Kardol P, Cregger M A, Campany C E,etal. Soil ecosystem functioning under climate change: Plant species and community effects.Ecology, 2010,91(3):767-781.
*通信作者(Corresponding author):陈丽梅,E-mail:chenlimeikm@126.com
第一作者联系方式:杨志丽,E-mail:yangzhili668@126.com
URL:http://www.cnki.net/kcms/detail/33.1247.s.20150519.1300.006.html

