树脂固定化β-半乳糖苷酶制备低聚半乳糖

树脂固定化β-半乳糖苷酶制备低聚半乳糖
费俊杰,李冰冰,陈勇,应汉杰
(南京工业大学生物与制药工程学院国家生化工程技术研究中心,南京211800)
摘要:以树脂为载体研究β-半乳糖苷酶固定化条件,来改善酶性质。以吸附率和回收率最高的离子交换树脂I002为载体,通过先吸附后交联的方法固定β-半乳糖苷酶,优化固定化条件。结果表明:加酶量为51.8 U(以1 g树脂计),固定pH为6.5,温度是25 ℃,吸附时间12 h,戊二醛体积分数为4%,交联温度是40 ℃,时间是6 h时,固定化效果最好。获得的固定化酶活可达16.2 U,固定酶回收率为39.1%,得到低聚半乳糖(GOS)的产率为24.2%。该研究为工业化利用固定化乳糖酶连续生产低聚半乳糖提供了技术依据。
关键词:β-半乳糖苷酶;固定化;低聚半乳糖;树脂
doi:10.3969/j.issn.1672-3678.2015.04.004
收稿日期:2014-04-23
基金项目:国家杰出青年基金(21025625);国家高技术研究发展计划(863计划)(2012AA021203);国家支撑计划(2012BAIG4001);国家自然科学基金青年基金(21106070);长江学者和创新发展计划(PCSIRT);江苏省高校优势学科建设工程;江苏自然科学基金(SBK201150207)
作者简介:费俊杰(1989—),男,江苏启东人,硕士研究生,研究方向:酶催化;应汉杰(联系人),教授,E-mail:yinghanjie@njtech.edu.cn
中图分类号:Q814文献标志码:A
Galactooligosaccharides production byβ-galactosidase immobilized onto resins
FEI Junjie,LI Bingbing,CHEN Yong,YING Hanjie
(National Engineering Technique Research Center for Biotechnology,College of Biotechnology
and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Abstract:We used resin as a carrier to immobilize β-galactosidase for the production of galactooligosaccharides. Cation exchange resin with the highest absorption rate and recover rate was selected as the carrier. The immobilization condition was optimized through cross-linking after immobilization of β-galactosidase.The best condition was enzyme load 51.8 U/g resin,pH 6.5,25 ℃, time 12 h; and the concentration of glutaraldehyde of 4%(v/v); the temperature in cross-linking action was 40 ℃,the time was 6 h. Under the conditions, the activity of immobilized enzyme was 16.2 U/g resin,the recovery of enzyme fixed was 39.1%,the galactooligosaccharides (GOS) production was 24.2%. The method provides technical basis for continuous production of GOS.
Keywords:β-galactosidase;immobilized;galactooligosaccharides;resin
低聚半乳糖(GOS)属于益生元,是近年来备受关注的功能性低聚糖,并且是众多功能性低聚糖中获得最广泛认可、最为安全的低聚糖之一。它不仅可以促进人体肠道内益生菌增殖,调整肠道菌群平衡,增强人体免疫机能和机体的非特异和特异性免疫反应等功能,还有低甜度、低能量、非消化性、安全性高等特点,是其他低聚糖无法相比的,可以说是促进人体健康的重要功能性食品成分,可广泛应用于食品加工业中。
目前,低聚半乳糖的制备主要有5种方法[2-3]:①天然提取法。在自然界中,低聚半乳糖含量较少,并且不带电荷,分离提取较为困难;②酸水解多糖法。酸水解多糖转化率低,产品成分复杂,难以得到含量较高的低聚半乳糖;③化学合成法。化学合成法试剂毒性大,易残留,不适用食品级低聚半乳糖生产;④发酵法。直接用微生物发酵制备低聚半乳糖目前研究较少,该方法需要从发酵液中分离提取低聚半乳糖,发酵液成分复杂,分离较为困难。以上4种方法由于产物成分复杂,分离成本高,目前不适合工业化生产;⑤酶法合成。酶法合成低聚半乳糖主要以牛乳来源的乳糖为底物,利用微生物β-D-半乳糖苷酶催化合成,乳糖来源充足,而β-D-半乳糖苷酶主要由微生物发酵制得,生产成本较低,是目前工业化生产低聚半乳糖的主要方法。酶法合成GOS分为游离酶和固定化酶两种。固定化酶法合成GOS具有酶利用率高,稳定性好,产率高, 产物后处理工艺少等优点,已成为合成研究的热点。树脂是一种廉价的材料,具有机械强度好,物化性能稳定,容易再生等特点。
本文采用树脂作为β-半乳糖苷酶的固定化载体,分别对酶固定化的条件及固定化酶的性质进行研究,以期为酶法合成低聚半乳糖提供新的思路。
1材料与方法
1.1实验材料
低聚半乳糖标品,上海惠诚生物科技有限公司;诺维信(Novozymes)乳糖酶Lactozym Pure 6 500 L,北京嘉瑞富德食品科技公司;葡萄糖、戊二醛(体积分数50%),国药集团化学试剂有限公司;乳糖、半乳糖、牛血清白蛋白(BSA),上海惠兴生化试剂有限公司;KH2PO4、K2HPO4、乙醇、正丙醇、NaOH、无水Na2CO3,西陇化工股份有限公司;邻硝基苯酚(ONP)、邻硝基苯-β-D-半乳糖糖苷(ONPG)、考马斯亮蓝G250,Sigma公司;98%浓硫酸、盐酸,上海凌峰化学试剂有限公司。
D113树脂、D001-CC树脂、HPD300树脂、DA201-A树脂,南开大学化工厂;I002树脂、HZ004树脂,由笔者所在课题组制备。
ZQZY-C型恒温摇床,上海知楚仪器有限公司;HH-2型恒温水浴锅,国华电器有限公司;UV-2600型紫外-可见分光光度计,上海尤尼柯仪器有限公司;1200 series高效液相色谱仪,安捷伦公司;HPX-87H型 Aminex色谱柱,Bio-Rad公司。
1.2实验方法
1.2.1树脂预处理方法
D113、D001-CC、HZ004和I002树脂是阳离子交换树脂,HPD300、DA201-A树脂是大孔吸附树脂。先在乙醇里浸泡8 h,用去离子水洗涤,再浸入1 mol/L NaOH浸泡8 h,用去离子水洗至中性,最后浸入1 mol/L HCl浸泡8 h,用去离子水洗至中性,去离子水浸泡备用。
I002树脂的活化:10 g树脂加入到40 mL的0.1 mol/L pH 8.0的磷酸缓冲液中,搅拌15 min后,测pH,维持 pH 7.8.0~8.2,1 h后过滤抽干。
1.2.2固定化乳糖酶的制备
取1 g树脂加入到5 mL的酶液里,在30 ℃条件下吸附12 h后,加入200 μL戊二醛溶液,25 ℃、150 r/min固定化处理6 h。固定化结束后,固定化酶用去离子水洗涤,晾干,测定固定化酶活和上清液酶活。
1.2.3酶活标准曲线的绘制
称取28 mg的邻硝基苯酚(ONP),1 mL的甲醇溶解,再用pH为6.5、浓度0.1 mol/L的磷酸缓冲液定容至100 mL,配制成2 mmol/L的ONP原液,加入不同体积的ONP和磷酸缓冲液,总量为4 mL。在40 ℃条件下反应20 min,加入2 mL的1 mol/L的Na2CO3灭活测定波长420 nm处的吸光度OD420,并绘制乳糖酶的标准曲线。
1.2.4乳糖酶酶活的测定
游离酶活力测定:取3 mL含有4 g/L ONPG的磷酸缓冲溶液于试管中,在40 ℃条件下水浴7 min,加入1 mL稀释过的酶液,振荡,40 ℃条件下反应10 min,再加入2 mL浓度为1 mol/L的Na2CO3终止反应,摇匀,在420 nm处测定OD420。
固定化酶活的测定:称取1 g的固定化酶颗粒,加入10 mL pH 6.5的磷酸缓冲溶液溶解的底物ONPG,于40 ℃反应20 min,加入1.5 mL浓度为1 mol/L的Na2CO3来灭活,测定灭活结束后OD420。
酶活的定义:在特定的反应条件下(40 ℃、pH 6.5、反应10 min),每分钟催化生成1 μmol的ONP所需的酶量定义为一个酶活单位(U),即
(1)
式中:N为游离酶的稀释倍数;0.714为换算系数,即ONP浓度为1 μmol/L的OD420;t为反应时间(min)。
1.2.5产物定量方法
使用美国安捷伦1200系列HPLC检测乳糖和转苷反应后的物质(GOS,D-半乳糖和D-葡萄糖)。检测条件:流动相为5 mmol/L硫酸,柱温为65 ℃,色谱柱为Aminex HPX 87H,流速0.6 mL/min,示差折光检测器检测,每次进样量10 μL。
1.2.6固定化酶活性吸附率和回收率计算
固定化酶活性吸附率和回收率的计算方法分别见式(2)和式(3)。

(2)
固定化酶回收率=
(3)
2结果与讨论
2.1β-半乳糖苷酶的标准曲线
按照实验方法中酶活标准曲线绘制来测定吸光值OD420,绘制β-半乳糖苷酶的标准曲线。ONP原液添加量与测到的OD420的数据见表1。

表1 OD 420数值
由表1数据绘制标准曲线,标准方程为Y=0.714 34X,R2=0.999 2。
2.2乳糖酶固定化条件的优化
2.2.1固定化树脂的选择确定
纯酶液酶活为51.796 U,加各种树脂1 g,按照1.2.4节实验方法测其上清液的酶活和固定化酶活,然后根据式(2)、式(3)来计算吸附率和回收率,结果见表2。
由表2可知:大孔吸附树脂I002、HPD300、DA201-A的吸附率相对比较高,可能原因是大孔吸附树脂的表面积大且吸附量大。离子交换树脂固定化乳糖酶时,酶蛋白与树脂进行离子交换的机率比较高,对酶活的影响较小,因此,其固定化酶活回收率较高。在6种树脂中,I002树脂对乳糖酶的吸附率和回收率最高,分别为80%和38.5%,故选择I002交换树脂作为乳糖酶固定化载体。
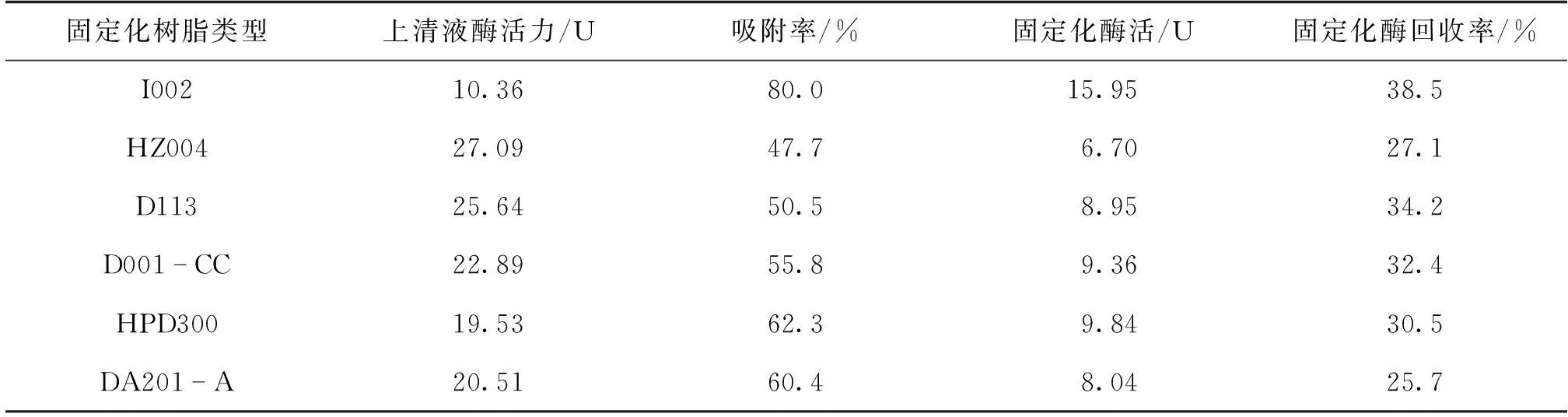
表2 不同树脂载体的吸附率和回收率比较
2.2.2戊二醛用量对酶固定化的影响
吸附在离子交换树脂I002上的乳糖酶容易受外界的影响而脱落,因此,可以用戊二醛作为交联剂来进一步提高固定化酶的稳定性。取处理后的I002树脂1 g加入到0.2 mol/L、pH 6.5磷酸缓冲液稀释的酶液中,然后加入51.8 U/g(以1 g树脂计)的β-半乳糖苷酶,在25 ℃条件下吸附12 h后,加入不同体积分数的戊二醛,在40 ℃条件下150 r/min的摇床中交联6 h,研究戊二醛用量对固定化酶活和固定化酶回收率的影响,结果如图1所示。
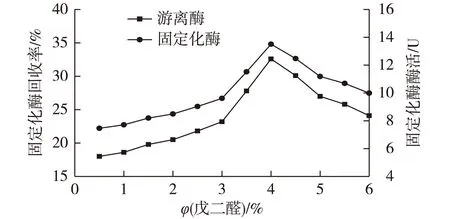
图1 戊二醛体积分数对酶固定化的影响 Fig.1 Effects of glutaraldehyde volume concentration on enzyme immobilization
由图1可知:固定化酶回收率和固定化酶活在戊二醛体积分数为4%的时候最大。其中,戊二醛在用量不高时主要起分子间的交联作用,可是当戊二醛用量过高时,会导致酶分子自己的结合,从而改变蛋白质分子的构象,使得固定化酶活降低,所以最佳戊二醛用量确定为4%。
2.2.3温度对酶固定化的影响
离子交换反应需要一定的活化能,温度的升高有利于交换速度的提高,影响分子热运动的速度,但温度过高会导致蛋白质的变性而失活,因此多种因素决定了温度对酶的固定化过程的影响,综上固定化乳糖酶存在一个最适温度范围。
按实验方法1.2.2节处理后的乳糖酶(戊二醛体积分数4%),在不同温度下交联6 h,研究不同温度对固定化酶回收率和固定化酶活的影响,结果见图2。
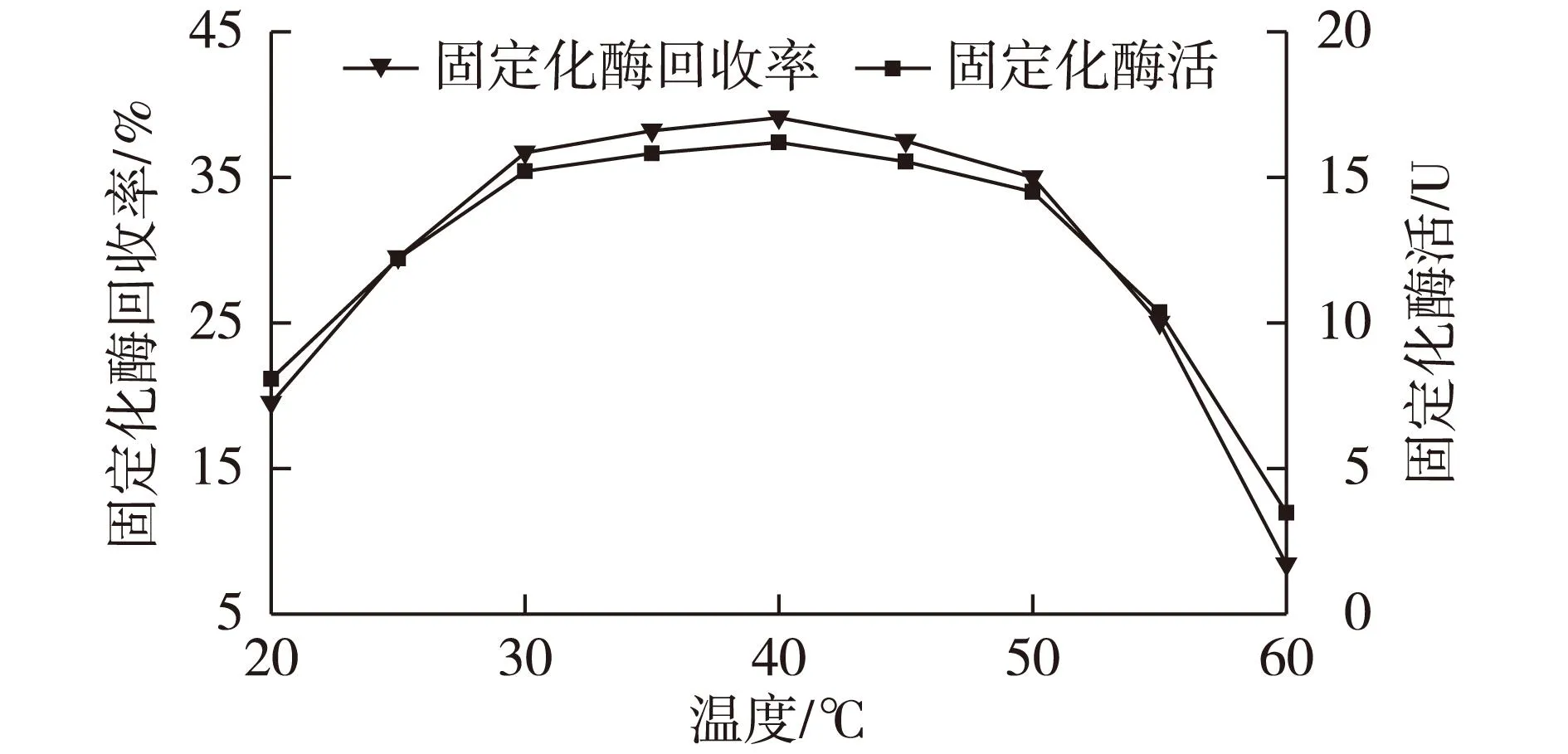
图2 温度对酶固定化的影响 Fig.2 Effects of temperature on enzyme immobilization
由图2可知:在40 ℃时固定化酶回收率和固定化酶活最大,固定化温度在30~50 ℃时固定化回收率为39.1%和固定化酶活为16.2 U,且变化不大。酶蛋白在树脂上的吸附是一个吸热过程,在温度较低时,酶不容易吸附到树脂上,随着固定化温度的升高,分子运动逐渐加剧,载体对酶的吸附量也会有所提高。当温度超过50 ℃,固定化酶回收率和固定化酶活会降低且变化幅度很大,是由于温度过高,导致戊二醛对酶变性作用过强,而且酶蛋白在较高的温度下容易变性失活。综上,最佳固定化温度选择为40 ℃。
2.3固定化乳糖酶性质的研究
2.3.1pH对乳糖酶酶活的影响
在0.2 mol/L磷酸缓冲盐体系下(含1.5 mmol/L的MgCl2),在温度40 ℃条件下,分别测固定化酶与游离酶相对酶活,结果见图3。
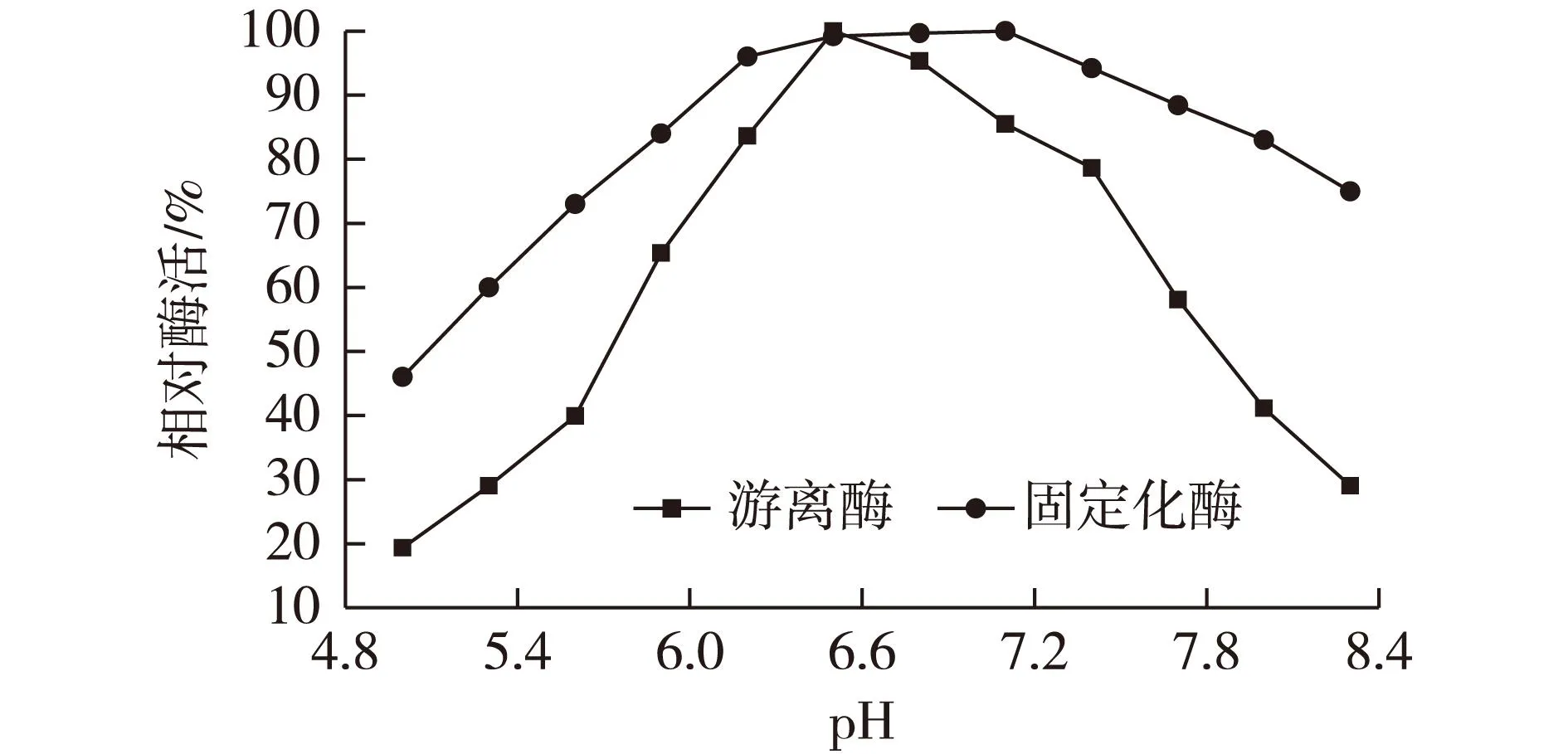
图3 pH对β-D-半乳糖苷酶活性的影响 Fig.3 Effects of pH on activity of β-D-galactosidase
由图3可知:pH为5.0~8.3时,乳糖酶游离状态下最适pH为6.2,乳糖酶固定在I002树脂上后,pH为6.2~7.4时,酶活性很稳定,即使在酸性条件下,酶的相对活力都比游离酶活高,这表明通过结合在载体后,酶分子稳定性得到了提高[7-8]。这是因为酶固定过程中与载体多位点结合[9-10],构象更加稳定,减弱了外部溶液变化对酶分子构象的影响。
2.3.2温度对乳糖酶酶活的影响
在0.2 mol/L磷酸缓冲盐体系下(含1.5 mmol/L的MgCl2),pH为6.5条件下考察温度对游离酶和固定化酶的影响,结果见图4。
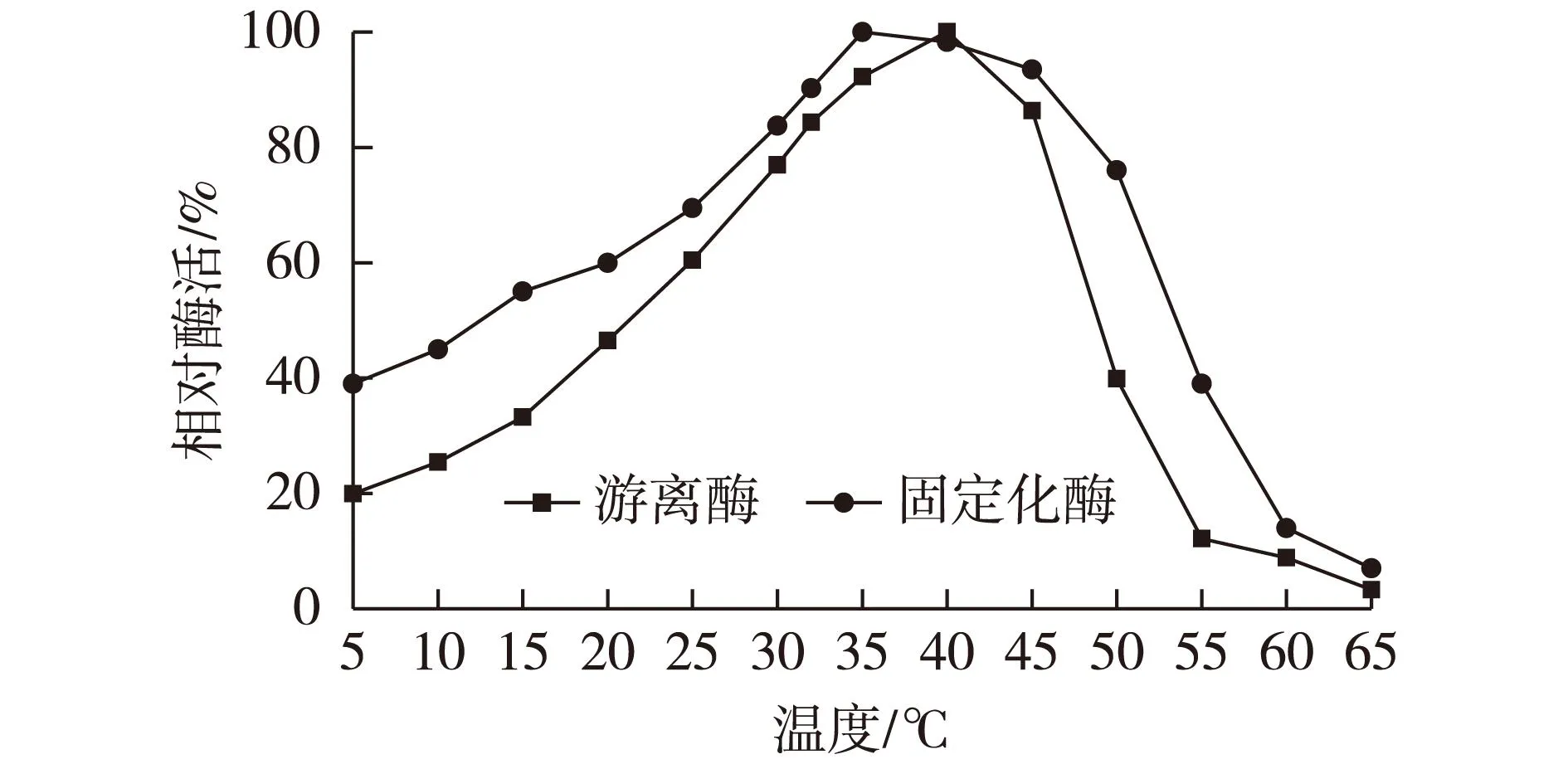
图4 温度对β-D-半乳糖苷酶活性的影响 Fig.4 Effects of temperature on activity of β-D-galactosidase
由图4可知:乳糖酶游离状态下的适合温度为40 ℃,乳糖酶固定在I002树脂上后,温度在30~50 ℃时相对酶活都较高。这表明通过载体的结合,酶分子稳定性得到了提高。可能是因为酶分子结构刚性增强,所以不易折叠变性。
2.3.3固定化的转苷反应结果
I002树脂固定β-半乳糖苷酶,乳糖250 g/L,pH 6.5,比酶活为3 U/mL,在磷酸缓冲体系中40 ℃条件下进行酶解反应,测定产物含量,在转苷反应形成GOS过程中,各个产物生成量与反应时间的关系见图5。
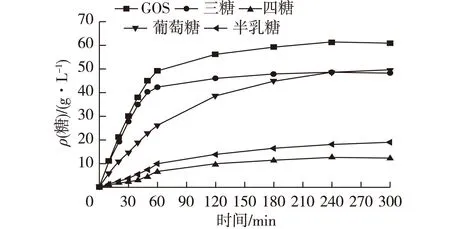
图5 反应生成物浓度与时间之间的关系 Fig.5 Relationship of product concentration and reaction time
由图5可以看出,当反应时间低于60 min时,GOS的生成量急剧增加,三糖的合成速率远远高于其他糖的合成速率;当反应超过120 min,三糖、四糖的生成量趋于稳定,但葡萄糖和半乳糖的量持续增加;尽管反应至240 min时,GOS含量达到最大(60.5 g/L),相对乳糖的收率为24.2%,但是自从反应超过120 min,GOS的生成量增加不明显。因此,为了提高GOS的生产效率,确定60 min为合适的反应时间。
2.3.4固定化酶反应的稳定性
固定化乳糖酶在pH 6.5和40 ℃的条件下连续操作9次,每次操作后测定固定化酶活,结果见图6。
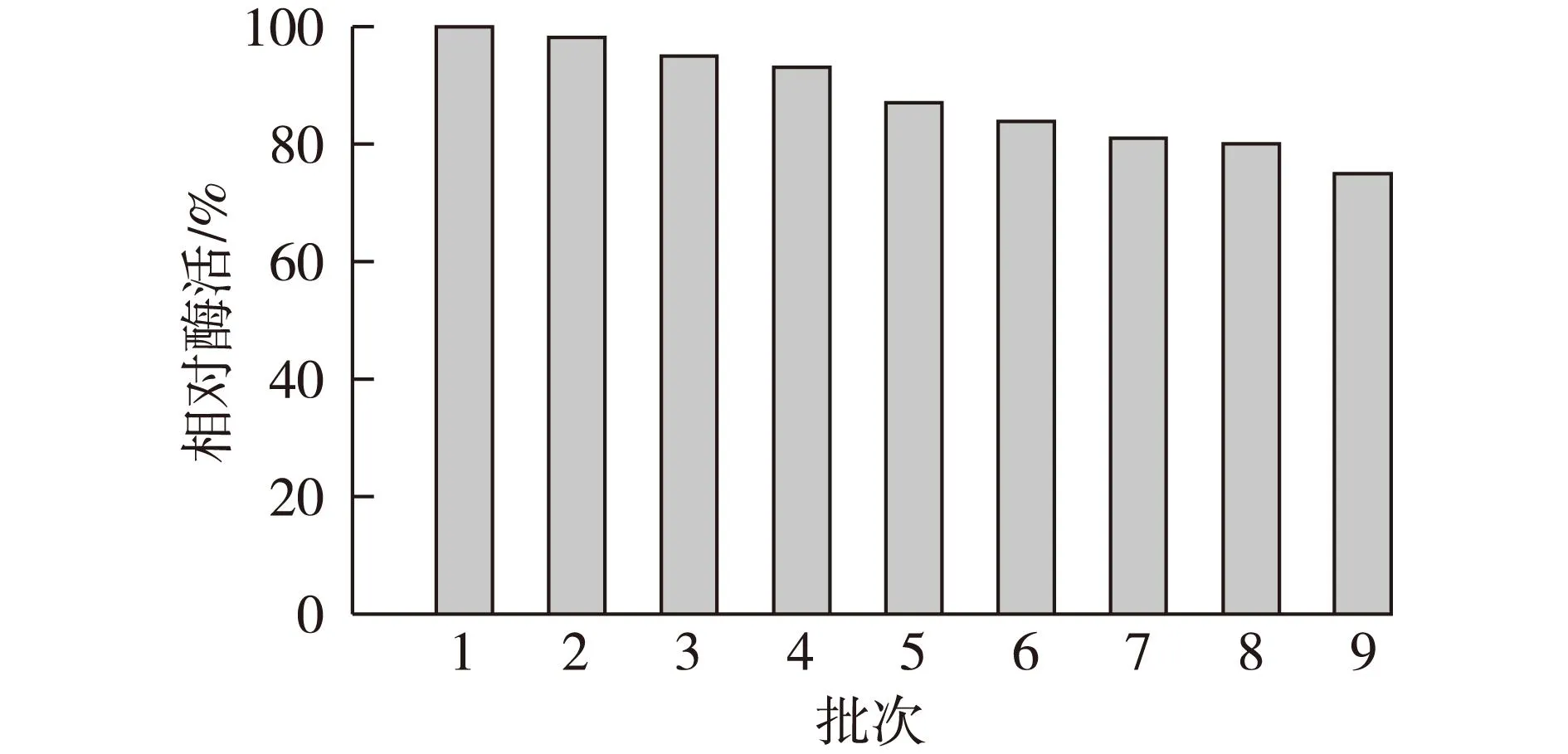
图6 固定化酶的操作稳定性 Fig.6 Operational stability of immobilized enzyme
由图6可知:固定化酶的相对活性随反应次数的增加而逐渐降低,酶活的降低可能有两方面原因,一方面是固定化酶在进行连续反应过程中,长时间机械搅拌会导致部分乳糖酶的失活;另一方面在重复回收的过程中可能会有一些人为的损失。但结果表明:固定化乳糖酶重复使用9次后仍保留了较高的活性,β-半乳糖苷酶的相对活力仍为75%,可见固定化乳糖酶具有良好的反应连续性和稳定性。
2.3.5固定化酶的储存稳定性
考察乳糖酶在固定化和游离状态下,在5 ℃冰箱内的储存稳定性是衡量其商业化应用的重要指标。将固定化乳糖酶和游离乳糖酶置于5 ℃冰箱内保存,每隔一段时间去测定乳糖酶活力,其酶活变化情况见图7。
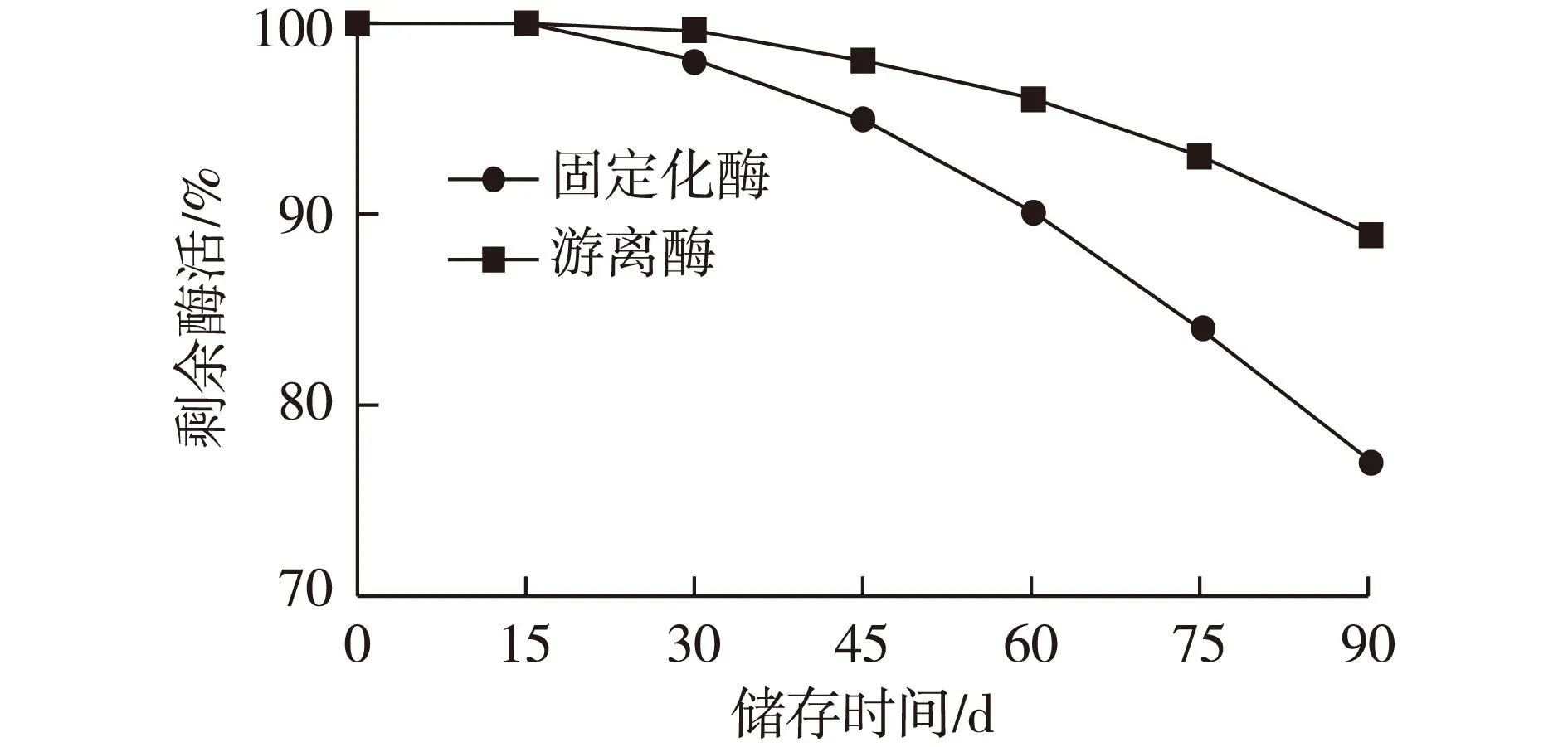
图7 乳糖酶的储存稳定性 Fig.7 Storage stability of β-D-galactosidase
由图7可知:固定化乳糖酶储存90 d,其酶活力保持在89%,而游离酶保持在77%。与游离酶相比,固定化酶在5 ℃储存时稳定性增强,这可能是由于酶的固定化降低了蛋白酶对乳糖酶的降解能力。酶的低温贮存稳定性增强,可进一步提高酶的应用价值,为固定化酶的实际应用提供了有利的数据参考。
3结论
选择6种离子交换树脂进行固定化吸附率和回收率的比较实验,并对吸附率和回收率最高的I002树脂进行吸附交联固定化,用戊二醛作为交联剂。处理后的1 g离子交换树脂I002加入用pH 6.5、0.2 mol/L磷酸缓冲液稀释的酶液,加酶量经测定为51.8 U/g(以1 g树脂计),在25 ℃吸附12 h后,加入体积分数4%的戊二醛,在40 ℃条件下交联6 h,最终获得的固定化酶活为16.2 U,固定化酶回收率为39.1%。并且利用固定后的树脂在比酶活为3 U/mL(磷酸缓冲盐溶液),pH为6.5,温度为40 ℃条件下进行酶解反应,得到GOS产率为24.2%。
参考文献:
[1]郑建仙,李旋.低聚半乳糖的制备.食品与机械,1999(1):20-21.
[2]Neri D F M,Balcao V M,Costa R S,et al.Galacto-oligosaccharides production during lactose hydrolysis by freeAspergillusoryzaeβ-galactosidase and immobilized on magnetic polysiloxane-polyvinyl alcohol.Food Chem,2009,115(1):92-99.
[3]Krajewska B.Application of chitin- and chitosan-based materials for enzyme immobilization.Enzyme Microb Technol,2004,35:126-139.
[4]Neri D F M,Balcão V B,Dourado F O Q,et al.Galactooligosaccharides production byβ-galactosidase immobilized onto magnetic polysiloxane-polyaniline particles.React Funct Polym,2009,69:246-251.
[5]Chockchaisawasdee S,Athanasopoulos V I,Niranjan K,et al.Synthesis of galacto-oligosaccharide from lactose using beta-galactosidase fromKluyveromyceslactis:studies on batch and continuous UF membrane-fitted bioreactors.Biotechnol Bioeng,2005,89(4):434-443.
[6]Kim S H,Lim K P,Kim H S.Difference in the hydrolysis of lactose and other substrates byβ-galactosidase fromK.lactis.J Dairy Sci,1997,80:2264-2269.
[7]Parmjit S P.Production ofβ-D-galactosidase from whey usingKluyveromycesmarxianus.Res J Microbiol,2008,3(1):24-29.
[8]Jochems P,Satyawali Y,Van R S,et al.Characterization and optimization of beta-galactosidase immobilization process on a mixed-matrix membrane.Enzyme Microb Technol,2011,49(6/7):580-588.
[9]Pereira-Rodríguez,á Fernández-Leiro R,González-Siso M I,et al.Structural basis of specificity in tetramericKluyveromyceslactisβ-galactosidase.J Struct Biol,2012,177(2):392-401.
[10]Song Y S,Lee J H,Kang S W,et al.Performance ofβ-galactosidase pretreated with lactose to prevent activity loss during the enzyme immobilization process.Food Chem,2010,123(1):1-5.
[11]Sun S F,Li X Y,Nu S L,et al.Immobilization and characterization of beta-galactosidase from the plant gram chicken bean(Cicerarietinum):evolution of its enzymatic actions in the hydrolysis of lactose.J Agric Food Chem,1999,47(3):819-823.
[12]Tu W X,Sun S F,Nu S L,et al.Immobilization of beta-galactosidase fromarietinum(gram chicken bean)and its catalytic actions.Food Chem,1999,64(4):495-500.
(责任编辑荀志金)


