β-半乳糖苷酶的筛选、克隆表达、酶学性质及其酶法合成低聚半乳糖

β-半乳糖苷酶的筛选、克隆表达、酶学性质及其酶法合成低聚半乳糖
王欣,吴斌,何冰芳
(南京工业大学生物与制药工程学院,江苏南京211800)
摘要:采用人工底物邻硝基苯酚-β-D-半乳糖苷(oNPG)为筛选标记,从耐有机溶剂微生物菌库中,筛选出具有较高水解活性的β-半乳糖苷酶产生菌,再以乳糖为底物考察菌株低聚半乳糖的合成性能,筛选得到1株产β-半乳糖苷酶的Erwinia billingiae WX1。根据GenBank中相同属种的基因组序列推测β-半乳糖苷酶基因,克隆得到β-半乳糖苷酶基因gal,并在大肠杆菌中实现了来源于Erwinia billingiae菌β-半乳糖苷酶的克隆表达。该基因的开放阅读框(ORF)为1 428 bp,编码475个氨基酸,理论相对分子质量为5.2×10`4。镍柱法分离纯化得到电泳纯的β-半乳糖苷酶GAL,其酶学性质研究表明最适催化温度55 ℃,最适pH 7.0;Mg`(2+)、Mn`(2+)对该酶起较强促进作用, EDTA对该酶抑制作用较强。利用β-半乳糖苷酶GAL的转糖基作用,以乳糖为底物合成低聚半乳糖,初步优化的反应条件:底物乳糖质量浓度400 g/L,每克乳糖添加酶量 1.0 U,在40 ℃反应16 h后,低聚半乳糖合成率达到34%(质量分数),显示了较好的开发前景。
关键词:Erwinia billingiae;β-半乳糖苷酶;克隆表达;酶法合成;低聚半乳糖
doi:10.3969/j.issn.1672-3678.2015.06.006
收稿日期:2014-04-04
基金项目:高等学校博士学科点专项基金(20123221130001);国家自然科学基金(21376119)
作者简介:王欣(1988—),女,辽宁营口人,硕士研究生,研究方向:生物化工;何冰芳(联系人),教授,E-mail:bingfanghe@njtech.edu.cn
中图分类号:Q93
文献标志码:A
文章编号:1672-3678(2015)06-0030-06
Abstract:Strains were screened from organic solvent tolerant bacteria,though the hydrolysis of o-nitrophenyl-β-D-galactopyranoside (oNPG).After rescreened by lactose as using lactose as substrate,strain Erwinia billingiae WX1 showed high transgalactosidation.Based on the nucleotide sequence of the β-galactosidase from Erwinia billingiae,the gene encoding the β-galactosidase GAL was cloned and expressed in Escherichia coli. The gene consists of 1 428 bp,and the translated protein encodes 475 amino acids and its molecular mass is approximately 5.2×10`4. After purification,the purity of this enzyme showed that the optimal pH and temperature were 7.0 and 55 ℃,respectively. Its activity was notably promoted by Mg`(2+),Mn`(2+),whereas EDTA had high inhibition to the enzyme. The enzyme synthesis of galacto-oligosachorides was studied by using its transgalactosylation. The optimum synthesis condition of galacto-oligosachorides was as follows:400 g/L lactose,1.0 U β-galactosidase GAL,reaction with temperature 40 ℃ for 16 h,under the conditons,the production rate of galacto-oligosachorides was 34%. Our findings demonstrate that the recombinant β-galactosidase has good development prospects.
Keywords:Erwinia billingiae; β-galactosidase; cloning expression; enzymatic synthesis; galacto-oligosachorides
Screening,cloning,expression,characterization of β-galactosidase and enzymatic synthesis of galacto-oligosaccharides
WANG Xin,WU Bin,HE Bingfang
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
低聚半乳糖(galacto-oligosaccharide,GOS)是在乳糖分子的半乳糖基一侧连接上1~4个半乳糖基生成的低聚糖类,属于葡萄糖和半乳糖组成的杂低聚糖。低聚半乳糖作为功能性低聚糖,具有促进肠道内益生菌增殖、缓解乳糖不耐症等功效。目前,市场上销售的乳制品中很多添加低聚半乳糖,具有广阔的应用前景。利用酶法合成低聚半乳糖,是工业生产低聚半乳糖的主要方法。
β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23),又称乳糖酶(GAL),能够水解乳糖生成半乳糖和葡萄糖。有些β-半乳糖苷酶在水解乳糖分子中β-1,4半乳糖苷键的同时,具有转糖基作用,通常以水解产物半乳糖为供体,以底物乳糖为受体,生成低聚半乳糖。该酶广泛存在于动物、植物及微生物中,其中微生物是β-半乳糖苷酶的主要来源。然而,国内用β-半乳糖苷酶催化合成低聚半乳糖的产率相对较低,因此筛选具有高合成性能的β-半乳糖苷酶产生菌株具有重要意义。
笔者筛得1株产β-半乳糖苷酶的ErwiniabillingiaeWX1,克隆该酶的基因,并在大肠杆菌中进行异源表达,以实现来源于Erwiniabillingiae菌β-半乳糖苷酶的克隆表达,在此基础上纯化β-半乳糖苷酶,考察该酶的酶学性质,并利用该酶催化合成低聚半乳糖。
1材料与方法
1.1 主要试剂和材料
pMD-18T Vector、限制性内切酶Hind III和NdeI、T4 DNA ligase,TaKaRa公司;大肠杆菌(Escherichiacoil)DH5a和BL21(DE3)、质粒pET-28a(+)由笔者所在实验室提供,邻硝基苯酚-β-D-半乳糖苷(oNPG),Sigma公司;酶标仪Power Wave XS,美国Bio-Tech公司;ultimate 3000型戴安高效液相色谱仪(HPLC),美国Thermo公司。
初筛培养基(g/L):酵母粉5、蛋白胨10、NaCl 10、琼脂20。pH 7.0。灭菌后冷却再加入oNPG 1 g/L。
复筛培养基(发酵培养基g/L):可溶性淀粉1、乳糖10、酵母粉2、胰蛋白胨6、CaCl20.5、MgSO4·7H2O 1.5、KH2PO42、脲0.5、TW-80 0.5×10-4。pH 7.5。
1.2 β-半乳糖苷酶产生菌株的筛选和鉴定
以笔者所在课题组自行筛选并保存的超过1 600株耐有机溶剂微生物为筛选菌库,从冻存管接种于LB固体培养基,于30 ℃培养24 h,将菌株点样转接到含人工底物oNPG的初筛培养基中,30 ℃培养24 h后,菌落边出现亮黄色圈的为有β-半乳糖苷酶水解活力的菌株。
将具有β-半乳糖苷酶水解活力的菌株接种到复筛培养基中培养,30 ℃、180 r/min培养24 h,再以乳糖为底物,通过薄层层析分析,筛选出具有转糖基活性的β-半乳糖苷酶产生菌株。运用16S rDNA序列分析,对筛选的目的菌株进行菌种鉴定。
1.3 β-半乳糖苷酶的基因克隆、异源表达
1.3.1β-半乳糖苷酶的基因克隆
参照GenBank中典型菌株ErwiniabillingiaeEb661基因组推测的β-半乳糖苷酶基因序列和表达载体pET-28a(+)的多克隆位点设计正向引物P1:(SF)5′-C ̄G ̄G ̄C ̄A ̄T ̄A ̄T ̄G ̄A ̄G ̄T ̄A ̄A ̄G ̄G ̄T ̄C ̄A ̄C ̄C ̄A ̄T ̄C ̄A ̄A ̄C ̄A -3′(下划线处为NdeI酶切位点);反向引物P2:(SR)5′-C ̄A ̄T ̄A ̄A ̄G ̄C ̄T ̄T ̄T ̄T ̄A ̄T ̄T ̄T ̄C ̄A ̄T ̄T ̄T ̄C ̄A ̄T ̄C ̄A ̄T ̄C ̄A ̄A ̄G ̄G ̄G ̄A -3′(下划线处为Hind III 酶切位点)。采用0.8%琼脂糖凝胶电泳检测并回收PCR产物。将目的片段连接到 pMD18-T载体,热激转化E.coliDH5α。筛选阳性菌落,提取重组质粒,经酶切鉴定后进行测序。将测序正确的重组质粒用Hind III和NdeI酶切后,回收目的片段,连接至用相同双酶切后的pET-28a(+)载体中,转化E.coliBL21,在含卡那霉素(50 μg/mL)的LB平板筛选阳性转化子。
1.3.2β-半乳糖苷酶的异源表达
挑取阳性转化子于4 mL LB(含50 μg/mL卡那霉素)培养基中,37 ℃振荡培养12 h,以2%的接种量转接到40 mL相同培养基中,37 ℃振荡培养,当培养液OD600达到0.5~0.6时,加入IPTG至终浓度0.1 mmol/L,30 ℃诱导培养8 h后,离心收集细胞。用磷酸缓冲溶液(50 mmol/L,pH 7.0)悬浮细胞,超声破碎细胞,于4 ℃下,12 000 r/min离心15 min,收集上清液作为粗酶液,进行酶活测定及SDS-PAGE分析。
1.3.3β-半乳糖苷酶酶活力及蛋白含量的测定
参照文献[7-8]进行β-半乳糖苷酶酶活力及蛋白含量的测定。人工底物的分光光度法检测灵敏度高,不易受干扰,操作方便,本实验采用oNPG为底物的比色法进行β-半乳糖苷酶酶活的测定。蛋白质含量的测定参照Bradford法,以牛血清白蛋白(BSA)为标准蛋白。
1.4 β-半乳糖苷酶的分离纯化及酶学性质
1.4.1β-半乳糖苷酶的分离纯化
利用pET-28a(+)表达载体在N端所带His标签,在β-半乳糖苷酶的N端引入His标签,表达后用亲和层析(镍柱)进行纯化,纯化方法见参照文献[9-10],纯化后的酶进行酶活测定及SDS-PAGE分析。用所获得纯酶进行酶学性质研究。
1.4.2β-半乳糖苷酶的酶学性质
1)反应温度、pH对β-半乳糖苷酶活力的影响将反应体系(纯酶置于pH 6.0缓冲溶液中)分别在30~70 ℃的水浴锅中进行反应,检测不同温度对β-半乳糖苷酶活力的影响。在最佳反应温度下,将反应体系分别置于pH 5.0~9.0的缓冲液(Na2HPO4-KH2PO4缓冲液)中,检测反应pH对β-半乳糖苷酶活力的影响
2)β-半乳糖苷酶的热稳定性及pH稳定性酶热稳定性的测定是取同样浓度的β-半乳糖苷酶,分别置于30~70 ℃的水浴锅中,每隔5 h取样测定残余酶活力。酶pH稳定性的测定是取同样浓度的β-半乳糖苷酶,分别置于不同pH缓冲液中(由磷酸缓冲配制),于40 ℃保温放置,每隔5 h取样测定残余酶活力。
3)金属离子及EDTA的影响为了考察金属离子对β-半乳糖苷酶的影响,在酶液中分别添加Cu2+等金属离子(金属离子终浓度分别为10 mmol/L和1 mmol/L),于30 ℃下放置1 h后检测β-半乳糖苷酶活力。以未添加离子的酶液作为对照,考察金属离子对酶活力的影响。
4)有机溶剂的耐受性将该酶放置在体积分数为20%的不同有机溶剂条件下,定时取样测定残余酶活力,考察酶对不同溶剂的耐受性。
1.5 β-半乳糖苷酶催化合成低聚半乳糖
1.5.1低聚半乳糖合成初始条件及产率计算
催化反应的初始体系(1 mL反应体系):300 g/L乳糖,加酶量1.0 U(以1 g乳糖计),pH 6.5的磷酸缓冲液,温度35 ℃、180 r/min下反应,在24 h内每隔4 h取样检测低聚半乳糖的合成率。以不加酶的反应体系为对照。
低聚半乳糖合成产率的计算见式(1)。

(1)
式中:A为反应结束后测得的葡萄糖、半乳糖和乳糖的总质量浓度(g/L),B为初始反应时添加乳糖的质量浓度(g/L)。
1.5.2低聚半乳糖的检测
薄层层析(TLC)检测条件:转糖基产物点样于硅胶板,展开剂展开,雾喷显色剂,于120 ℃显色。展开剂为V(正丁醇)∶V(乙酸)∶V(水)=8∶4∶1;显色剂为20% H2SO4配制的0.5%的3,5-二羟基甲苯。
HPLC检测条件:色谱柱为Kromasil氨基柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水溶液(两者体积比为75∶25),流速1.0 mL/min,柱温30 ℃;进样量10 μL,检测器为示差折光检测器。单糖(葡萄糖和半乳糖)、乳糖、三糖和四糖的保留时间分别为10.3、14.8、17.3和23.7 min。
2结果与讨论
2.1 β-半乳糖苷酶产生菌株的筛选
对保存的耐有机溶剂微生物菌库中的1 632株菌,采用人工底物oNPG为筛选标记,产β-半乳糖苷酶的菌株能够水解oNPG产生黄色的邻硝基苯酚(oNP)。根据显色反应筛选,获得产β-半乳糖苷酶的菌株258株,将初筛菌株进行发酵培养,以乳糖为底物,进一步进行乳糖转糖基反应,利用TLC进行筛选,结果见图1。由图1可知:通过筛选获得具有转糖基活性的β-半乳糖苷酶的菌株6株,其中第6号菌株为转糖基活性较好的菌株WX1,可作为进一步研究的候选菌。通过HPLC检测菌株WX1转糖基活性(图2),并通过16S rDNA序列分析,该菌株被鉴定为Erwiniabillingiae,命名为ErwiniabillingiaeWX1。
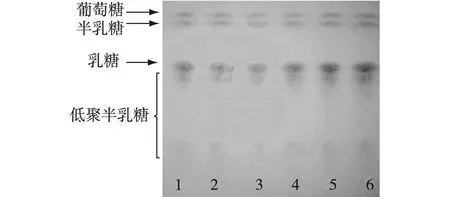
图1 转糖基反应产物TLC分析 Fig.1 Analysis of transgalactosylation products by TLC

1—单糖;2—乳糖;3~4—低聚半乳糖 图2 转糖基反应产物HPLC分析 Fig.2 Analysis of transgalactosylation products by HPLC
2.2 β-半乳糖苷酶的基因克隆及异源表达结果
根据在GenBank中搜索ErwiniabillingiaeEb661菌中推测的β-半乳糖苷酶基因序列设计引物,扩增到约1 400 bp的PCR产物,与预期大小一致。经限制性内切酶NdeI 和Hind III双酶切后插入经相同酶切的质粒pET-28a(+)中得到重组质粒pET-gal。图3为pET-gal双酶切验证图。对pET-gal插入部分测序表明,ErwiniabillingiaeWX1的β-半乳糖苷酶基因的开放阅读框(ORF)为1 428 bp,编码475个氨基酸,理论相对分子质量为5.2×104。与ErwiniabillingiaeEb661基因组推测的β-半乳糖苷酶的同源性达到99%,氨基酸序列一致,但是ErwiniabillingiaeEb661菌β-半乳糖苷酶未曾报道。将鉴定后的重组质粒pET-gal转化大肠杆菌BL21感受态细胞,得到重组菌BL21/pET-gal。重组菌BL21/pET-gal经过诱导表达条件的初步优化,比酶活达到2.83 U/mL,约为对照菌BL21/pET酶活力的30倍。利用重组蛋白的His标签进行镍柱亲和层析纯化后,SDS-PAGE分析显示纯化后的目的蛋白呈单一条带(图4),其表观相对分子质量约为5.2×104,与推测的理论相对分子质量一致。纯化后比酶活提高20倍,β-半乳糖苷酶回收率达到10.3%(表1)。首次实现来源于Erwiniabillingiae菌β-半乳糖苷酶的克隆表达。

M—标准DNA;1—NdeI+Hind III双酶切pET-gal结果; 2—β-半乳糖苷酶基因;3—NdeI+Hind III双酶切pET-28a结果 图3 pET-gal双酶切验证图谱 Fig.3 Digestion of recombinant plasmid pET-gal

M—标准蛋白;1—BL21/pET上清; 2—BL21/pET-gal上清液;3—纯化后的β-半乳糖苷酶 图4 重组蛋白的SDS-PAGE电泳 Fig.4 SDS-PAGE analysis of recombinant plasmid pET-gal

表1 β-半乳糖苷酶GAL纯化参数
2.3 β-半乳糖苷酶的酶学性质
2.3.1温度及pH对β-半乳糖苷酶的影响及其热稳定性和pH稳定性
图5为温度对β-半乳糖苷酶活力的影响结果。由图5可知,β-半乳糖苷酶最适反应温度为55 ℃。比嗜热脂肪芽胞杆菌XG24的β-半乳糖苷酶的最适温度65 ℃稍低[11],与来自米曲霉的β-半乳糖苷酶的最适温度相似[12]。

图5 温度对β-半乳糖苷酶活性的影响及其热稳定性 Fig.5 Optimum temperature and thermal stability of β-galatosidase
pH对β-半乳糖苷酶活力影响结果见图6。由图6可知,pH对酶活力的影响显著。由图6还可以看出,β-半乳糖苷酶催化体系pH范围较窄,β-半乳糖苷酶最适反应pH为7.0。与来自嗜热乳酸菌的β-半乳糖苷酶的最适pH相似[13],乳球菌G2005的β-半乳糖苷酶的最适pH为6.5[14]。

图6 pH对β-半乳糖苷酶活性的影响及其pH稳定性 Fig.6 Optimum pH and pH stability of β-galatosidase
由图5还可知,在50 ℃以下放置50 h后,酶活力残留92%以上,该酶在50 ℃以下有很好的热稳定性,与已报道青霉L7的β-半乳糖苷酶在50 ℃处理5 h酶活残留80%[13]相比,该酶GAL有很好的热稳定性。由图6还可知,该酶在pH 5.0~9.0体系中放置50 h后,在各pH体系酶活均残留90%以上,表明该酶GAL有很好的pH稳定性,而嗜热脂肪芽胞杆菌XG24的β-半乳糖苷酶在pH4.0~7.5处理1 h,其酶活残留90%[11]。
2.3.2金属离子及EDTA对酶活的影响结果
表2为金属离子及EDTA对GAL酶活的影响结果。由表2可知:在催化体系中若适当加入Mg2+、Ba2+、Mn2+及Fe3+离子,可以提高β-半乳糖苷酶GAL的酶活,而Cd3+、Cu2+对糖苷酶活有一定的抑制作用。与来源于短芽胞杆菌L2004的β-半乳糖苷酶相似[15]。通常,β-半乳糖苷酶的活性中心由2个酸性氨基酸残基组成。由表2还可知,EDTA显著抑制GAL的酶活,可推测金属离子对该β-半乳糖苷酶维持活性结构具有关键作用。

表2 金属离子及EDTA对 β-半乳糖苷酶活性的影响
2.3.3酶对有机溶剂的耐受性分析
有机溶剂对β-半乳糖苷酶活性的影响结果见图7。由图7可知:在体积分数为20%的甲醇、乙醇、丙酮的体系中保温200 h,酶活无显著变化,体现了很高的耐受性。其他有机溶剂体系中保温200 h,活力保持72%以上,表明该酶对多种有机溶剂有很好的耐受性。

图7 有机溶剂对β-半乳糖苷酶活性的影响 Fig.7 Effects of organic solvents on the stability of β-galatosidase

图8 β-半乳糖苷酶催化乳糖反应进程曲线图 Fig.8 Time course of lactose reaction by β-galatosidase
2.4 β-半乳糖苷酶催化合成低聚半乳糖
通过对反应时间、反应温度、底物浓度、酶量等条件进行优化,优化的反应条件如下:底物乳糖质量浓度400 g/L,酶量1.0 U/g(以1 g乳糖计),反应温度40 ℃,反应16 h,低聚半乳糖产率达到34%(质量分数),而后再延长反应时间,产物有少量水解。与巨大芽胞杆菌β-半乳糖苷酶合成低聚半乳糖产率25.68%(质量分数)[15]相比有所增高。产率与Aspergillusoryzae的β-D-半乳糖苷酶合成低聚半乳糖的产率[16]相近。
3结论
以人工底物oNPG为筛选标记初筛,通过乳糖转糖基反应复筛,成功筛选到1株产β-半乳糖苷酶的菌株ErwiniabillingiaeWX1。该菌的β-半乳糖苷酶基因未曾被报道,实现了该菌株的β-半乳糖苷酶的克隆表达,并对酶学性质,催化合成低聚半乳糖进行了研究。
酶学性质研究表明,β-半乳糖苷酶GAL在温度为55 ℃、最适pH为7.0时对各种有机溶剂体现了很好的耐受性,同时具有较好的温度稳定性。
该β-半乳糖苷酶(GAL)转糖基合成低聚半乳糖,经过合成条件的初步优化,GOS产率达到34%(质量分数)。同时转糖基这个特性不仅可以用于低聚半乳糖的合成,还可应用于生产低乳糖高低聚半乳糖乳制品,解除源于乳糖酶缺乏的乳糖不耐受症,同时改善乳制品的风味和营养,具有进一步的应用开发前景。
参考文献:
[1]张莉,李庆章,田雷.β-半乳糖苷酶研究进展.东北农业大学学报,2009,40(7):128-131.
[2]董艺凝,陈海琴,刘小鸣,等.耐热β-半乳糖苷酶的研究进展.食品工业科技,2012,33(1):384-387.
[3]Greenberg N A,Mahoney R R.Production and characterization ofβ-galactosidase fromStreptococcusthermophilus.J Food Sci,1982,47(6):1824-1835.
[4]Haki G D,Rakshit S K.Developments in industrially important thermostable enzymes:a review.Bioresour Technol,2003,89(1):17-34.
[5]Sheridan P P,Brenchley J E.Characterization of a salt-tolerant family 42β-galactosidase from a psychrophilic AntarcticPlanococcusisolate.Appl Environ Microbiol,2000,66(6):2438-2444.
[6]Li Lite,Zhang Min,Jiang Zhengqiang,et al. Characterization of a thermostable family 42β-galactosidase fromThermotogamaritime.Food Chem,2009,112(1):844-850.
[7]Peterson G L.Determination of total protein.Methods Enzymol,1983,91(1):86-105.
[8]张敏,江正强,唐荦,等.海栖热袍菌耐高温β-半乳糖苷酶基因的克隆和表达.微生物学通报,2007,35(4):507-511.
[9]Nguyen T H,Splechtna B,Krasteva S,et al.Characterization and molecular cloning of a heterodimeric beta-galactosidase from the probiotic strainLactobacillusacidophilusR22.FEMS Microbiol Lett,2007,269(1):136-144.
[10]Nguyen T H,Splechtna B,Yamabhai M,et al.Cloning and expression of the beta-galactosidase genes fromLactobacillusreuteriinEscherichiacoli.J Biotechnol,2007,129(4):581-591.
[11]高兆建,候进慧,孙会刚,等.耐高温β-半乳糖苷酶的分离纯化与酶学性质分析.食品科学,2010,31(23):151-155.
[12]王昌禄,顾晓波.米曲霉β-半乳糖苷酶的性质及其水解作用.中国食品添加剂,2002,1(1):34-37.
[13]黎丽,王瑞明,李丕武,等.一种来源于青霉的β-半乳糖苷酶酶学性质的研究.中国食品添加剂,2013(3):121-126.
[14]史应武,娄恺,常玮,等.一株产高温β-半乳糖苷酶低温菌株及其酶学性质的研究.食品与发酵工业,2007,33(2):56-58.
[15]王红妹,肖敏,李正义,等.转糖基β-半乳糖苷酶产生菌筛选和鉴定及酶法催化生成低聚半乳糖.山东大学学报:理学版,2006,41(2):133-139.
[16]许杜丹,杨伟东,柯蕾,等.米曲霉β-半乳糖苷酶催化合成低聚半乳糖的工艺研究.食品添加剂,2006(1):183-189.
(责任编辑荀志金)

