HPLC法测定抗丙肝新药CZYS-201402-04的有关物质
HPLC法测定抗丙肝新药CZYS-201402-04的有关物质
陶鑫1,焦丹丹2,吴卫忠3,张建军4,余洛汀1
(1.四川大学生物治疗国家重点实验室,四川 成都 610041;2.常州寅盛药业有限公司,江苏 常州 213033;
3.常州大学,江苏 常州 213164;4.中国药科大学,江苏 南京 210009)
摘要:目的采用高效液相色谱法测定新型丙型肝炎治疗药物CZYS-201402-04的有关物质。 方法采用Zorbax Eclipse Plus C18(4.6 mm×100 mm, 3.5 μm),用二元梯度洗脱的方式,流动相A为10 mmol·L-1磷酸二氢钾溶液(pH 3.0),流动相B为乙腈,检测波长为210 nm,柱温40 ℃,流速1.0 mL·min-1。结果CZYS-201402-04的峰能与相邻杂质峰完全分离。CZYS-201402-04定量限为0.039 ng(0.003 9 μg·mL-1),最低检出限为0.013 ng(0.001 3 μg·mL-1)。重复性RSD=1.5%(n=6),中间精密度RSD=1.4%(n=9)。样品溶液在24 h内稳定。结论该方法为CZYS-201402-04的有关物质检查提供了方便、灵活、精确、可靠的方法。
关键词:高效液相色谱法; CZYS-201402-04;有关物质
基金项目:“十二五”新药创制科技重大专项(No.2012ZX09103101079);江苏省科技支撑计划—社会发展项目(No.BE2014626)
作者简介:陶鑫,男,主管药师,研究方向:药物合成与质量控制,E-mail:taoxinmeter@163.com
通讯作者:余洛汀,男,博士研究生,教授,博士生导师,研究方向:药物化学、化学生物学和不对称合成化学,Tel:028-85503817,E-mail:luodyu@163.com
中图分类号:R927.1文献标识码:A
Determination of related substances of a novel anti-HCV drug CZYS-201402-04 by HPLC
TAOXin1,JIAODan-dan2,WUWei-zhong3,ZHANGJian-jun4,YULuo-ting1
(1.StateKeyLaboratoryofBio-therapyofSichuanUniversity,Chengdu610041,China;2.Changzhou
YinshengPharmaceuticalCo.,Ltd.,Changzhou213033,China;3.ChangzhouUniversity,Changzhou
213164,China;4.ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:ObjectiveTo establish an HPLC method for the determination of related substances of a novel anti-HCV drug CZYS-201402-04.MethodsZorbax Eclipse Plus C18(4.6 mm×100 mm,3.5 μm)column was used.The mobile phase A was water solution containing 10 mmol·L-1 potassium dihydrogen phosphate(pH 3.0)and the mobile phase B was acetonitrile.The UV detection wavelength was 210 nm,the column temperature was 40 ℃ and the flow rate was 1.0 mL·min-1.ResultsCZYS-201402-04 could be effectively separated with impurities.The LOQ was 0.039 ng (0.003 9 μg·mL-1) and LOD was 0.013 ng (0.001 3 μg·mL-1).RSD of repeatability was 1.4% and RSD of intermediate precision was 1.5%.The solution was stable in 24 h.Conclusion The method was convenient,sensitive,accurate and reliable for the determination of assay and related substances of CZYS-201402-04.
Key words:HPLC;CZYS-201402-04;Related substances
慢性丙型肝炎(Chronic Hepatitis C,CHC)是由丙型肝炎病毒(Hepatitis C Virus,HCV)引起的一种传染性肝脏疾病。目前全球约有2%的人感染了HCV,而每年约有35万人死于丙型肝炎相关的疾病[1]。中国在1999年HCV感染率约为1.1%(1 400万人)[2],并且在最近几年呈逐渐上升趋势,每年新诊断病例接近20万人。HCV的感染者经过10~20年的潜伏期后,约有80%的人将发展为慢性丙型肝炎,20%的人将进一步发展成肝硬化,1%~4%的人将最终恶化转变为肝癌[3]。目前,临床上用于丙型肝炎治疗的直接抗病毒药物大致可以分为3类:① NS3/4A抑制剂,包括Telaprevir、Boceprevir、Simeprevir等;②NS5A抑制剂,包括BMS公司开发的Daclatasvir[4]和Ombitasvir等;③NS5B抑制剂,包括Sofosbuvir和Dasabuvir等。临床试验显示Daclatasvir可使病人体内的RNA水平下降约3.5 log10,与干扰素联用时对基因型1a的有效率为70%左右[5]。我国CHC患者的标准治疗方案是聚乙二醇干扰素-α与利巴韦林的联合应用,而美国、欧洲和日本近年来在开发直接抗病毒药物(DAAD)上取得了突破,一类新药CZYS-201402-04(药品代号)是针对丙型肝炎病毒NS5A靶点的的新型抑制剂。该化合物具有活性高、低毒性、高生物利用度等特点。在该药物的质量标准方面,尚无有关物质检测的方法报导。本文建立了CZYS-201402-04有关物质检查的HPLC方法[6,7]。
1仪器与试药
Agilent 1260 液相色谱仪,G1314F紫外检测器,G4212B DAD检测器,G1316A柱温箱,OpenLAB CDS EZChrom 色谱工作站。CZYS-201402-04对照品(含量:99.8%),CZYS-201402-04精制品(批号:201402-04-140405,201402-04-140501,201402-04-140502,常州寅盛药业有限公司);纯化水;乙腈、甲醇为色谱级;磷酸、磷酸二氢钾为国产分析纯。
2方法与结果
2.1色谱条件与系统适用性试验采用Zorbax Eclipse Plus C18(4.6 mm×100 mm,3.5 μm)色谱柱,用二元梯度洗脱的方式,流动相A为10 mmol·L-1磷酸二氢钾溶液(用磷酸调pH至3.0),流动相B为乙腈,梯度洗脱程序[8]为0 min:A∶B=90∶10,10 min:A∶B=60∶40;25 min:A∶B=50∶50,30 min:A∶B=20∶80,35 min:A∶B=20∶80,后运行时间为5 min。检测波长为210 nm,柱温40 ℃,流速1.0 mL·min-1。进样体积10 μL。系统适用性试验要求在此色谱条件下分析,主峰的理论塔板数应不得低于3 000,主峰拖尾因子应不大于2.0,主峰与相邻峰的分离度应不得低于1.5。
2.2溶液配制及检测 照《中国药典》2010年版(二部)高效液相色谱法的要求[9],取供试品30 mg,精密称定,置50 mL容量瓶中,加甲醇溶解并稀释至刻度,混匀即得浓度为0.6 mg·mL-1样品溶液。照选定色谱条件,取10 μL注入液相色谱仪,记录色谱图,按面积归一化法计算,即得。色谱图见图1。

图1 空白(A)及供试品溶液(B)的色谱图
2.3专属性考察分别制备酸、碱、氧化、高温、高湿及强光照射破坏的样品溶液[10],制成0.6 mg·mL-1的样品溶液,按“2.1”项下色谱条件,分别进样10 μL,记录色谱图,试验结果显示,在选定的色谱条件下,CZYS-201402-04与降解物质均能较好的分离,且主峰峰纯度均为0.95以上,没有杂质包夹的现象。6种降解条件下的色谱图见图2~7。

图2 高湿(RH 90%±5%)破坏的色谱图

图3 高温(105 ℃)破坏的色谱图
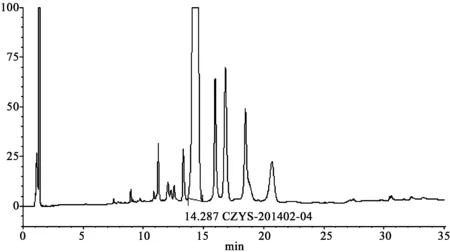
图4 酸(1 mol·L -1乙酸溶液)破坏的色谱图

图5 氧化(3%双氧水溶液)破坏的色谱图

图6 光照(4 500 Lx以上)破坏的色谱图

图7 碱(1 mol·L -1氢氧化钠溶液)破坏的色谱图
2.4定量限(LOQ)、最低检测限(LOD)的确定分别配制一系列不同浓度的CZYS-201402-04溶液,按照“2.1”项下色谱条件,分别进样记录色谱图。按照信噪比10∶1,测得CZYS-201402-04的定量限为0.039 ng(0.003 9 μg·mL-1)。按照信噪比3∶1,测得CZYS-201402-04的检测限为0.013 ng(0.001 3 μg·mL-1)。
2.5精密度试验(重复性和中间精密度)通过两人在不同时间进行样品的测定,记录色谱图,按面积归一化法计算纯度,检查进样精密度(重复性和中间精密度),试验结果表明,本品有关物质检查的进样重复性RSD=1.5%(n=6),中间精密度RSD=1.4%(n=9)。
2.6溶液稳定性取同一溶液进行数次测定,室温下放置0、2、4、6、8、10、12、18、24 h,分别按“2.1”项下色谱条件,分别进样10 μL,记录谱图。试验结果表明,CZYS-201402-04的主峰面积RSD=0.5%,样品在24 h内稳定。
2.7样品的测定分别精密称取3批供试品30 mg,精密称定,置50 mL容量瓶中,加稀释液溶解并稀释至刻度,混匀即得0.6 mg·mL-1的样品溶液。按“2.1”项下色谱条件,分别进行有关物质检测,3批样品的总杂质分别为1.0%、1.3%、1.1%。
3讨论
3.1检测波长的选择根据上述含量和有关物质的检查方法,对样品进行DAD检测,由光谱图可知,主要有关物质如原料、中间体、降解产物的最大吸收均在210 nm左右,反应副产物(位于主峰后)的吸收曲线与主峰一致,最大吸收在340 nm左右。为了有效检测杂质,若将检测波长设置为340 nm,则可能掩盖有关物质的数量和大小,因此,将检测波长定位210 nm。所制定的方法简单准确,灵敏度高。
3.2方法的选择该产品为创新药物,在临床前研究阶段尚未对已知杂质做非常深入的研究。在产品检测中来源于原料、中间体和降解产物的有关物质含量较少,而主要杂质为反应副产物(位于主峰后),其吸收曲线与主峰相同,因此,选择面积归一化法可有效检测该主要杂质的含量。本文建立的方法可为一类新药CZYS-201402-04的后续研究提供一定的理论基础。
参考文献:
[1] WHO.Hepatitis C[EB/OL].2013.http://www.who.int/mediacentre/factsheets/fs164/en/.
[2] Shan H,Wang JX,Ren FR,et al.Blood banking in China[J].Lancet,2002,360(9347):1770-1775.
[3] Lauer GM,Walker BD.Hepatitis C virus infection[J].N Engl J Med,2001,345(1):41-52.
[4] Belema M,Nguyen VN,et al.Hepatitis C Virus NS5A replication complex inhibitors:the discovery of daclatasvir[J].J Med Chem,2014,57(5):2013-2032.
[5] Pol S,Ghalib RH,Rustgi VK,et al.Daclatasvir for previously untreated chronic hepatitis C genotype-1 infection:a randomised,parallel-group,double-blind,placebo-controlled,dose-finding,phase 2a trial[J].Lancet Infect Dis 2012,12(9):671-677.
[6] 齐勇,聂磊.HPLC法测定布洛芬钠有关物质[J].药学研究,2014,33(8):446-448.
[7] 常艳波.HPLC法测定盐酸舍曲林片的有关物质[J].药学研究,2014,33(10):578-580.
[8] 蒋银妹,罗秀琴,徐燕,等.梯度洗脱反相高效液相色谱法测定恩替卡韦的有关物质[J].药物分析杂质,2009,29(4):676-679.
[9] 国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录Ⅴ D.
[10] 国家食品药品监督管理局.药物研究技术指导原则(2005年) [M].北京:中国医药科技出版社,2005:17-27.

