2013版《赫尔辛基宣言》的修订及其意义的分析研究
·科研伦理·
2013版《赫尔辛基宣言》的修订及其意义的分析研究*
王頔1,杨竟2,陈仲林3,丁艳1,江一峰1
(1 上海市第一人民医院伦理委员会,上海200080, oasiswang@126.com;
项目来源:“重大新药创制”科技重大专项项目(项目编号:2011ZX09302-007);上海市卫生局科研课题面上项目(项目编号:20134346)
2 第三军医大学第一附属医院伦理委员会,重庆400038;3 上海市胸科医院伦理委员会,上海200030)
摘要〔〕 2013年新修订的《赫尔辛基宣言》对宣言的结构进行了调整,在内容上对部分条款进行了增删和修改,并在细节上对部分用词进行了修改。新版《赫尔辛基宣言》的修订改进了宣言的架构,完善了宣言的内容,加强了对受试者的保护,提高了对研究者的要求,并明确了国家、研究机构、申办方的义务。这对我国的启示有:不断修订涉及人体临床试验的相关法规,切实保护受试者权益; 提出国家对受试者保护的义务,探索建立国家临床试验赔偿体系;明确伦理委员会职责和定位,探索建立相对独立的伦理审查主体。
关键词〔〕 赫尔辛基宣言;医学伦理;医学研究;受试者;研究者
通讯作者,E-mail:jiangyf2010@sina.com
中图分类号〔〕R-052〔
收稿日期〔2015-02-27〕
The Revision and Significance of 2013 Declaration of Helsinki
WANGDi1,YANGJing2,CHENZhonglin3,DINGYan1,JIANGYifeng1
(1EthicsCommitteeofShanghaiFirstPeople′sHospital,Shanghai200080,China,E-mail:oasiswang@126.com;
2EthicsCommitteeoftheFirstAffiliatedHospitalofThirdMilitaryMedicalUniversity,Chongqing400038,China;
3EthicsCommitteeofShanghaiChestHospital,Shanghai200030,China)
Abstract:The new revision of Declaration of Helsinki in 2013 has adjusted the structure, added or deleted some provisions on the content and modification, and modificated on the details of some words. Revision of the new version has improved the architecture, perfected the content of the declaration, strengthened the protection of the subjects, increased demand for researchers, and cleared the duty of country, research institutions and bidders. The enlightenment to our country are: constantly revised involving human clinical trials of the relevant laws and regulations, to protect rights and interests of the subjects; National obligations for protection of the subjects, clinical trials explore the establishment of national compensation system; Ethics committee responsibilities and clearly positioning, exploring to establish an independent ethical review body.
Key words:Declaration of Helsinki; Medical Ethics; Medical Research; Subjects; Researcher
《赫尔辛基宣言》全称《世界医学会赫尔辛基宣言》,是涉及人类受试者的医学研究伦理原则。《赫尔辛基宣言》与《纽伦堡法典》同为医学伦理的两大国际性指南。[1-3]2013年在巴西福塔雷萨召开的第64届世界医学会联合大会通过了《赫尔辛基宣言》的第九次修订。[4]本文通过分析2013版《赫尔辛基宣言》在2008版基础上进行的修订,探讨2013版《赫尔辛基宣言》修订的意义,为涉及人体的医学研究伦理实践提供参考。
12013版《赫尔辛基宣言》的修订内容
1.1结构的修订
2008版的《赫尔辛基宣言》共35条,分为三个部分:前言,所有医学研究使用的原则,与临床相结合的医学研究的其他原则;而2013版的《赫尔辛基宣言》在结构上进行了调整与细化,将37个条款划分为十二个部分:前言,一般原则,风险、负担和获益,科学要求和研究方案,研究伦理委员会,隐私和保密,知情同意,安慰剂使用,试验后条款,研究注册、出版和结果发布,以及临床实践中未经证明的干预措施(图1)。修订后的《赫尔辛基宣言》层次清楚、条理明晰,使参阅者能够更系统地理解宣言的内容,并明确宣言中具体条款所针对的伦理原则,真正起到指导规范临床研究的作用。
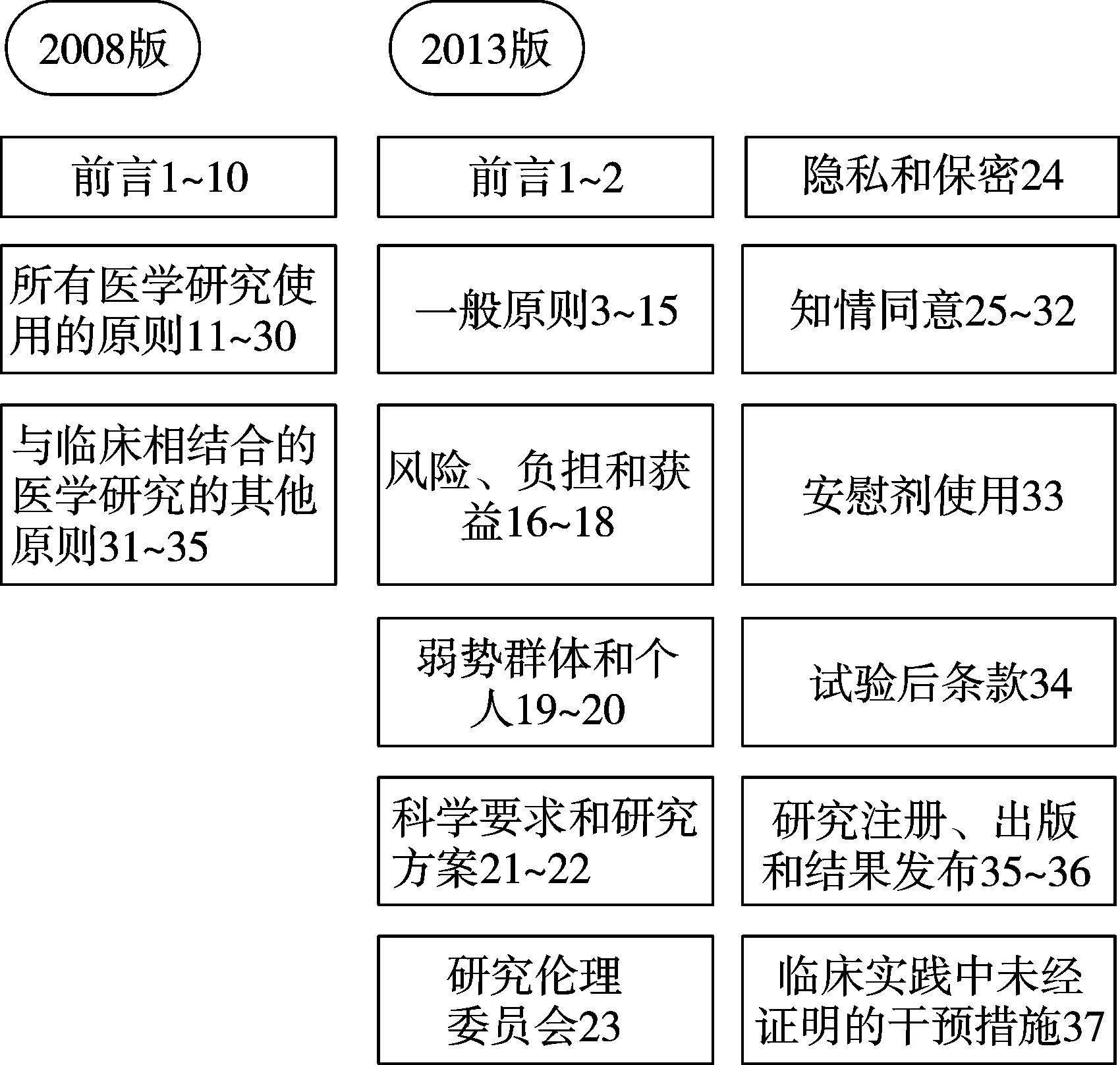
图1 2013版《赫尔辛基宣言》的结构修订
1.2条款内容的修订
2013版《赫尔辛基宣言》与2008版相比较,在内容上进行了较多调整,包括条款的增删和修改(图2)。
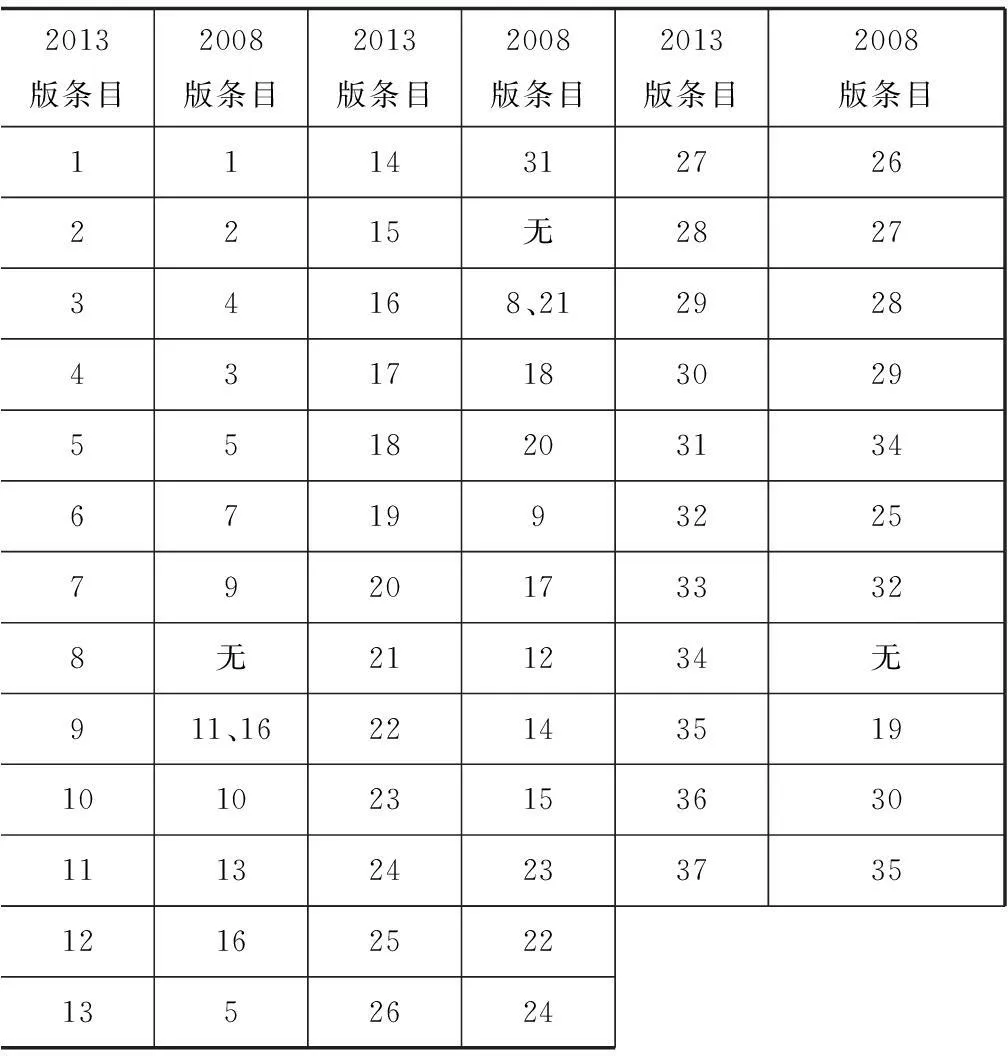
2013版条目2008版条目2013版条目2008版条目2013版条目2008版条目11143127262215无282734168、2129284317183029551820313467199322579201733328无211234无911、1622143519101023153630111324233735121625221352624
图22013版《赫尔辛基宣言》条款修订索引
(基于2008版《赫尔辛基宣言》)
1.2.1删除的条款。
2008版《赫尔辛基宣言》的第6条和第33条在2013版中被删除。
第6条,“涉及人类受试者的医学研究中,个体受试者的幸福必须高于其他一切利益”,虽然描述了受试者利益优先,但是略显笼统,象征意义大于指导意义。
第33条,“在研究项目结束时,参与研究的患者有权得知研究的结果并分享由此产生的任何益处,比如有权获得研究中确认有效的干预措施或其它合理的照顾或获益”,尽管阐述了试验结束后受试者的获益,但是没有明确使受试者获益的责任主体,因此在2013版中被删除并将其内容进行了质的深化(第34条)。
1.2.2新增条款。
2013版《赫尔辛基宣言》中,第8条、第15条和第34条为新增内容。
第8条“若医学研究的根本目的是为产生新的知识,则此目的不能凌驾于受试者个体的权利和利益之上”,第15条“必须确保因参与研究而受伤害的受试者得到适当的补偿和治疗”,这两条从保障医学研究中受试者的权益以及明确受试者受到伤害后的责权问题这两个细节,强调了人体试验中受试者利益优先的原则。
第34条,“临床试验开展前,申办方、研究者和主办国政府应制定试验后规定,以照顾所有参加试验,并仍需要获得在试验中确定有益的干预措施的受试者。此信息必须在知情同意过程中向受试者公开”,首次提出了申办方、研究者和主办国政府应承担使受试者在试验结束后继续获益的责任。
1.2.3重要修正的条款。
2013版的《赫尔辛基宣言》对2008版中部分条款的内容进行了一些重要的修正。
2008版《赫尔辛基宣言》中第20条“当发现研究的风险大于潜在的获益,或已有决定性的证据证明研究已获得明确的结果时,医生必须立即结束该项研究”,改为2013版第18条“……医生必须评估是继续、修改还是立即结束研究”。这处改动提示,如果修改研究方案能够改变研究的风险和获益,使研究获益大于风险且风险/获益比可接受,那么研究仍存在继续开展的机会;此外,即使研究的风险大于潜在的直接获益,如果医生评估后认为预计的研究结果具有相当的价值,那么在做好风险管控的前提下,研究仍有“继续”的可能。
2013版《赫尔辛基宣言》第23条增加了“研究结束后,研究者必须向委员会提交结题报告,包括对研究发现和结论的总结”的描述,明确了研究者递交结题报告的责任。第26条增加了“必须向所有医学研究受试者提供获得研究预计结果相关信息的选择权”的描述,扩展了受试者知情同意的内容。
此外,关于安慰剂的使用原则,2013版《赫尔辛基宣言》第33条在2008版“安慰剂、无干预措施”的基础上增加了“比现有最佳干预低效的干预措施”。
关于研究注册、出版和结果发布的伦理责任,2013版《赫尔辛基宣言》第36条在2008版“作者、编辑和出版者”的基础上增加了“研究者”和“申办方”。
1.3细节的修订
解读2013版《赫尔辛基宣言》最直观的感受是2013版将2008版中多处“应该(should)”改成了“必须(must)”,比如第27条“如果潜在受试者与医生有依赖关系,或有被迫表示同意的可能,在设法获得其参与研究项目的知情同意时,医生必须特别谨慎”,第30条“当研究涉及身体或精神上不具备知情同意能力的受试者时(比如无意识的患者),……医生必须设法征得法定代理人的知情同意”。这些修改不能仅仅理解为语气上的加强,而是进一步强调了研究者对保护参加人体试验的受试者具有不可推脱的责任与义务,这些责任和义务可以体现在研究过程中的任何时间、地点和事件中。
另有多处的“treatment(治疗)”改成了“intervention(干预)”“current(当前的)”改成了“proven(已被证明的)”等,例如第6条“即使对已被证明的最佳干预措施也必须通过研究,不断对其安全性、效果、效率、可及性和质量进行评估”,第33条“在缺乏已被证明有效的干预措施的情况下,在研究中使用安慰剂或无干预处理是可以接受的”。《宣言》在依据最新诊疗规范进行修缮的同时,也保证了前后术语使用的一致性。
22013版《赫尔辛基宣言》的修订意义
2.1改进宣言架构,完善宣言内容
2013版《赫尔辛基宣言》以十二个部分的形式呈现,细化归纳整理了涉及人体的医学研究伦理原则的框架结构,与2008版三部分相比架构合理、逻辑清晰。《赫尔辛基宣言》作为医学伦理的重要国际性指南,其指导和参考作用不言而喻,新版宣言修订后更贴近读者,方便阅读和查找,便于参阅者理解。[5]2013版同时新增加了如对于试验后规定的要求,对于研究者结题的要求,以及对于知情同意书中告知研究预计结果的相关信息等内容,进一步完善了宣言的内容,使以往临床试验中一些容易被忽略,但对于受试者保护而言却是十分重要的过程得以体现。
2.2加强受试者保护,强调受试者获益
伦理审查的目的是保护参与医学研究的人类受试者的权利和利益,作为医学伦理的国际性指南,《赫尔辛基宣言》对受试者保护及获益提出了诸如安全研究、风险管理、知情同意、隐私保护等各方面的具体要求,并尤其关注弱势个人和群体的保护及其获益。2013版《赫尔辛基宣言》在原来的基础上,进一步明确了受试者伤害赔偿的责权问题,并提出了受试者获取研究信息的选择权,同时表明受试者在研究结束后有持续获益的权利,使得受试者的保护与获益得到更为全面的体现。这些保护与获益不仅应当发生在研究方案设计时、研究进行过程中,同样也应该发生在研究结束之后,甚至是研究结束后相当长的一段时间内。
2.3注重研究方案的合理设计
科学合理的方案设计,有助于增强对健康和医学知识的认知,以个人或社会为目标,通过对医学研究结果的了解与分享,最终促进医学研究的不断发展。涉及人类受试者的医学研究必须符合普遍认可的科学原则,应当基于对科学文献和其他相关信息的充分了解。2013版《赫尔辛基宣言》要求研究方案必须明确描述研究项目的科学要素。这些科学要素包括了研究目的、受试者纳入和排除标准、研究方法、研究过程、研究风险及其处置等极为重要的信息。在伦理审查中,对研究项目科学性的评估应该先于伦理评估。任何不科学的医学研究都是不合伦理的,因为这类研究可能会给受试者带来毫无意义的风险或是不便。
2.4提高对研究者的要求
研究者在涉及人体的医学研究过程中参与设计并执行研究方案(GCP第三十六条,申办者、研究者共同设计临床试验方案),保证研究质量,参加研究培训,保障受试者安全以及接受监查稽查等职责。在研究方案开始、跟踪、暂停或终止以及结题时,研究者承担向伦理委员会报告的主要义务;在研究开展前和实施过程中,研究者必须做好风险管控,尽可能降低受试者面临的研究风险;而在受试者知情同意的过程中,研究者则是执行传递信息,保证受试者理解并自愿同意的最主要的责任人。2013版《赫尔辛基宣言》对研究者这几方面的要求进行了进一步的深化,促使研究者的关注点不仅仅停留在研究的申请和实施上,也要重视研究的结题,并尽可能改善研究的风险管理,不中断对风险/获益比的评估,同时在知情同意过程中给予受试者更多的信息。此外,通过部分条款中语气的强化,更是明确了研究者保护受试者权利和利益的必要责任。
2.5明确国家、研究机构、申办方的义务
涉及人体的医学研究中,以往对申办方的要求多停留在申请并组织研究,设计研究方案,建立质控体系,提供研究资源以及负责伤害赔偿等方面,这些申办方职责集中在研究开始前和研究进行中,而研究结束后向受试者继续提供研究信息则容易被忽视。很多对受试者有益的信息,比如干预措施的有效性和安全性,通常要在受试者随访结束后才能得到收集和总结,因此研究结束后信息的持续公开对受试者的保护和获益具有重要作用。2013版《赫尔辛基宣言》不仅对申办方提出持续公开信息的要求,同时也将这一要求视为主办国、研究机构和研究者的共同义务,使研究后信息向受试者公开上升到机构义务和国家义务的高度,无疑是具有突破性意义的。[6]
32013版《赫尔辛基宣言》对我国的启示
3.1不断修订涉及人体的临床试验相关法规,切实保护受试者权益
《赫尔辛基宣言》作为重要的国际伦理准则,一直以来都是我国保护受试者利益的重要依据。[7]无论在我国的《药物临床试验质量管理规范》或是《医疗器械临床试验规定》等临床试验管理规范中都有明确规定:临床试验应当遵守《赫尔辛基宣言》的道德原则。《赫尔辛基宣言》经过多次修订,不断完善着受试者权益保护的内容,体现出与时俱进、追求实效的特征。这个特征提醒我们,必须根据我国涉及人体的临床试验的发展方向与趋势,不断修订相关法规,进一步明晰概念、明确细则、拓展范围、完善体系,切实保护我国受试者的权益。
3.2明确伦理委员会职责和定位,探索建立相对独立的伦理审查主体
2013版《赫尔辛基宣言》中对伦理委员会的资质、定位有了更明确的表述,要求委员会必须透明运作,必须独立于研究者、申办方及其他任何不当影响,并且必须有正式资质,必须考虑到本国或研究项目开展国家的法律、法规以及适用的国际规范和标准。目前我国的伦理委员会全部依附于高校、医院或者各种研究机构,至今尚未出现相对独立的,不依附于其他机构的伦理委员会。2013版《赫尔辛基宣言》为我们提供了这方面的启示,探索建立类似于美国西部伦理委员会那种完全独立于任何机构的伦理审查主体,为解决伦理审查的独立性,伦理审查收费的合规性以及伦理审查绩效的滞后性等等问题提供新的模式。
3.3提出国家对受试者保护的义务,探索建立国家临床试验赔偿体系
当受试者参加临床试验而受到损害时,如果损害与试验产品直接相关,毫无疑问,赔偿责任应该由申办方承担;如果损害是由研究者的过错而造成的,那么相应的,研究者负有赔偿受试者的责任。尽管目前临床试验开展过程中,赔偿责任方明确可辨,但是在有些情况下,受试者因参加临床试验而受到损害却得不到赔偿,比如申办方注册资金不足以承担赔偿,或者研究结束多年后出现了远期损害,而这时申办方已经不复存在等情况。2013版《赫尔辛基宣言》为这些受试者无法索赔的情况提供了解决办法,即探索由主办国政府建立国家保障,比如国家临床试验赔偿体系,使受试者的权益不因申办方的问题而受到影响。
参考文献〔〕
[1]田海平. 人的概念与“概念”中的人——从《纽伦堡法典》到《赫尔辛基宣言》的人权伦理探索[J]. 伦理学研究, 2012,(5): 23-26.
[2]姚树森.《赫尔辛基宣言》修订与受试者权益保障[J]. 中国医院, 2014, 18 (2): 51-53.
[3]World Medical Association. World Medical Association Declaration of Helsinki, Ethical Principles for Medical Research Involving Human Subjects[J]. Bulletin of the World Health Organization, 2001, 79 (4): 373.
[4]World Medical Association. World Medical Association Declaration of Helsinki, Ethical Principles for Medical Research Involving Human Subjects[J]. The Journal of the American Medical Association, 2013, 310 (20): 2191-2194.
[5]吴静, 白桦. 2013版《赫尔辛基宣言》评述[J]. 中国中西医结合杂志, 2014, 34 (1): 127.
[6]郑金, 曲雁. 从2013 年版《赫尔辛基宣言》的变化看生命伦理学研究的新进展[J]. 中国医学伦理学, 2014, 27 (4): 449-452.
[7]杨丽然. 更高的伦理标准与更多的利益冲突——《赫尔辛基宣言》2008年的修订[J]. 医学与哲学(人文社会医学版), 2009, (5): 76-78.
〔修回日期2015-04-03〕
〔编辑商丹〕

