老鹳草化学成分研究(Ⅱ)
杨秀芳, 程小伟, 马养民, 康永祥
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.西北农林科技大学 林学院, 陕西 杨凌 712100)
老鹳草化学成分研究(Ⅱ)
杨秀芳1, 程小伟1, 马养民1, 康永祥2
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安710021; 2.西北农林科技大学 林学院, 陕西 杨凌712100)
摘要:研究老鹳草(Geranium wilfordii Maxim.) 全草的化学成分.采用硅胶柱层析、Sephadex LH-20 柱层析,结合重结晶等方法分离纯品化合物,并通过化合物的理化性质和波谱数据鉴定其化学结构.在原来分离的基础上又分离鉴定了4 个化合物,分别为琥珀酸( 7) 、山奈酚( 8) 、胡萝卜苷( 9) 、山奈酚-3,7-O-α-L-鼠李糖苷(10),其中化合物7,9,10为首次从该种植物中分离得到,为太白山老鹳草的进一步开发利用提供依据.
关键词:老鹳草; 化学成分; 黄酮; 糖苷
0引言
老鹳草(GeraniumwilfordiiMaxim.),为牻牛儿苗科(Geraniaceae),老鹳草属植物.我国约有55 种和5 变种[1],广泛分布于西南部和西北部.老鹳草为多年生草本植物,其多种植物在民间药用,习称鸭脚老鹳草、五叶草.具有祛风湿、通经络、止泻痢的功效[2].近年来文献报道,从该属植物中分离得到了约39个鞣质类化合物,53个黄酮类化合物,其中以山奈酚和槲皮素为主,8个有机酸类化合物,83个挥发油和一些其他成分,主要有三萜类、甾醇类和木质素类[3-5].研究表明,老鹳草具有抗炎镇痛、抗菌、抗氧化和抗肿瘤等功效[6,7].为了更好地开发利用这一丰富的药用植物资源,我们对采自太白山区的老鹳草全草进行了系统的化学成分研究,共分离纯化得到10个化合物,其中6个化合物已报道[8],本文对后续分离得到的4个化合物结构通过波谱数据分析进行了鉴定,旨为这一药用资源的系统开发利用提供理论依据.
1材料与方法
1.1材料
1.1.1样品
老鹳草采自陕西太白山区,经西北农林科技大学林学院康永祥教授鉴定为老鹳草(GeraniumwilfordiiMaxim.).
1.1.2仪器
Bruker avance III-400 MHz 超导核磁共振仪,瑞士布鲁克公司;EV311型旋转薄膜蒸发仪,北京莱伯特科仪器有限公司;柱层析硅胶(200~300目)和薄层层析硅胶G,青岛海洋化工有限公司;XT5 显微熔点测定仪,北京市科仪电光仪器厂.
1.1.3主要试剂
Sephadex LH-20,上海维编科贸有限公司; 柱层析硅胶(200~300目) ,青岛海洋硅胶干燥剂厂; 石油醚(60 ℃~90 ℃ ),乙酸乙酯和甲醇,天津市天力化学试剂有限公司; 正丁醇, 开封化学试剂厂, 所用试剂均为分析纯.
1.2提取分离
1.2.1样品的提取
干燥的老鹳草全草粉碎(7.35 kg) ,用工业酒精提取5次(每次浸泡24 h),合并提取液,减压浓缩得到浸膏(668.23 g).
1.2.2样品的分离
将浸膏混悬于水中,依次用石油醚、乙酸乙酯、正丁醇进行萃取,减压回收溶剂,得到石油醚萃取物79.78 g,乙酸乙酯萃取物76.05 g,正丁醇萃取物115.84 g.对以上三相萃取物进行初步的生物活性测试,结果表明乙酸乙酯萃取物具有很强的抗菌活性,因此我们对乙酸乙酯萃取物进行了化学成分的分离和鉴定.乙酸乙酯部分经硅胶柱色谱,用石油醚-乙酸乙酯(1∶0,20∶1,10∶1,5∶1,2∶1,1∶1,V/V)及乙酸乙酯-甲醇(1∶0,20∶1, 10∶1,5∶1,2∶1,1∶1,0∶1,V/V)梯度洗脱,对所得组分反复用硅胶、 凝胶柱层析分离, 经TLC检识和多次重结晶后, 得到9个化合物,其中化合物2(56 mg),化合物3(15 mg),化合物4(23 mg),化合物5(34 mg),化合物6(47 mg),化合物7(6 mg),化合物8(8mg),化合物9(78 mg),化合物10(16 mg),另外从石油醚相中分离得到化合物1(0.6 g).
1.3鉴定方法
通过纯度检测(如用5%的浓硫酸和乙醇溶液显色剂、紫外灯和碘蒸气进行检测,化合物的熔程测定)和化合物的理化性质检验(如糖苷的紫环反应,黄酮类盐酸-镁粉反应,甾体类化合物的Liebermann-Burchard显色反应等), 并对比文献的核磁共振波谱数据鉴定化合物结构.
2结构鉴定
参考文献上述分离纯化得到的10个化合物中,其中化合物1~化合物6的结构解析已作报道,见[8],下面将另外4个化合物结构解析如下.
化合物7无色片晶(丙酮),m.p.183~184 ℃,溶于水,微溶于乙醇、乙醚和丙酮,溴甲酚绿试剂的显色反应呈阳性.1H-NMR (400 MHz,DMSO-d6)δ:12.11(2H,s,-COOH),2.41(4H,s,-CH2CH2-).13C-NMR (100 MHz, DMSO-d6)δ:173.6(-COOH),28.8(-CH2CH2-).以上数据与文献[9]基本一致,故确定该化合物为丁二酸,即琥珀酸,其结构如图1所示.

图1 丁二酸
化合物8黄色粉末(甲醇),m.p. 274~276 ℃,ESI-MS m/z:285[M-H]-.盐酸-镁粉反应显红色显色剂(5% 浓硫酸-乙醇溶液)显色为一个黄色斑点,Molish反应呈阴性.1H-NMR (400 MHz, DMSO-d6)δ:12.50(1H,s,5-OH),10.81(1H,s,7-OH),10.13(1H,s,4′-OH),9.44(1H,s,3-OH),6.44(1H,d,J=2.1 Hz,H-8),6.20(1H,d,J=2.0 Hz,H-6),8.05(2H,d,J=8.8 Hz,H-2′,H-6′),6.93(2H,d,J=8.9 Hz,H-3′,H-5′).13C-NMR (100 MHz,DMSO-d6)δ:129.5(C-2′,6′) ,115.4(C-3′,5′),146.8(C-2),135.6(C-3),175.8(C-4) ,δ160.7(C-5),98.2(C-6),164.0(C-7),93.4(C-8),156.1(C-9),102.9(C-10),121.6(C-1′),129.5(C-2′,6′),115.4(C-3′,5′),159.2(C-4′) .以上数据与文献[10,11]基本一致,结合HMQC,HMBC确定该化合物为山奈酚,其结构如图2所示.
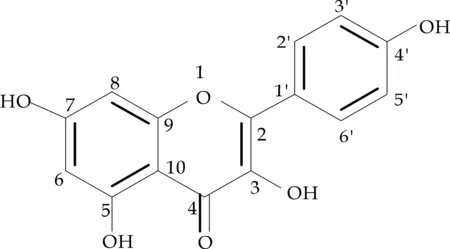
图2 山奈酚
化合物9白色无定形粉末(甲醇),m.p.290 ℃~292 ℃,Molish反应呈阳性,Liebermann-Burchard反应呈阳性.1H-NMR (400 MHz, DMSO-d6)δ:5.33(1H,m,H-6),3.67~3.63(1H,m,3-H),4.90~4.89(1H,m,H-1′),4.46(2H,t,J=5.6 Hz,H-6′),4.22(1H,d,J=7.8 Hz,H-4′),0.99(3H,s,H-21),0.95(3H,s,H-19),0.90(3H,s,H-26),0.88(3H,s,H-29),0.81(3H,s,H-27),0.65(3H,s,H-18).13C-NMR(100 MHz,DMSO-d6)δ:140.9(C-5),121.7(C-6),δ101.2 (C-1′),δ73.9(C-2′),77.4(C-3′),70.5(C-4′),77.2(C-5′),61.5 (C-6′),77.2(C-3),12.2(C-18),19.4(C-19),23.1(C-21),20.2(C-26),19.1(C-27),12.1(C-29),36.0(C-1),31.9(C-2),36.7(C-4),31.9(C-7),31.9(C-8),49.5(C-9),36.0(C-10),19.4(C-11),38.8(C-12),42.3(C-13),56.6(C-14),24.3(C-15),28.3(C-16),55.9(C-17),42.3(C-20),36.7(C-22),29.1(C-23),50.1(C-24),33.8(C-25),25.9(C-28).以上数据与文献[12]基本一致,故该化合物确定为胡萝卜苷,其结构如图3所示.

图3 胡萝卜苷
化合物10黄色针晶(甲醇),m.p.188 ℃~190 ℃,ESI-MS m/z:577[M-H]-.盐酸-镁粉反应显红色,紫外光下显黄色荧光,Molish反应呈阳性.1H-NMR(400 MHz,DMSO-d6)δ:12.61(1H,s,5-OH),10.30(1H,s,4′-OH),6.80(1H,d,J=2.1 Hz,H-8),6.46(1H,d,J=2.0 Hz,H-6),7.80(2H,d,J=8.8 Hz,H-2′,H-6′),6.92(2H,d,J=8.8 Hz,H-3′,H-5′),5.56(1H,d,J=1.2 Hz,H-1′′′),5.30(1H,d,J=1.2 Hz,H-1′′),1.05(3H,d,J=6.1 Hz,H-6′′′),0.82(3H,d,J=5.6 Hz,H-6′′).13C-NMR(100 MHz,DMSO-d6)δ:156.6(C-2),135.0(C-3),178.4(C-4),161.4(C-5),99.9(C-6),162.1(C-7),95.0(C-8),158.3(C-9),106.2(C-10),120.8(C-1′),131.2(C-2′,6′),115.9(C-3′,5′),160.6(C-4′),102.3(C-1′′),98.8(C-1′′),17.9(C-6′′),8.4(C-6′′′),δ70.6(C-2′′),71.2(C-3′′),72.0(C-4′′),70.5(C-5′′),70.6(C-2′′′),70.7(C-3′′′),71.5(C-4′′′),71.3(C-5′′′).以上数据与文献[13-15]基本一致,结合DEPT-135,故将该化合物确定为山奈酚-3,7-O-α-L-鼠李糖苷,其结构如图4所示.

图4 山奈酚-3,7-O-α-L-鼠李糖苷
3结论与讨论
本研究分离并鉴定了 4 个化合物,分别为琥珀酸( 7) 、山奈酚( 8) 、胡萝卜苷( 9) 、山奈酚-3,7-O-α-L-鼠李糖苷( 10),其中化合物7,9,10为首次从该种植物中分离得到.
试验主要对石油醚和乙酸乙酯的提取物通过硅胶柱色谱、Sephadex LH-20凝胶柱色谱等分离手段进行了分离纯化.乙酸乙酯相中分离得到的化合物极性相差不大且容易受温度的影响,通过硅胶柱层析分离有一定的难度,针对这一问题,我们在上样时一方面控制温度在60 ℃左右,另一方面控制硅胶与样品的比例(20∶1,m/m),同时对乙酸乙酯相得到的各个组分,反复柱层析及重结晶,分离效果良好,得到了纯品化合物.从老鹳草全草的乙醇提取物中分离纯化得到的10个化合物中,其中2个甾体类化合物,2个有机酸类化合物,3个鞣质类化合物和3个黄酮类化合物.
[1] 中国植物志编委会.中国植物志(43 卷第1 册)[M].北京:科学出版社,2004:22-23.
[2] 李琳波,马天波,肖月星,等.青岛老鹳草化学成分的研究[J].中草药,2000,31(2):92-93.
[3] 金晴昊,崔京浩,郭建鹏.老鹳草的研究进展[J].时珍国医国药,2005,16(9):840-841.
[4] Kuepeli E,Tatli I I,Akdemir Z S,et al.Estimation of antinociceptive and anti-inflammatory activity on Geranium pratense subsp.finitimum and its phenolic compounds[J].Journal of Ethnopharmacology,2007,114(2):234-240.
[5] 何文涛,金哲雄,王宝庆.老鹳草的研究进展[J].航空航天医学杂志,2011,22(10):1 200-1 202.
[6] Hammami I,Mohamed A T,Ahmed R.Chemical compositions,antibacterial and antioxidant activities of essential oil and various extracts of Geranium sanguineum L.flowers[J].Archives of Applied Science Research,2011,3(3):135-144.
[7] Yang Y C,Li J, Zu Y G, et al.Optimisation of microwave-assisted enzymatic extraction of corilagin and geraniin from Geranium sibiricum linne and evaluation of antioxidant activity[J].Food Chemistry,2010,22:373-380.
[8] 程小伟,马养民,康永祥,等.老鹳草化学成分研究[J].中药新药与临床药理,2013,24(4):390-392.
[9] 赵倩,刘钫,李清娟,等.月季花化学成分的研究[J].中草药,2012,43(8):1 484-1 488.
[10] 张晓瑢,彭树林,肖顺昌,等.单条草化学成分的研究[J].应用与环境生物学报,1998,4(2):145-147.
[11] 贾陆,敬琳琳,周胜安,等.地桃花化学成分研究.Ⅰ.黄酮类化学成分[J].中药与天然药物,2009,40(9):662-665.
[12] 赵庆春,付艳辉,郭涛,等.葫蔓藤中非生物碱类化学成分的分离与鉴定[J].沈阳药科大学学报,2007,24(10):619-622.
[13] 杨秀伟,张建业,钱忠明.罗汉果中新的天然皂苷[J].中草药,2008,39(6):810-814.
[14] 段世康,唐生安,秦楠,等.金鸡脚化学成分及其抗氧化活性[J].中国中药杂志,2012,37(10):1 402-1 407.
[15] 渠桂荣,李新新.裂叶苣荬菜的黄酮苷成分研究[J].中国中药杂志,1996,21(5):292-294.

Study on chemical compositions ofGeraniumwilfordiiMaxim.(Ⅱ)
YANG Xiu-fang1, CHENG Xiao-wei1, MA Yang-min1, KANG Yong-xiang2
(1.College of Chemistry and Chemical Engineering, Key Laboratory of Auxiliary Chemistry & Technology for Chemical Industry, Ministry of Education, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.College of Forestry, Northwest A & F University, Yangling 712100, China)
Abstract:The constituents of the whole herb of Geranium wilfordii Maxim. were investigated.The compounds were isolated by silica gel column chromatography,Sephadex LH-20 column chromatography and purified via recrystallization.Their structures were identified by physicochemical properties and spectra analysis.Four compounds were obtained and identified as succinic acid (7),kaempferol (8), daucosterol (9) and kaempferol-3,7-O-α-L-dirhamnoside (10).Compound 7,9 and 10 were obtained from Geranium wilfordii Maxim.for the first time.The study provides basis for the further development and utilization of Geranium wilfordii Maxim.
Key words:Geranium wilfordii Maxim.; chemical constituent; flavones; glucoside
中图分类号:R284.1
文献标志码:A
文章编号:1000-5811(2015)01-0095-04
作者简介:杨秀芳(1963-),女,陕西铜川人,教授,研究方向:天然产物的提取与开发
基金项目:陕西省科技厅自然科学基金项目(2012JM2017); 国家林业公益性行业科研专项项目(20094004)
收稿日期:*2014-09-28

