缝隙连接蛋白43通过调控L型钙电流参与心房肌细胞的电重塑
缝隙连接蛋白43通过调控L型钙电流参与心房肌细胞的电重塑*
饶芳1, 2, 3,薛玉梅1, 3,邓春玉2, 3,余细勇1, 2, 3,肖定璋2, 3,陈少贤2, 3,林秋雄2, 3,杨慧2,3,邝素娟2,3,刘晓颖2,3,朱杰宁2, 3,吴书林1, 3△
(1广东省心血管病研究所心内科,2广东省人民医院医学研究部,3广东省医学科学院 广东 广州 510080)
[摘要]目的: 观察缝隙连接蛋白43(Cx43)是否通过与L型钙通道共定位,调控L型钙电流,参与房颤(AF)的发病机制。方法: 使用蛋白免疫印迹和实时荧光定量PCR检测AF和窦性心律患者心房组织中Cx43的蛋白和mRNA表达差异;用RNA干扰技术沉默心房肌细胞的Cx43表达,实时荧光定量PCR和全细胞膜片钳实验观察对L型钙通道mRNA表达和L型钙电流的影响;免疫共沉淀和激光共聚焦显微成像观察心房肌细胞中Cx43与L型钙通道是否存在共定位。结果: AF患者心房组织中的Cx43表达明显低于窦性心律患者;干扰Cx43表达可明显抑制L型钙电流和L型钙通道α1c亚基的mRNA表达;且心房肌细胞中Cx43与L型钙通道存在共定位。结论: 心房肌细胞中的Cx43可通过与L型钙通道形成分子复合物,调控L型钙电流,参与心房肌细胞的电重塑。
[关键词]缝隙连接蛋白43; L型钙通道; 心房肌细胞; 心房纤颤; 电重塑
[中图分类号]R363.2[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.010
[文章编号]1000-4718(2015)11-1992-06
[收稿日期]2015-02-06[修回日期] 2015-09-09
[基金项目]*国家自然科学基金资助项目(No. 31260250)
通讯作者△Tel: 0851-86753069; E-mail: moxiangang123@126.com
Cx43 is involved in electrical remodeling of atrial myocytes through regulating L-type calcium currentRAO Fang1, 2, 3, XUE Yu-mei1, 3, DENG Chun-yu2, 3, YU Xi-yong1, 2, 3, XIAO Ding-zhang2, 3, CHEN Shao-xian2, 3, LIN Qiu-xiong2, 3, YANG Hui2, 3, KUANG Su-juan2, 3, LIU Xiao-ying2, 3, ZHU Jie-ning2, 3, WU Shu-lin1, 3
(1DepartmentofCardiology,GuangdongProvincialCardiovascularInstitute,2MedicalResearchCenter,GuangdongGeneralHospital,3GuangdongAcademyofMedicalSciences,Guangzhou510080,China.E-mail:wushulincn@163.com)
ABSTRACT[]AIM: To investigate whether the association of connexin 43 (Cx43) and L-type calcium channel involved in the pathogenesis of atrial fibrillation (AF). METHODS: The biochemical assays and whole-cell patch-clamp technique were used to study the expression of Cx43 in human atrial tissue. The co-localization of Cx43 and L -type calcium channel, and the regulation of L-type calcium current in atrial myocytes were investigated. RESULTS: The expression of Cx43 at mRNA and protein levels was decreased in human atrial tissues of AF patients. In cultured atrium-derived myocytes (HL-1 cells), knockdown of Cx43 significantly inhibited the mRNA expression of L-type calcium channel α1c subunit, as well as L-type calcium current. Co-localization of Cx43 with L-type calcium channel α1c subunit in mouse atrial myocytes was observed. CONCLUSION: The decrease in Cx43 is involved in the pathogenesis of AF, probably through reducing the L-type calcium current in atrial myoctyes by co-localization with L-type calcium channel, thus representing the potential pathogenesis in atrial fibrillation.
[KEY WORDS]Connexin 43; L-type calcium channels; Atrial myocytes; Atrial fibrillation; Electrical remodeling
心房颤动(atrial fibrillation,AF)是临床最常见的快速性心律失常之一,发病率呈逐年上升趋势。可导致心力衰竭和动脉栓塞,使患者致残或致死,给社会和家庭带来沉重的负担。当前的抗心律失常药物和导管治疗AF均有较多局限性。因此需进一步阐明AF的发病机制,以寻找更好的治疗策略;
AF的发病机制主要包括电重塑和结构重塑。心房肌细胞L型钙电流(L-type calcium current,ICa,L)减少,导致心房有效不应期缩短和多子波-折返通路形成和维持,是AF电重塑的主要标志[1-2]。另一方面,AF的结构重塑包括心房扩大和纤维化,与电重塑的发生是平行的[2-3]。心肌细胞间通讯异常在AF的发病中亦起着非常重要的作用。心脏电活动的协调是心肌细胞间通过位于闰盘的缝隙连接通道形成的细胞间偶联维持的。缝隙连接蛋白(connexins,Cxs)是组成连接子和缝隙连接的主要蛋白。近年来的研究显示改善缝隙连接开放,可有效增加心肌细胞间传导,起抗心律失常作用[4]。Cx43是心房肌细胞中的主要Cxs之一;AF时Cx43表达降低,去磷酸化以及分布侧边化,使细胞间的电传导减慢,最终导致AF的发生和发展[5]。但近年来有研究发现,心肌细胞中的Cx43与桥粒斑菲素蛋白( plakophilin 2,PKP2)和Na+通道能形成大分子复合体,其表达改变可直接影响钠电流[6-7]。因此,Cx43亦可能在细胞膜上与其它阳离子通道形成复合体,直接调控通道功能,如L型钙通道(L-type calcium channel,LCC),直接调控ICa,L,从而参与AF电重塑。
材料和方法
1患者资料
本研究符合赫尔辛基宣言中的原则,并经广东省人民医院(广东省医学科学院)医学研究伦理委员会批准(批准号:GDREC20131107)。所有患者均签署知情同意书。有严重左室功能不全者,合并其它系统严重疾病者及合并肺炎及其他炎症性疾病者不能入选。接受心脏手术的患者,在体外循环开始前收集切除的右心耳,迅速投入到液氮中,并储存在-80 ℃备用。本研究中选取9名慢性AF和7名窦性心律(sinus rhythm,SR)患者。入选患者详细资料见表1。

表1 入选患者的详细资料
MVR: mitral valve replacement; EF: ejection fraction.
2实验方法
2.1HL-1 细胞的培养及分组心房肌细胞株HL-1获赠自William Claycomb 教授实验室(Louisiana State University Health Science Center, New Orleans, LA)。细胞培养于Claycomb 培养基(JRH Biosciences),加入了10% 胎牛血清(JRH Biosciences)、2 mmol/L的L-谷氨酰胺(Gibco)、100 μmol/L去甲肾上腺素(Sigma)、1×105U/L青霉素和100 mg/L链霉素(Gibco),培养瓶使用纤连蛋白和凝胶预铺(Sigma),培养于37 ℃、5% CO2、95%空气的培养箱中。每24~48 h换液1次。
2.2心房肌细胞Cx43的RNA干扰技术由上海吉玛公司合成小鼠Cx43 mRNA的siRNA Oligo,共有4对阳性序列,1对阴性对照,序列见表 2。细胞接种于6孔板上,使其转染密度为50%~70%。分别取100 μL Claycomb培养基稀释3 μL siRNA (终浓度为50 nmol/L)和2 μL LipofectamineTM2000试剂,室温下孵育5 min。两者混合后在室温下孵育20 min。每孔待转染细胞加入无血清培养基1000 μL,再加入上述siRNA和LipofectamineTM2000混合物,轻轻地前后摇动培养板混匀,37 ℃、5%CO2的培养箱中孵育6 h后更换含血清的生长培养基。RNA干扰实验分为Cx43 siRNA-I组、Cx43 siRNA-Ⅱ组、Cx43 siRNA-Ⅲ组、Cx43 siRNA-IV组、空白组和阴性对照,转染48 h后提取细胞总蛋白,Western blot法检测各组细胞中Cx43的表达情况。
2.3Western blot实验剪碎的心房组织标本和敲低Cx43表达的细胞,加入裂解液,冰上裂解30 min,12 000 r/min离心20 min,取上清,分装后储存于-80 ℃。测定蛋白浓度后,4×上样缓冲液(Invitrogen)稀释后的30 μg 样本,95 °C 煮5 min。10% SDS-聚丙烯酰胺凝胶分离蛋白,然后转至硝酸纤维素膜(amersham)。TBST-脱脂牛奶中室温下封闭2 h,加入anti-Cx43的 I 抗(1∶1 000,CST),4 °C过夜。以anti-GAPDH(1∶1 000, Zymed)为内参照。TBST洗3次,每次10 min,封闭液稀释的HRP标记的抗兔IgG(KPL)中孵育1 h。TBST洗3次,每次10 min,加入ECL (Pierce),X光片显影。ImageJ软件对条带进行定量。

表2 siRNA序列
2.4Real-time PCR将经Cx43 siRNA转染48 h后的HL-1细胞弃去培养基,预冷PBS洗3遍,每孔加入800 μL TRIzol,吹打后混匀,提取总mRNA。取1 μg总RNA逆转录(TaKaRa)为cDNA。使用SYBR Premix Ex TaqTM(TaKaRa)进行扩增,每个样本加入2 μL cDNA,总体积为25 μL。在MJ Research DNA Engine Opticon® 2 连续荧光检测系统(MJ Research)上进行实时定量聚合酶链反应。人 Cx43的正向引物序列为5’-TTG CTG CGA ACC TAC ATC ATC AGT-3’, 反向引物序列为5’-GCC AGG GAC ACC AAG GAC AC-3’;小鼠 Cx43的正向引物序列为5’-GAT CGC GTG AAG GGA AGA AG-3’,反向引物序列为5’-CAG CCA TTG AAG TAA GCA TAT TTT G-3’;小鼠 LCC α1c亚基的正向引物序列为 5’-ATG AGA CCC GCA GCG TAA-3’,反向引物序列为5’-GAG GCA GAG CGA AGG AAA -3’;β-actin的正向引物序列为5’-TGT CCC TGT ATG CCT CTG GT-3’,反向引物序列为5’-GAT GTC ACG CAC GAT TTC C-3’。通过2-ΔΔCt计算相对表达水平。
2.5免疫共沉淀小鼠引颈处死,取心房组织,冰上剪碎,加入裂解液(50 mmol/L NaCl、20 mmol/L HEPES、1% Triton X-100、0.5% NP-40、1 mmol/L EDTA、1 mmol/L PMSF、 1 mmol/L NaVO3、50 mmol/L NaF 和蛋白酶抑制剂)匀浆,制备组织裂解液。3 500 r/min 离心 15 min, 去沉淀。预处理组织裂解液,取1 mL 上清液加入30 μL protein A/G 琼脂糖珠(Upstate),4 ℃ 缓慢摇晃30 min。3 500 r/min 离心5 min,取上清液,测蛋白浓度(Bio-Rad)。每1 mL组织裂解液中含有400 μg蛋白;1 mL组织裂解液中加入8 μg兔抗Cav2.1 (LCC α1c; Alomone),4 ℃ 缓慢摇晃1 h。加入50 μL protein A/G琼脂糖珠,4 ℃缓慢摇晃1 h;将 抗体-protein A/G琼脂糖珠复合物2 000 r/min离心5 min,裂解缓冲液洗3遍。加入100 μL裂解液和25 μL 4×上样缓冲液;取30 μL样本,95 ℃,10 min。Western blot检测Cx43的表达;等量兔IgG加入组织裂解液,以及预去除LCC α1c的心房组织裂解液作为阴性对照组;心房组织裂解液作为阳性对照。
2.6激光共聚焦显微镜成像原代乳大鼠心房肌细胞生长于盖玻片上,4%多聚甲醛固定15 min,0.25% Triton X-100透化15 min。1%牛血清白蛋白室温封闭1 h。PBS洗3遍,分别加anti-Cx43的 I 抗和anti-Cav2.1(LCCα1c)I 抗(1∶100),4 ℃ 过夜。PBS洗3遍,分别加入相对应的 II 抗(1∶100),室温1 h。DAPI (Vector Laboratories)染核后,封片;激光共聚焦显微镜(Leica)下观察。
2.7全细胞膜片钳技术记录ICa,LHL-1细胞经干扰Cx43表达后,接种于35 mm培养皿中,弃去培养基,予0.05%胰蛋白酶-EDTA消化约1 min,终止消化,细胞在6 h内用于电生理实验。全细胞膜片钳技术记录ICa,L,细胞外液(mmol/L):TEA-Cl 140, CaCl25, MgCl22, HEPES 10, Glucose 10(pH 7.4)。玻璃电极由硼硅玻璃毛细管(Corning)拉制而成。充满细胞内液后电极尖端电阻为2~3 ΩM。细胞内液(mmol/L): CsCl 100, TEA-Cl 20, Na2ATP 5, Na2GTP 0.4, EGTA 10, HEPES 10 (pH 7.2)。
液接电位补偿后用负压使电极与细胞表面形成高阻封接后(阻抗>1 GΩ),在接触细胞前,补偿尖端电位。给负压破膜,形成全细胞记录。用Axopatch 200B 放大器和Digidata 1200B-pClamp 7.0 data-acquisition system (Axon Instruments)记录电流信号。5 kHz过滤信号,储存于电脑的硬盘中。串联电阻(Rs)为3~5 MΩ,电补70%~80%以使在记录电流和钳夹的膜上电压下降时电容激增缩小至最小,并在电流记录过程中保持稳定。为了避免细胞体积所致的差异,所有数据均以电流密度表示。实验在(25±1) ℃ 左右进行。
3统计学处理
所有数据用均数±标准误(mean±SEM)表示,用SPSS 11.0统计软件分析。两组间的比较使用t检验,多组间均数比较用单因素方差分析,组间均数的两两比较使用LSD法和SNK法。以P<0.05为差异有统计学意义。
结果
1SR和AF患者的Cx43 mRNA和蛋白的表达差异
本研究中,我们发现与SR组(n=7) 相比,AF组(n=9)患者心房肌组织中Cx43 的mRNA表达明显降低 (P<0.05)。蛋白水平的表达差异结果亦相似(P<0.05),见图 1。我们之前的研究中已发现AF组心房肌组织中LCC α1c的mRNA和蛋白水平明显低于SR组。因此我们观察心房肌细胞中LCC α1c是否与Cx43存在相互作用。
2Cx43 siRNA成功沉默HL-1细胞Cx43的表达
将Cx43 siRNA序列转染至HL-1细胞,干扰48 h,Western blot检测Cx43的表达,提示Cx43 siRNA-IV为有效靶序列,见图2。
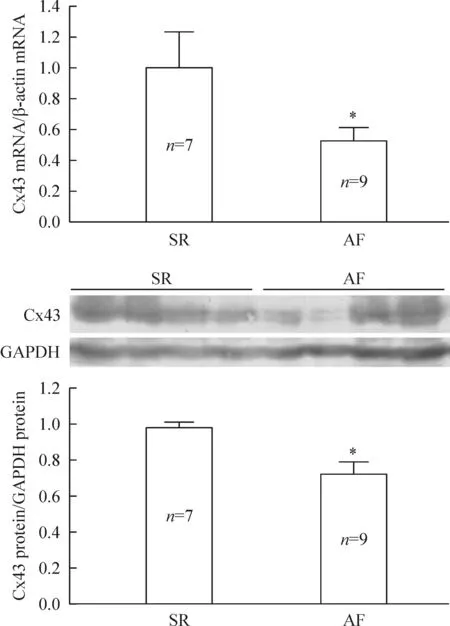
Figure 1.The expression of Cx43 at mRNA and protein levels in the atrium tissues from the patients with SR and AF.Mean±SEM.*P<0.05vsSR.
图1窦性心律和房颤患者心房肌组织中Cx43表达水平的比较

Figure 2.Cx43 expression in HL-1 cells after knockdown ofCx43 expression by siRNA. Screening of effective interference chain was analyzed by Western blot.
图2筛选有效Cx43 siRNA序列
3Cx43 siRNA敲低HL-1细胞Cx43对LCC的影响
经有效Cx43 siRNA处理HL-1细胞48 h后,检测Cx43和LCC α1c的mRNA表达。结果发现LCC α1c基因表达明显被抑制(P<0.05),见图 3。
4敲低HL-1细胞Cx43表达对ICa,L的影响
经有效Cx43 siRNA处理HL-1细胞48 h后,将细胞接种至35 mm培养皿,全细胞膜片钳检测ICa,L。结果发现HL-1细胞的Cx43被敲低后,ICa,L明显被抑制(P<0.01),见图 4。
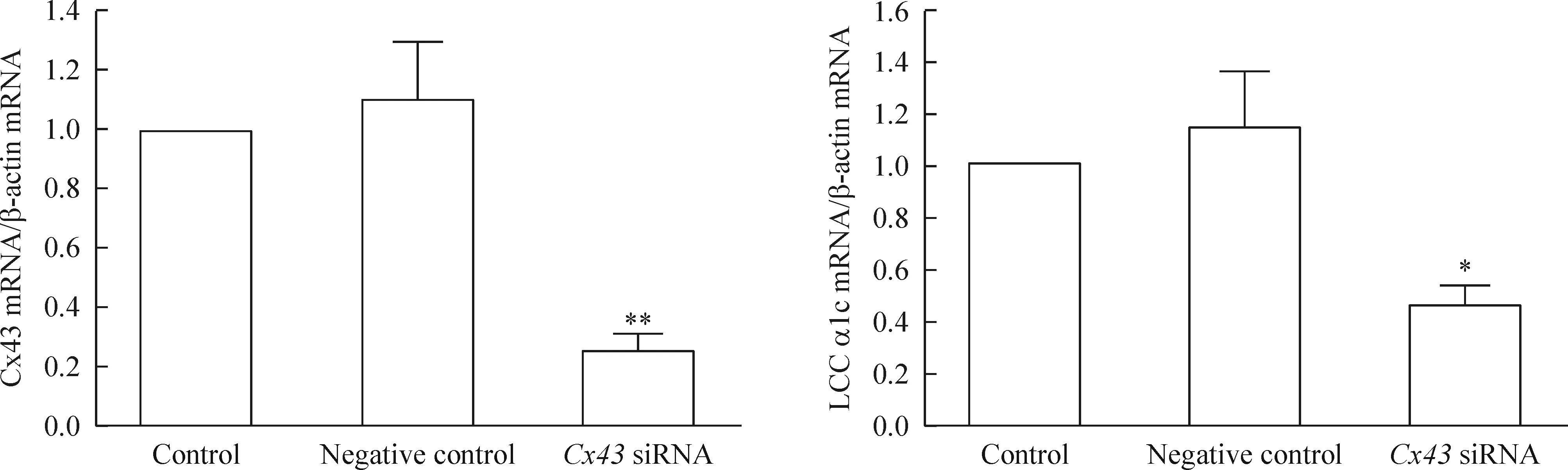
Figure 3.The mRNA expression of Cx43 and LCC α1c in the HL-1 cells before and after knockdown ofCx43. The mRNA levels of Cx43 and LCC α1c subunit were analyzed by real-time PCR. β-actin served as an internal control. Mean±SEM.n=4.*P<0.05,**P<0.01vscontrol.
图3敲低Cx43对HL-1细胞Cx43和LCC α1c mRNA表达的影响
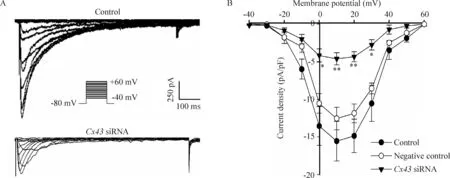
Figure 4.TheICa,Lcurrent-voltage relationship in the HL-1 cells before and after knockdown ofCx43. A: representative recordings of whole-cellICa,L.ICa,Lwas measured as the nicardipine-sensitive current. B: representativeICa,Ldensity-voltage relationships. Mean±SEM.n=7~8.*P<0.05,**P<0.01vscontrol.
图4敲低Cx43对HL-1细胞ICa,L密度的影响
5Cx43与LCC α1c的相互作用
干扰Cx43的表达,可影响LCC和ICa,L的mRNA表达,提示Cx43与LCC α1c可能存在相互作用。用免疫共沉淀实验和激光共聚焦显微镜成像观察Cx43与LCC α1c的共定位;用LCC α1c的 I 抗包被琼脂糖珠沉淀LCC α1c,Western blot检测到Cx43的存在;免疫荧光提示在原代乳大鼠心房肌细胞中,LCC α1c与Cx43存在共定位现象,见图5。
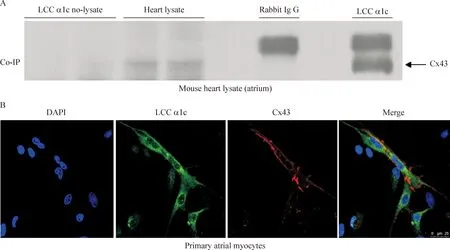
Figure 5.The interaction of LCC α1c with Cx43. A: co-immunoprecipitation of LCC α1c with Cx43. Immunoblots for Cx43 from samples exposed to protein A/G beads coated with rabbit IgG (negative control) or LCC α1c antibody. B: co-localization of LCC α1c with Cx43 confirmed by confocal microscopy. HL-1 cells were co-stained with anti-LCC α1c antibody, anti-Cx43 and DAPI. Merged images of LCC α1c (green), Cx 43 (red) and DAPI staining (blue) were shown. The scale bar= 25 μm.
图5Cx43与LCC α1c的相互作用
讨论
随着我国人口的老龄化和心血管疾病的生存率的增加,AF发病率逐年上升,但其发病机制尚未得到阐明,需进一步研究;众所周知,心肌细胞间通讯异常在AF的发病中起着非常重要的作用。心脏电活动的协调是心肌细胞间通过位于闰盘的缝隙连接通道形成的细胞间偶联维持的。Cxs是组成连接子和缝隙连接的主要蛋白。近年来的研究发现改善缝隙连接开放,可有效增加心肌细胞间传导,起抗心律失常的作用[8]。心房中主要有Cx40和Cx43,两者表达量相等,是心房肌细胞间传导的主要决定因素。以往关于Cxs与AF的研究主要集中在Cx40,但Cx43在AF发病中也起着非常重要的作用。
现有研究表明AF可能与Cx43的表达下降,去磷酸化和分布侧边化相关[5]。其可能机制是Cx43表达下调使心房肌细胞间的传导速度减慢,或异质性分布使相邻细胞具有不同的阻抗和传导速度,产生许多微小传导阻滞区,形成微小折返环路,诱发AF。正常情况下,心肌细胞表达的Cx43具有非常大的冗余度。Cx43基因敲除小鼠使Cx43降低大于90%时,才引起心肌细胞电传导减慢[9]。提示心肌细胞Cx43分布不均匀,导致电传导速度减慢[8],与Cx43表达降低协同作用更易导致心律失常的发生。
Cx43除了在心肌细胞间电传导中起重要作用,还可通过组成半通道,允许一些小分子通过,其中包括Na+和Ca2+;近年来有研究发现,Cx43可直接参与膜上离子通道的调控。在致心律失常右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)的研究中表明,Cx43和PKP2 共存于一个大分子复合物中,敲除PKP2可使Cx43表达下降,Cx43重新分布,缝隙连接斑减少,从而诱发心律失常[7]。进一步研究发现,HL-1细胞中,PKP2可与电压门控的钠离子通道相互作用;敲除PKP2可降低钠电流,使动作电位传播速率减慢。免疫共沉淀结果提示PKP2和钠离子通道共定位[10],提示Cx43、PKP2和钠离子通道三者共存于一个复合物中,Cx43的表达改变可能直接影响钠离子通道的特性,从而诱发心律失常[10]。新近有研究发现,Cx43和NaV1.5可能参与心肌纤维化。过表达钙调神经磷酸酶(calcineurin A,CnA)小鼠诱导心肌肥厚模型,与野生型小鼠相比,MHC-CnA小鼠出生后第 1 周即出现Cx43和NaV1.5的表达明显降低,第 4 周出现纤维化指标明显升高,心室出现纤维化,提示Cx43和NaV1.5的表达明显降低可导致纤维化[11]。
心房肌细胞的电重塑和结构重塑是AF发病的主要机制;电重塑的主要标志是心房有效不应期缩短,频率适应性丧失和心房传导延长。心房肌细胞ICa,L降低是AF电重塑时心房肌有效不应期缩短的主要原因之一[12];此外,有研究发现AF时心房Cx43分布与纤维化相关[13],但心房肌细胞中Cx43是否参与钙电流的调控,从而参与AF的发病机制,目前尚未有研究报道。本实验中我们发现AF患者心房组织标本中,Cx43的mRNA和蛋白表达明显低于SR患者;而之前的研究提示ICa,L和LCC亚单位的表达亦以AF组表达明显降低,提示两者之间可能存在相互作用;进一步研究发现,敲低Cx43可明显使LCC α1c亚单位的表达下调,以及ICa,L的密度明显下调;在本研究中,我们还观察了Cx43和LCC α1c是否通过共定位相互作用。免疫共沉淀发现LCC α1c可将Cx43从小鼠心脏组织裂解中拖带下来,提示2个蛋白质之间存在直接或间接的相互作用;免疫荧光提示在原代乳大鼠心房肌细胞中,Cx43和LCC α1c存在共定位;但该结果存在一定的局限性,免疫荧光虽然提示Cx43和LCC α1c共同存在于同一个细胞中。但拟合后的图像可能反映真实的共定位,亦或者仅仅是非常靠近。
综上所述,我们认为在心房肌细胞中,Cx43可能通过与LCC共定位,直接调控ICa,L;在病理情况下,Cx43表达降低,可抑制ICa,L,从而促进AF的发生和发展。
[参考文献]
[1]Hertervig EJ, Yuan S, Carlson J, et al. Evidence for electrical remodelling of the atrial myocardium in patients with atrial fibrillation. A study using the monophasic action potential recording technique[J]. Clin Physiol Funct Imaging, 2002, 22(1):8-12.
[2]Nattel S. New ideas about atrial fibrillation 50 years on[J]. Nature, 2002, 415(6868):219-226.
[3]Everett TH, Olgin JE. Atrial fibrosis and the mechanisms of atrial fibrillation[J]. Heart Rhythm, 2007, 4(3 Suppl):S24-S27.
[4]Dhein S, Hagen A, Jozwiak J, et al. Improving cardiac gap junction communication as a new antiarrhythmic mechanism: the action of antiarrhythmic peptides[J]. Naunyn Schmiedebergs Arch Pharmacol, 2010, 381(3):221-234.
[5]余志斌,圣娟娟. 心肌细胞缝隙连接重塑和心律失常[J]. 生理学报, 2011, 63(6):586-592.
[6]Oxford EM, Musa H, Maass K, et al. Connexin43 remo-deling caused by inhibition of plakophilin-2 expression in cardiac cells[J]. Circ Res, 2007, 101(7):703-711.
[7]Sato PY, Musa H, Coombs W, et al. Loss of plakophilin-2 expression leads to decreased sodium current and slower conduction velocity in cultured cardiac myocytes[J]. Circ Res, 2009, 105(6):523-526.
[8]Boulaksil M, Winckels SK, Engelen MA, et al. Heterogeneous Connexin43 distribution in heart failure is associated with dispersed conduction and enhanced susceptibility to ventricular arrhythmias[J]. Eur J Heart Fail, 2010, 12(9):913-921.
[9]Gutstein DE, Morley GE, Tamaddon H, et al. Conduction slowing and sudden arrhythmic death in mice with cardiac-restricted inactivation of connexin43[J]. Circ Res, 2001, 88(3):333-339.
[10]Sato PY, Coombs W, Lin X, et al. Interactions between ankyrin-G, Plakophilin-2, and Connexin43 at the cardiac intercalated disc[J]. Circ Res, 2011, 109(2):193-201.
[11]Fontes MS, Raaijmakers AJ, van Doorn T, et al. Changes in Cx43 and NaV1.5 expression precede the occurrence of substantial fibrosis in calcineurin-induced murine cardiac hypertrophy [J]. PLoS One, 2014, 9(1):e87226.
[12]Rao F, Deng CY, Wu SL, et al. Involvement of Src in L-type Ca2+channel depression induced by macrophage migration inhibitory factor in atrial myocytes [J]. J Mol Cell Cardiol, 2009, 47(5):586-594.
[13]何文聪,李裕舒,罗明华,等.心房颤动患者心房纤维化与缝隙连接重构的关系[J].中国病理生理杂志,2008,24(10):1943-1947 .
(责任编辑: 陈妙玲, 罗森)


