磺酸化多壁碳纳米管对溶液中铀的吸附性能研究
磺酸化多壁碳纳米管对溶液中铀的吸附性能研究
崔丹妮杨倩苏晓龙邱燕芳
(东华理工大学,江西 南昌 330013)
摘要:本文采用发烟硫酸气固转换磺酸法对多壁碳纳米管进行磺酸化,并用红外对磺酸化结果进行表征,考察了pH、接触时间、铀初始浓度、温度对磺酸化多壁碳纳米管对溶液中铀的吸附的影响。结果表明,磺酸化多壁碳纳米管对铀的吸附受pH值影响很大,最佳pH为6,吸附在40min达平衡,磺酸化后多壁碳纳米管对铀的吸附量增大了4倍;磺酸化多壁碳纳米管对铀的吸附行为符合Langmuir等温吸附,其单层饱和吸附量为249.38mg/g,动力学数据拟合符合拟二级动力学模型,说明吸附是由化学作用力控制的;热力学参数表明,多壁碳纳米管对铀的吸附是自发的、吸热的反应。
关键词:多壁碳纳米管磺酸化铀吸附
近年来,随着核技术的发展,在铀矿开采、铀生产加工及应用过程中产生了大量的含铀废水,这些含铀废水会对水体、土壤甚至是人类的健康造成严重的危害。目前,处理溶液中铀的方法主要有溶剂萃取法[1]、离子交换法[2]和吸附法[3]等。吸附法因其去除率高、操作简便受到人们的广泛关注。传统的吸附剂存在吸附容量差、吸附速度缓慢等缺陷,如何克服这些缺点,寻找新型、高效的铀吸附材料具有重要的现实意义。
自1991年Lijima[4]发现了碳纳米管以来,碳纳米管受到了各界的广泛关注。碳纳米管具有高度多孔、中空结构、比表面积大等特点,因此,它被认为是一种有效的吸附有机污染物、重金属和放射性核素的吸附剂。近几年,人们研究了氧化[5]或羧基化[6]后的多壁碳纳米管(MWCNTs)对铀的吸附,但还未研究其他改性对多壁碳纳米管对铀的吸附。本文采用气固转换法制备了磺酸化多壁碳纳米管(MWCNTs-SO3H),研究了磺酸化多壁碳纳米管对溶液铀的吸附性能。
1实验部分
1.1 仪器与试剂
多壁碳纳米管,深圳纳米港股份有限公司;浓硫酸,阿拉丁;浓硝酸,南昌鑫光精细化工厂;铀标准溶液10mg/mL;氯乙酸-乙酸钠缓冲溶液(pH=2.5);偶氮砷Ⅲ,阿拉丁;浓盐酸,西陇化工股份有限公司。
傅里叶变换红外光谱仪Nicolet iS5,赛默飞世尔科技有限公司;可见分光光度计721E,上海光谱仪器有限公司;开启式管式炉,杭州卓驰仪器有限公司;PHS-3C型酸度计,上海仪电科学仪器股份有限公司。
1.2 吸附剂的制备
MWCNTs的纯化:准确称取MWCNTs0.5g于反应槽中,将反应槽放入开启式管式炉中,530℃下煅烧0.5小时。
MWCNTs的羧基化:准确称取纯化后的MWCNTs0.5g于500mL烧杯中,加入150mL混酸(V浓硫酸:V浓硝酸=3:1)与其混合,放入超声1小时,油浴60℃加热反应4h,冷却至室温;离心洗涤至上清液至中性,将所得产品于60℃真空干燥箱中干燥,得羧基化MWCNTs.
MWCNTs的磺酸化:基本同文献[7],但条件略有改变,具体过程为:将5mL发烟硫酸(50% SO3/H2SO4)加入100mL高压反应釜的聚四氟乙烯内衬中;准确称取0.20g羧基化MWCNTs于聚四氟乙烯烧杯中,并将其放入高压反应釜中,密封后在343K下反应24h,取出,用大量去离子水清洗数遍,用热水(>353K)清洗至滤液无游离的硫酸根离子存在后,在333K下真空干燥后,即得到MWCNTs-SO3H。
1.3 吸附实验
称取0.01000g的吸附剂放入150mL的锥形瓶中,再向锥形瓶中加入50mL一定浓度和pH值的铀U(VI)溶液,把锥形瓶放入振荡器中振荡一定时间,取出一定量的溶液离心,采用偶氮胂III法[8]测定吸附后上层清液的铀浓度,采用差减法计算出吸附容量。吸附量q(mg·g-1)根据公式1计算。
(1)
C0和Ce分别是吸附前后离子的浓度,mg·L-1;V是溶液的体积,L;m是干燥的吸附剂的质量,g。
2结果与讨论
2.1 表征
用傅立叶变换红外光谱仪分析碳纳米管表面的官能团。数据测试范围为 4000crn-1到500cm-1,平均16倍扫描,扫描时扣除CO2的干扰。IR谱图见图1。由图1可以看到MWCNTs-SO3H在1118cm-1处出现了磺酸基的吸收峰,由此MWCNTs表面已经引入了磺酸基团。
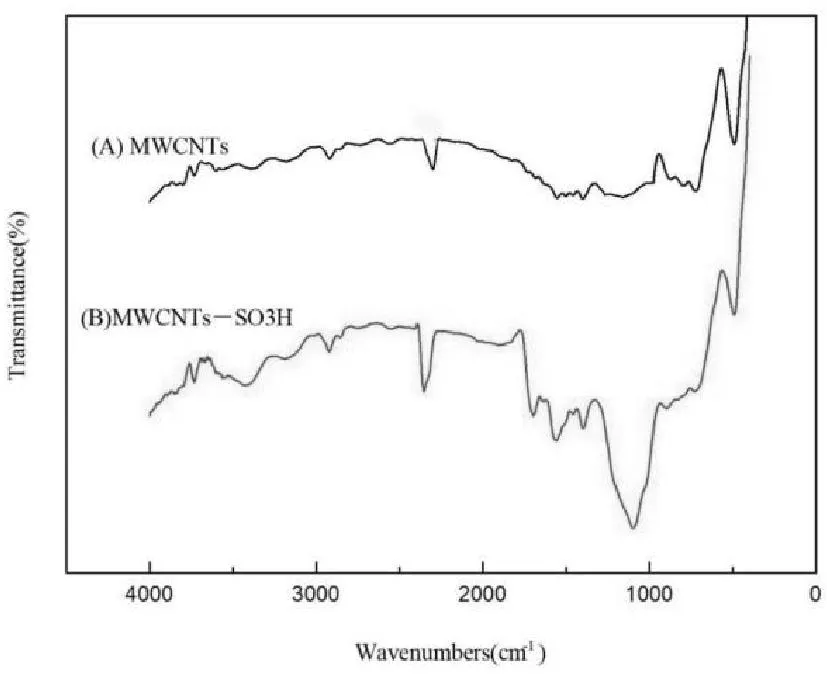
图1 MWCNTs(A)和MWCNTs-SO 3H(B) 的FT-IR谱图
2.2 吸附性能
实验探讨了pH值、时间、铀U(VI)的初始浓度和温度对MWCNTs-SO3H对铀的吸附的影响,并通过等温吸附模型、吸附动力学、吸附热力学对吸附过程进行研究。
2.2.1溶液初始pH的影响
由于pH值对溶液中铀酰离子的形态以及MWCNTs的表面反应官能团的结构有很大影响,因此溶液初始pH值是影响多壁碳纳米管对铀的吸附能力的一个关键因素[9],实验研究了溶液初始pH值(2.0-7.0)对MWCNTs和MWCNTs-SO3H吸附铀(VI)的影响,如图2所示。
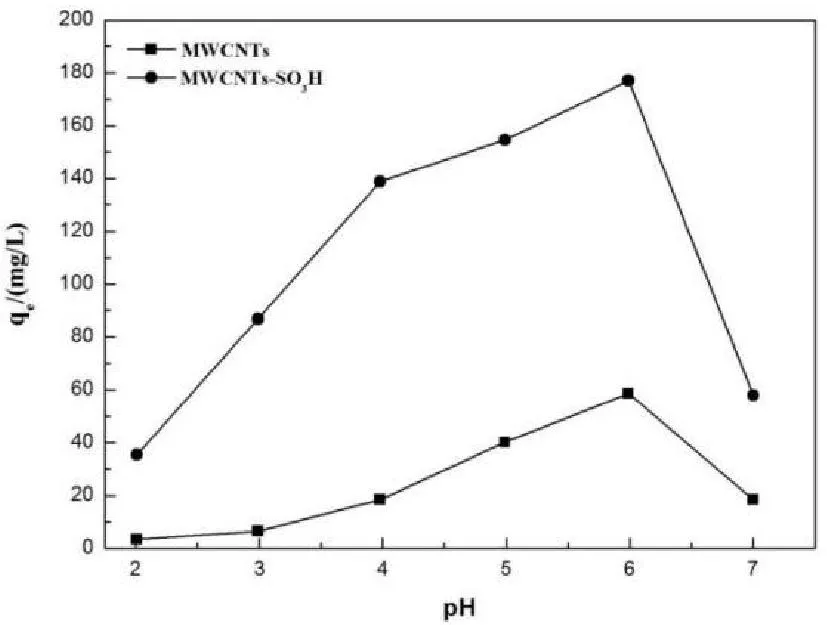
图2 溶液初始pH对MWCNTs和MWCNTs-SO 3H 吸附铀(VI)的影响(C 0=50mg·L -1;V=50mL; m=0.0100g;T=298.15K)
由图2可知,MWCNTs-SO3H对铀(VI)的吸附量随着pH值由2.0升至6.0而不断增加;pH=6.0时吸附量达到最大;然后吸附量逐渐随着pH值的增大而减小。在最佳吸附pH=6.0时,MWCNTs和MWCNTs-SO3H对铀的吸附量分别为58.6和177.0mg·g-1,表明磺酸基团的引入可提高多壁碳纳米管对铀(VI)的吸附量。这是因为经过磺酸化后的多壁碳纳米管表面增加了磺酸基(-SO3H)、羧基(-COOH)等官能团,这些基团中的含氧配体会给UO22+的空轨道提供电子,从而与UO22+发生配位,使其吸附量增加。
2.2.2吸附动力学
吸附时间对MWCNTs和MWCNTs-SO3H吸附铀(VI)的影响如图3所示。由图可知,在反应最初,MWCNTs和MWCNTs-SO3H对铀(VI)的吸附量随着时间的增加而迅速增加,并分别在50min、40min左右达到吸附平衡,最大吸附量分别为56mg/g和189mg/g,因此,50min和40min为MWCNTs和MWCNTs-SO3H吸附铀的最佳时间。为了使反应充分进行,在后续的实验中我们选取3h作为反应时间。
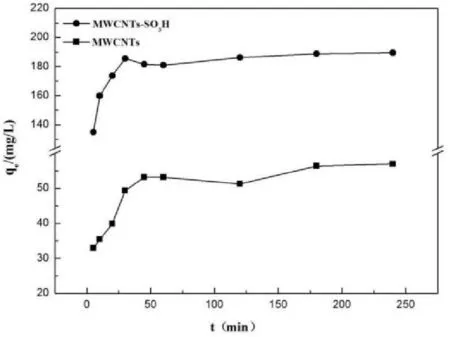
图3 吸附时间对MWCNTs和MWCNTs-SO 3H 吸附铀(VI)的影响(pH=6.0;C 0=50mg·L -1; V=50mL;m=0.0100g;T=298.15K)
为了进一步考察吸附时间对MWCNTs和MWCNTs-SO3H吸附铀的影响,确定其吸附速率,运用准一级[10]和准二级[11]动力学模型对MWCNTs和MWCNTs-SO3H吸附铀(VI)的机理进行研究,其线性表达式如方程(2)和(3)所示:
(2)
(3)
其中k1(min-1)和k2(g·mg-1·min-1)分别为准一级和准二级动力学模型中的吸附速率速率常数,qt(mg·g-1)为t时间内的吸附量。
分别以log(qe-qt)对t和t/qt对t作图,采用准一级和准二级动力学模型对实验数据进行线性拟合,结果如图4所示,由图中的曲线斜率和截距计算得到的qe,cal、k1和k2值列于表1。
由表1可以看出,准二级动力学拟合线性相关系数较准一级动力学拟合更高,并且由准二级动力学拟合得到平衡时最大吸附量qe,cal比由准一级动力学拟合得到的qe,cal值与实验值qe,exp更相近,所以准二级动力学方程能更好的描述MWCNTs和MWCNTs-SO3H对铀的吸附过程,而且与实验结果一致,这表明MWCNTs和MWCNTs-SO3H对铀的吸附过程是受化学作用控制的。
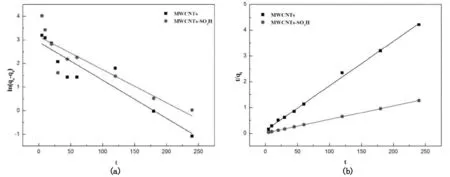
图4 MWCNTs和MWCNTs-SO 3H吸附铀(VI)的准一级(a)和准二级动力学(b)拟合曲线
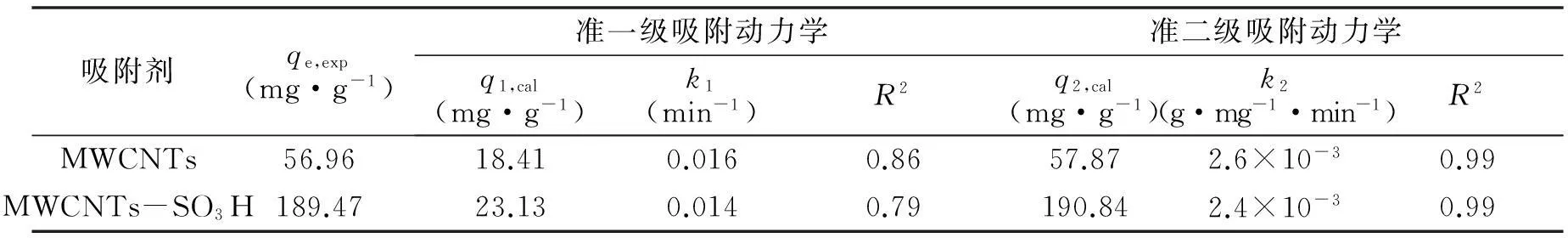
吸附剂qe,exp(mg·g-1)准一级吸附动力学准二级吸附动力学q1,cal(mg·g-1)k1(min-1)R2q2,cal(mg·g-1)k2(g·mg-1·min-1)R2MWCNTs56.9618.410.0160.8657.872.6×10-30.99MWCNTs-SO3H189.4723.130.0140.79190.842.4×10-30.99
2.2.3吸附等温线
初始浓度是影响吸附剂铀(VI)吸附性能的又一重要因素,在298.15K及最佳pH值时,不同的铀的初始浓度(5~110mg·L-1)对MWCNTs和MWCNTs-SO3H吸附铀的影响如图5所示,从铀的初始浓度与吸附量关系曲线可以看出,随着铀的初始浓度由10增加110mg·L-1,MWCNTs-SO3H对铀(VI)的吸附量在不断的增加,且其吸附量增加幅度比MWCNTs的大,表明MWCNTs-SO3H对铀(VI)的吸附性能优于MWCNTs。
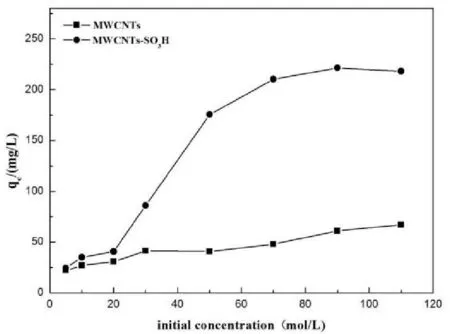
图5 溶液初始浓度对MWCNTs和MWCNTs-SO 3H 吸附铀(VI)的影响(pH=6.0;t=3h;V=50mL; m=0.0100g;T=298.15K)
为了进一步探究初始浓度对MWCNTs和MWCNTs-SO3H吸附铀(VI)的影响,掌握吸附剂的吸附容量和吸附的机理,下面进行吸附等温线的研究。Langmuir和Freundlich吸附等温方程[12]是研究水溶液中铀(VI)吸附最常用的两种吸附等温模型。其中Langmuir吸附等温方程假设吸附为单层均一吸附,且每个吸附位点只能容纳一个吸附质分子,其方程如式(4)所示。
(4)
其线性表达式如式(5)所示。
(5)
式中KL为与吸附能量相关的参数,其值越大表明吸附的亲和力越大;qm为单层饱和吸附容量,mg·g-1。
Freundlich吸附模型假设吸附剂表面不是均一的,且吸附位点分布不是均匀的[30]。其等温线模型的非线性和线性表达式分别为式(6)和(7)。
(6)
(7)
式中:KF和n分别为与吸附容量和吸附强度相关的参数。
分别以Ce/qe对Ce、lnqe对lnCe作图,得到Langmuir和Freundlich吸附等温方程的拟合曲线见图6,由斜率和截距计算得到相关的参数列于表2,由表可知,MWCNTs和MWCNTs-SO3H对铀(VI)的吸附平衡数据对Langmuir吸附等温式的拟合的线性相关度R2>0.90,而对Freundlich拟合的线性相关系数R2<0.90,因此MWCNTs和MWCNTs-SO3H对铀(VI)的吸附符合Langmuir吸附等温模型,说明铀(VI)在MWCNTs和MWCNTs-SO3H上的吸附为单分子层的,吸附的主导作用力为表面的功能基团与铀的结合。由Langmuir吸附参数单层饱和吸附容量qm可知,MWCNTs磺酸化后对铀(VI)吸附容量由63.65升高至249.38mg·g-1。
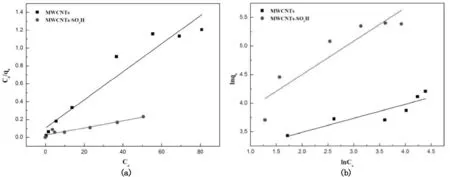
图6 MWCNTs和MWCNTs-SO 3H吸附铀(VI)的Langmuir(a)和Freundlich(b)等温吸附拟合曲线
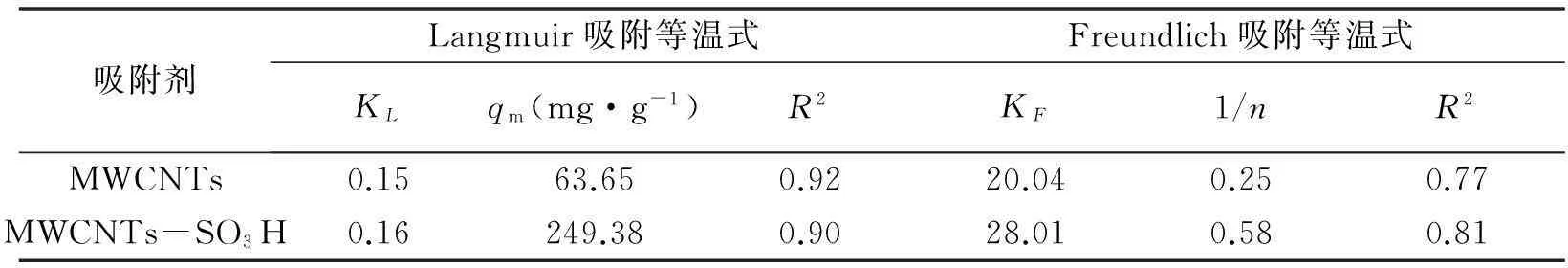
吸附剂Langmuir吸附等温式Freundlich吸附等温式KLqm(mg·g-1)R2KF1/nR2MWCNTs0.1563.650.9220.040.250.77MWCNTs-SO3H0.16249.380.9028.010.580.81
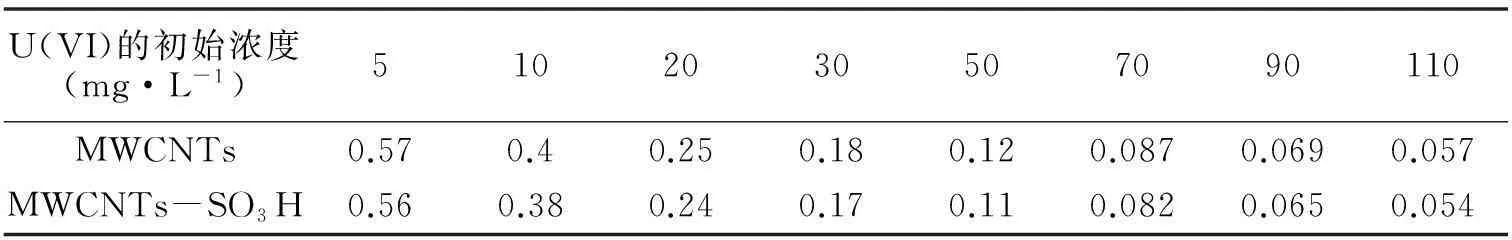
表3 不同初始浓度下的 R L值
RL是用于判断符合Langmuir吸附等温式的吸附剂的吸附行为是否可行的一个参数,其方程如式8所示。
(8)
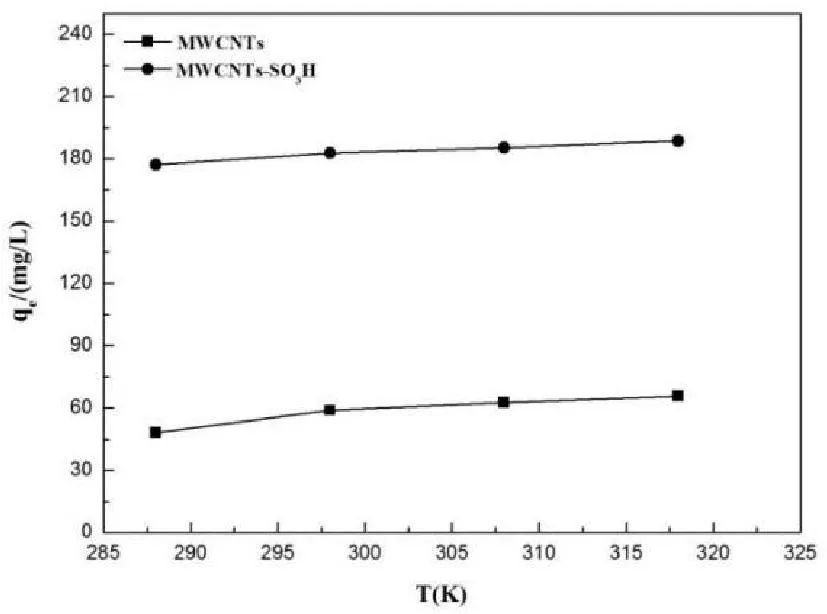
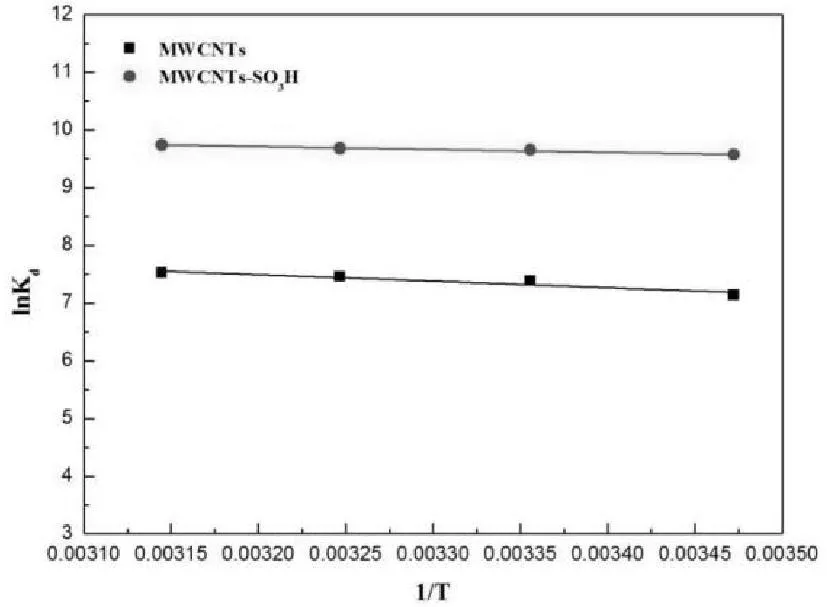
在不同的初始浓度(5~110mg·L-1)下,RL值如表3所示。由表可知,在初始浓度为5~110mg·L-1时,其0 2.2.4吸附热力学 研究不同温度(288.15K、298.15K、308.15K和318.15K)对MWCNTs和MWCNTs-SO3H吸附铀(VI)的影响。由图7可知,随着溶液温度的升高,MWCNTs和MWCNTs-SO3H对铀(VI)的吸附量也随之增加,但无显著变化,说明吸附剂对铀(VI)的吸附均为吸热过程,升高温度有利于吸附进行,同时温度对铀(VI)在MWCNTs和MWCNTs-SO3H上吸附的影响较小。考虑到实际应用,在后续实验中,选择在室温298.15K下进行MWCNTs和MWCNTs-SO3H吸附铀(VI)的实验。 图7 温度对MWCNTs和MWCNTs-SO 3H 吸附铀(VI)的影响(pH=6.0;V=50mL;m=0.0100g; C 0=50mg·L -1) 热力学函数如Gibbs自由能变的变化(ΔG,kJ·mol-1)、焓变(ΔH,kJ·mol-1)和熵变(ΔS,J·K-1·mol-1)对进一步考察温度对MWCNTs和MWCNTs-SO3H吸附水溶液中的铀的影响有重要的意义[13]。 ΔH和ΔS的值可由式9计算得到。 (9) 其中R为气体摩尔常数,R=8.314 J·K-1·mol-1。以lnKd对1/T作图(图8),由斜率和截距可以分别得到ΔH和ΔS的值。在不同温度下的ΔG值根据式10计算。 ΔG=ΔH-TΔS (10) 图8 MWCNTs和MWCNTs-SO 3H对铀(VI)吸附 的lnK d对1/T关系曲线 热力学函数值如表4所示,由表中数据可知:ΔH为正值,这表明MWCNTs和MWCNTs-SO3H对铀(VI)的吸附均为吸热过程;ΔS大于零,这说明MWCNTs和MWCNTs-SO3H吸附铀后,混乱程度增加,这是因为水溶液中铀是以水合离子形式存在,当铀离子被吸附剂吸附后,结合水重新回到溶液中,这个过程会增加系统的熵值;ΔG<0,这说明MWCNTs和MWCNTs-SO3H对铀的吸附均是自发过程,且随着温度的增加,其绝对值不断增大,表明升高温度有利于吸附进行,与实验结果相符。 3结论 成功地制备了磺酸化的多壁碳纳米管。对磺酸化多壁碳纳米管对铀的吸附性能的研究结果表明,磺酸化后多壁碳纳米管对铀的吸附量增大了4倍,证明磺 表4 MWCNTs和MWCNTs-SO 3H吸附铀(VI)的热力学函数值 酸化有助于提高多壁碳纳米管对铀的吸附能力;磺酸化多壁碳纳米管对铀的吸附受pH值影响很大,最佳pH为6,吸附在40min达平衡,磺酸化多壁碳纳米管对铀的吸附行为符合Langmuir等温吸附,其单层饱和吸附量为249.38mg/g,动力学数据拟合符合拟二级动力学模型,说明吸附是由化学作用力控制的;热力学参数表明,该吸附是吸热自发的过程。本研究为多壁碳纳米管在放射性铀废水处理方面的研究奠定了理论基础。 参考文献 [1]Moore F L.Liquid-Liquid Extraction of Uranium and Plutonium from Hydrochloric Solution with Tri(iso-octyl)amine[J].Analytical Chemistry,1958,30(5):908-911. [2]蔡萍莉,谭凯旋,史文革,等.酸法地浸采铀废水离子交换与中和试验研究[J].现代矿业,2010,32(11):1398-1402. [3]Dushenkov S,Vasudev D,Kapulnik Y,et al.Removal of uranium from water using terrestrial plants[J].Environmental Science & Technology,1997,31(12):3468-3474. [4]Iijima S.Nature(London)Phys[J].Sci,1991,354:56. [5]Sun Y,Yang S,Sheng G,et al.The removal of U(VI)from aqueous solution by oxidized multiwalled carbon nanotubes[J].Journal of environmental radioactivity,2012,105:40-47. [6]刘淑娟,李金英,罗明标,等.纯化及羧化多壁碳纳米管吸附铀的研究[J].核化学与放射化学,2012,33(5):285-290. [7]R.Xing,N.Liu,Y.Liu,et al.Novel Solid Acid Catalysts:Sulfonic Acid Group-Functionalized Mesostructured Polymers[J].Advanced Functional Materials,2007,17(14):2455-2461. [8]Savvin S B.Analytical use of arsenazo III:determination of thorium,zirconium,uranium and rare earth elements[J].Talanta,1961,8(9):673-685. [9]Shah F,Soylak M,Kazi T G,et al.Development of an extractive spectrophotometric method for uranium using MWCNTs as solid phase and arsenazo(III)as chromophore[J].Journal of Radioanalytical and Nuclear Chemistry,2013,296(3):1239-1245. [10]Eitan A,Jiang K,Dukes D,et al.Surface modification of multiwalled carbon nanotubes:toward the tailoring of the interface in polymer composites[J].Chemistry of Materials,2003,15(16):3198-3201. [11]A.Mellah,S.Chegrouche,and M.Barkat.The removal of uranium(VI)from aqueous solutions onto activated carbon:Kinetic and thermodynamic investigations[J].Journal of Colloid and Interface Science,2006,296(2):434-441. [12]Y.S.Ho and G.McKay.Pseudo-second order model for sorption processes[J].Process Biochemistry,1999,34(5):451-465.