骨支架复合材料不饱和聚磷酸酯-β-磷酸钙的体外降解行为研究
袁 泉,徐娟娟,刘 璐,彭 周,夏 风,肖建中
(华中科技大学材料科学与工程学院 材料成型与模具技术国家重点实验室,湖北 武汉 430074)
骨支架复合材料不饱和聚磷酸酯-β-磷酸钙的体外降解行为研究
袁泉,徐娟娟,刘璐,彭周,夏风,肖建中
(华中科技大学材料科学与工程学院 材料成型与模具技术国家重点实验室,湖北 武汉 430074)
摘要:采用溶液聚合的方法制备了主链含不饱和双键的聚磷酸酯,并以β-磷酸钙(β-TCP)为无机填料通过交联反应得到骨支架复合材料不饱和聚磷酸酯-β-磷酸钙。研究了β-磷酸钙含量对复合材料体外降解行为的影响,采用X-射线衍射研究了降解前后复合材料中无机相的变化,采用扫描电子显微镜观察了复合材料降解过程中的表面形貌变化。结果表明:复合材料的降解速度先快后慢;β-磷酸钙的加入可有效减缓复合材料的降解速度;降解过程中材料表面有羟基磷灰石生成,说明此材料具有良好的生物相容性。
关键词:不饱和聚磷酸酯;β-磷酸钙;降解行为;生物相容性
聚磷酸酯在生物学方面的应用始于20世纪70年代[1],由于在结构上与生物高分子如核酸及磷壁酸等相似,聚磷酸酯中的磷酸酯键在生理条件下可发生水解反应或酶促分解反应[2-3],因而具有良好的生物相容性和可降解性[4-5],在药物控释[6-7]、基因载体[8-9]和组织工程[10]等领域得到了广泛的应用。卓仁禧等[11-13]制备得到了多种结构的聚磷酸酯,并研究了其在药物缓释方面的性能。Leong等制备了侧链含不同基团的聚磷酸酯,并研究了其在基因传递、组织工程中的应用[4,14]。
β-磷酸钙(β-TCP)具有良好的生物相容性和生物降解性,其钙磷质量比为1.5,与正常骨组织接近,其在体内降解产生的钙、磷能在一定程度上促进新生骨骼的生成[15-16],因而作为一种生物材料得到了广泛的关注。
虽然国内外对聚磷酸酯的研究较多,但主要集中在合成方法上,应用上则集中在药物控释和基因载体等方面,对其作为骨支架材料的体外降解行为研究鲜有报道。作者制备了主链含不饱和双键的聚磷酸酯,以β-磷酸钙为无机填料制备了可原位固化的聚磷酸酯-β-磷酸钙骨支架复合材料,研究了复合材料的体外降解行为。
1实验
1.1 试剂及原料
三乙胺、二氯甲烷、过氧化二苯甲酰(BPO)、N,N′-二甲基对甲基苯胺(DMT)、丙酮、无水乙醚,均为分析纯,国药集团化学试剂有限公司;二氯磷酸乙酯(EDP),纯度98%,北京百灵威科技有限公司;N-乙烯基吡咯烷酮(NVP),纯度99%,阿拉丁试剂(上海)有限公司。
β-磷酸钙(β-TCP)为自制粉末,粒径范围150~300 nm。富马酸二(1,2)-丙二醇酯(BPGF)参照文献[17]方法合成。
1.2 方法
1.2.1不饱和聚磷酸酯(UPPE)的合成
向干燥的三口烧瓶中加入9.29 g BPGF,在冰浴条件下向烧瓶中通入氩气以置换出瓶中空气,用注射器先后注入150 mL干燥二氯甲烷和8.90 g三乙胺。在机械搅拌下,通过分液漏斗向瓶中缓慢滴加溶于20 mL干燥二氯甲烷的EDP 6.52 g。滴加完毕后,升温回流反应18 h。将产物用旋转蒸发器减压浓缩至约20 mL,加入150 mL丙酮将其溶解后置于冰水浴中析出副产物三乙胺盐酸盐,过滤,如此反复多次。后将溶液再次浓缩至约20 mL,用丙酮-无水乙醚沉淀3次后真空干燥至恒质量,得到深黄色黏稠物即为目标产物UPPE,测定其分子量为3 050 g·mol-1。合成路线如图1所示。
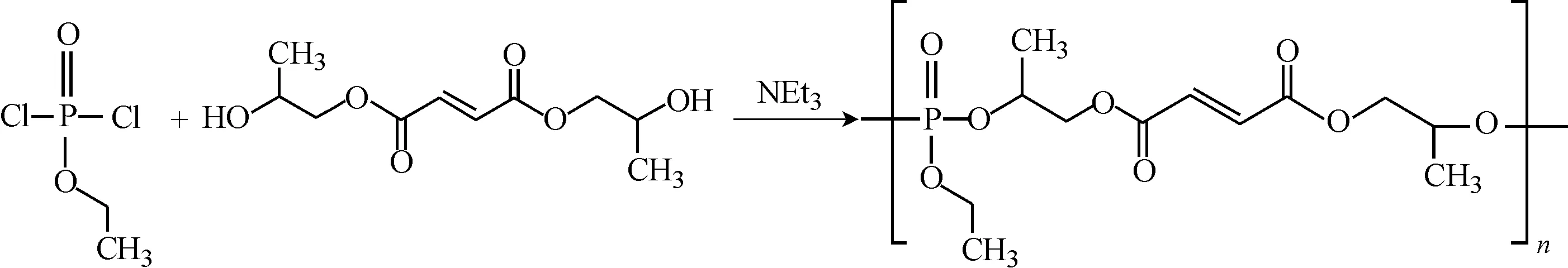
图1 不饱和聚磷酸酯的合成路线Fig.1 Synthetic route of unsaturated polyphosphoester
1.2.2复合材料不饱和聚磷酸酯-β-磷酸钙的交联
交联反应是通过氧化还原引发体系BPO/DMT引发,NVP作为交联剂来实现的。取1 g UPPE和DMT溶于2/3所需用量的NVP中,分别加入0 g、0.3 g和0.6 gβ-TCP,混合均匀,构成组分A;另取一定量的BPO溶于剩余1/3所需用量的NVP中,构成组分B;将两组分混合均匀后用注射器注入聚四氟乙烯(Φ6 mm×12 mm)模具中,置于37 ℃水浴锅中恒温固化24 h,得到交联产物。根据β-TCP加入量的不同(0 g、0.3 g、0.6 g),将3种配方分别标记为T0、T0.3和T0.6。
1.2.3复合材料的降解实验
根据交联反应的配方,每组取10个尺寸相同的平行试样,封入透析袋中,然后将其放入装有50 mL模拟体液(pH=7.4)的锥形瓶中,密封后在振荡器中37 ℃恒温振荡,振荡速度60 r·min-1,每隔3 d更换模拟体液。模拟体液的配制方法参照文献[18-19]。降解反应如图2所示。
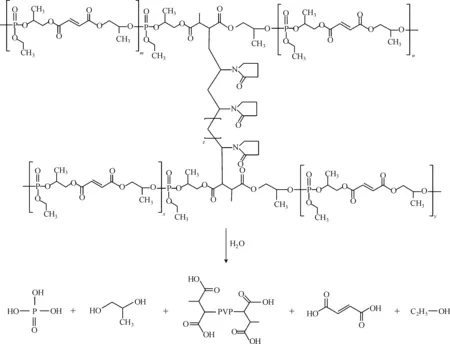
图2 交联不饱和聚磷酸酯的降解反应Fig.2 Degradation reaction of cross-linked unsaturated polyphosphoester
降解一段时间后将样品取出,经蒸馏水洗涤3遍后用滤纸吸干表面残留的水分,测量试样长度(Lt)和直径(Dt)。随后于37 ℃下真空干燥至恒质量,称量(Wd)。用扫描电子显微镜观察样品表面形貌。每次更换模拟体液前测量模拟体液的pH值(pHt)。
各计算公式如下:
质量保持率=(Wd/W0)×100%
(1)
长度增加率=[(Lt-L0)/L0]×100%
(2)
直径增加率=[(Dt-D0)/D0]×100%
(3)
pH变化值=7.4-pHt
(4)
式中:L0为试样降解前的初始长度;D0为试样降解前的初始直径;W0为试样降解前的初始质量。
模拟体液中NVP、PVP的紫外吸收在紫外分光光度计上测定。NVP、PVP的检测波长分别为234 nm、202 nm,标准曲线分别为:
y=0.02185x+0.1153
(5)
y=0.00718x-0.0347
(6)
式中:x为样品浓度,mg·L-1;y为吸光度。
1.2.4测试表征
复合材料红外光谱采用德国Bruker 公司VERTEX 70型红外光谱仪测定,溴化钾压片涂膜。紫外吸收采用美国Perkin Elmer公司Lambda 35型紫外分光光度计测定。分子量采用美国Agilent公司 Agilent 1100型高效液相色谱仪测定;聚苯乙烯为标样,四氢呋喃为溶剂(流速1 mL·min-1) 。X-射线衍射图谱采用荷兰帕纳科公司X′Pert PRO型X-射线衍射仪测定;微观形貌采用荷兰FEI公司Sirion 200型场发射扫描电子显微镜观察。
2结果与讨论
2.1 富马酸二(1,2)-丙二醇酯(BPGF)和不饱和聚磷酸酯(UPPE)的红外光谱(图3)

图3 BPGF和UPPE的红外光谱Fig.3 FTIR Spectra of BPGF and UPPE
由图3可知,与BPGF的红外光谱比较,UPPE的3 432.14 cm-1处羟基的伸缩振动吸收峰减弱,说明羟基参与了聚合反应。此外,1 260.11 cm-1处为P=O的伸缩振动吸收峰,1 119.06 cm-1和1 035.90 cm-1处分别为P-O-C中P-O和C-O的伸缩振动吸收峰,这些峰的出现表明了UPPE的产生。
2.2 β-TCP含量对复合材料降解行为的影响
2.2.1复合材料体外降解过程中NVP及PVP释放量的变化(图4)

图4 试样体外降解过程中NVP(a)和PVP(b)的释放量Fig.4 Released amount of NVP(a) and PVP(b) of samples during degradation in vitro
从图4可知,试样降解过程中NVP和PVP释放量随降解时间的变化趋势大致相同。3组样品均在降解开始的前2 d NVP和PVP释放最快,第6 d后释放量很小,并趋于平稳,且6 d后3组样品的NVP和PVP释放量相差很小。比较3组样品在降解开始前3 d的NVP和PVP释放量,可以看出,随着β-TCP含量的增加,NVP和PVP释放量逐渐减小。
复合材料在交联的过程中,有部分交联剂NVP没有参与反应,仍以单体形式存在;部分NVP没有与UPPE形成交联网络,而是形成了均聚物PVP。NVP和PVP有很强的亲水性,故在降解开始的前2 d快速溶出。与未加入β-TCP的试样比较,加入β-TCP的试样NVP和PVP的释放量较低,这是因为加入无机填料后,体系黏度增大,链自由基的运动受到限制,双基终止困难,有更多的NVP参加反应进入交联网络,体系中游离NVP的量减少,因此降解过程中NVP的释放量减少;此外,参加均聚反应形成PVP的NVP也减少,因而PVP的释放量也相对减少。
2.2.2复合材料体外降解过程中的质量变化(图5)
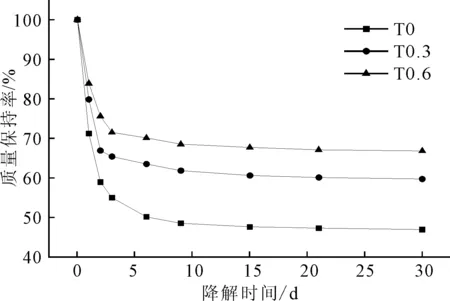
图5 试样体外降解过程中的质量变化Fig.5 Mass changes of samples during degradation in vitro
从图5可以看出,随着降解时间的延长,3组样品的质量均呈下降趋势,且降解前3 d质量变化最大;随着降解时间的延长,变化逐渐减缓。T0质量变化最大,降解30 d后质量仅为起始质量的46.9%,随着β-TCP含量的增加,质量保持率不断上升,T0.3和T0.6在降解30 d后的质量保持率分别为起始质量的59.7%和66.8%。
降解前3 d样品的质量损失主要是体系中NVP和PVP的溶出造成的,由于β-TCP加入量越多的样品NVP和PVP的溶出量越小,因此质量损失也越少。降解后期体系中的NVP和PVP基本释放完毕,此时的质量损失则是材料本身降解造成的。
2.2.3复合材料体外降解过程中长度和直径的变化(图6)

图6 试样体外降解过程中长度(a)和直径(b)的变化Fig.6 Length(a) and diameter(b) changes of samples during degradation in vitro
由图6可以看出,随着降解时间的延长,3组样品均呈现出长度增加的趋势,并且随着β-TCP含量的增加,长度增加率逐渐减小,30 d后3组样品的长度增加率分别为32.0%、23.3%和15.0%。3组样品的长度均在降解第1 d变化最快,而T0和T0.3两组样品在第2 d和第3 d长度缩短,之后又继续增长。样品直径在降解过程中的变化趋势与样品长度的变化趋势相似,但直径的增加率较长度更大,降解30 d后3组样品的直径增加率分别为41.8%、24.7%和16.2%。
降解开始的第1 d样品尺寸的急剧增加是由于体系内亲水性强的NVP和PVP的吸水造成的,β-TCP含量高的样品的伸长率较低,一方面是因为其体系内游离的NVP和PVP的含量较低,另一方面是因为无机相的加入对样品体积起到了一定的稳定作用;降解后期样品长度和直径的增加主要是由样品的溶胀造成的。T0和T0.3两组样品在降解开始第2 d和第3 d长度和直径出现了波动,这是由于降解第2 d时NVP和PVP已经大量溶出,体系的吸水性急剧下降,造成样品体积的收缩;T0.6的体积没有出现波动,也与无机相的稳定作用有关。
2.2.4复合材料体外降解过程中模拟体液pH值的变化(图7)
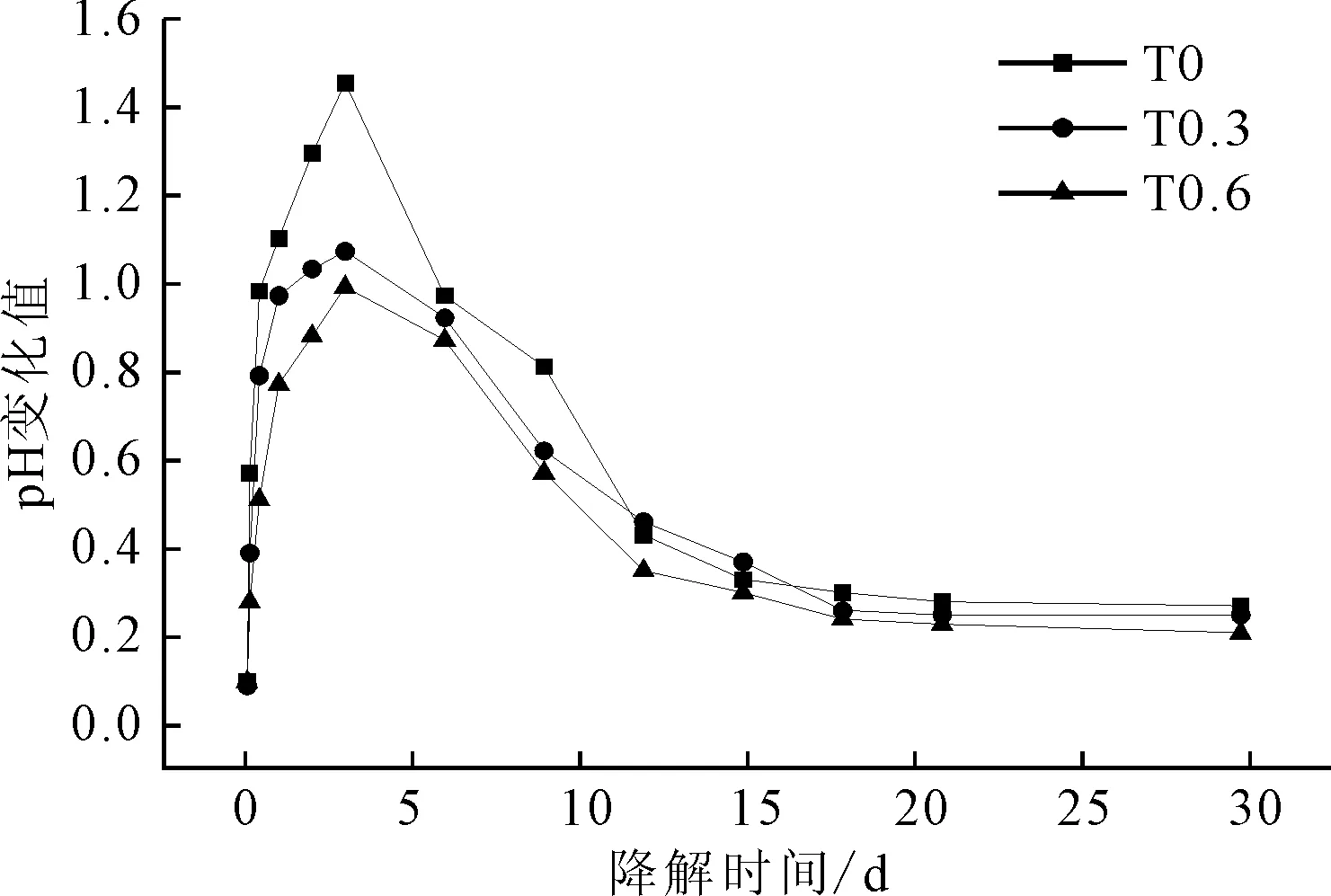
图7 试样体外降解过程中pH值的变化Fig.7 pH Value changes of samples during degradation in vitro
从图7可以看出,随着降解时间的延长,3组样品的pH变化值均不断减小。
从图2的反应式可以看出,模拟体液pH值的降低是由于交联产物降解后产生了具有酸性的小分子。由图7中pH值的变化趋势不难看出,交联产物降解速度在前3 d最快,随着降解时间的延长,降解速度逐渐减缓。比较3组样品可以发现,β-TCP含量高的样品其模拟体液pH值变化较小,即降解速度更慢,说明无机相的加入可以有效调节样品的降解速度。
2.3 复合材料体外降解过程中无机物的物相变化(图8)

图8试样体外降解过程中的物相变化
Fig.8Phase changes of samples during degradationinvitro
从图8可以看出,复合材料降解前为纯β-TCP的物相,从降解1 d到降解30 d,羟基磷灰石(HA)的峰强度越来越高,说明降解过程中有羟基磷灰石产生。
2.4 复合材料体外降解过程中试样微观形貌的变化(图9)

a1,a2,a3:0 d b1,b2,b3:1 d c1,c2,c3:30 d
由图9可以看出,降解前,样品表面比较光滑,球形的无机相β-TCP颗粒镶嵌在有机相UPPE中,颗粒间有轻微的团聚倾向。降解1 d后,样品表面出现了许多长度约100 nm的米粒状颗粒,这是羟基磷灰石的典型形貌,说明在样品表面新生成了羟基磷灰石。降解30 d后,基体形貌与之前差别不大,但米粒状颗粒消失,试样表面有许多球状颗粒物,尺寸与β-TCP颗粒相近,但分布比较均匀,没有团聚现象,且是附着在UPPE的表面,可能是前期米粒状羟基磷灰石长大的结果。
复合材料降解后1 d和30 d的XRD图谱和SEM照片均证明了材料表面生成了羟基磷灰石,说明这种复合材料具有良好的生物相容性。
3结论
采用溶液聚合的方法制备了主链含不饱和双键的聚磷酸酯,以β-磷酸钙为无机填料制备了可原位固化的聚磷酸酯-β-磷酸钙骨支架复合材料。红外光谱分析表明成功制备出了不饱和聚磷酸酯。复合材料的体外降解实验表明其降解速度先快后慢,且前2 d降解速度最快,后期趋于平稳;无机相的加入可有效减缓复合材料的降解速度。XRD图谱和SEM照片表明降解过程中材料表面有羟基磷灰石生成,说明复合材料具有良好的生物相容性。
参考文献:
[1]KALUZYNSKI K,LIBISZOWSKI J,PENCZEK S.A new class of synthetic polyelectrolytes.Acidic polyesters of phosphoric acid,(poly(hydroxyalkylene phosphates))[J].Macromolecules,1976,9(2):365-367.
[2]WU Q H,WANG C,ZHANG D,et al.Synthesis and micellization of a new amphiphilic star-shaped poly(D,L-lactide)/polyphosphoester block copolymer[J].Reactive and Functional Polymers,2012,72(6):372-377.
[3]邱进俊,刘承美,胡芬,等.可注射性骨组织工程支架材料不饱和聚磷酸酯的合成[J].高等学校化学学报,2005,22(10):1952-1956.
[4]LI Q,WANG J,SHAHANI S,et al.Biodegradable and photo-crosslinkable polyphosphoester hydrogel[J].Biomaterials,2006,27(7):1027-1034.
[5]SU Y,MO X M.Genipin crosslinked gelation nanofibers for tissue engineering[J].Journal of Controlled Release,2011,152(S1):230-232.
[6]毛海泉,卓仁禧,范昌烈,等.新型聚磷酸酯药物控释材料的合成[J].高等学校化学学报,1993,14(12):1743-1747.
[7] ZHANG G Y,ZHANG M Z,HE J L,et al.Synthesis and characterization of a new multifunctional polymeric prodrug paclitaxel-polyphosphoester-folic acid for targeted drug delivery[J].Polymer Chemistry,2013,4(16):4515.
[8]ZHANG S Y,WANG H,SHEN Y F,et al.A simple and efficient synthesis of an acid-labile polyphosphoramidate by organobase-catalyzed ring-opening polymerization and transformation to polyphosphoester ionomers by acid treatment[J].Macromolecules,2013,46(13):5141-5149.
[9]BIAN J,HAO Y,HE J L,et al.Synthesis and characterization of a biodegradable ABC triblock terpolymer as co-delivery carrier of doxorubicin and DNA[J].Journal of Polymer Science Part A:Polymer Chemistry,2014,52(21):3005-3016.
[10]ZHANG Z X,MAO J,FENG X L,et al.Invitrocytotoxicity of polyphosphoester as a novel injectable alveolar replacement material[J].Journal of Huazhong University of Science and Technology,2008,28(5):604-607.
[11]卓仁禧,崔竞舟,刘立建.主链含茜草双酯亚结构单元的聚磷酸酯的合成、降解及释药性能研究[J].合成化学,1997,5(4):385-389.
[12]傅杰,卓仁禧,范昌烈.含磷二羧酸与二对羧基苯氧基丙烷的共聚及其药物释放性能研究[J].武汉大学学报(自然科学版),1997,43(4):467-470.
[13]卓仁禧,王均,毛海泉.聚磷酸酯-聚氨酯药物释放材料的合成[J].高等学校化学学报,1997,18(7):1207-1211.
[14]WANG J,HUANG S W,ZHANG P C,et al.Effect of side-chain structures on gene transfer efficiency of biodegradable cationic polyphosphoesters[J].International Journal of Pharmaceutics,2003,265(1-2):75-84.
[15]张磊,孙水,任强,等.细胞复合β-磷酸三钙生物陶瓷修复软骨缺损的实验研究[J].中国矫形外科杂志,2008,16(9):698-701.
[16]王思群.β-TCP多孔生物陶瓷软骨组织工程支架的研发及应用研究[D].上海:复旦大学,2009.
[17]JAMES C W,CREVE C,ERHARD J P,et al.Purification of hydroxyalkyl fumarate esters:US,3360546[P].1967-12-26.
[18]KOKUBO T,TAKADAMA H.How useful is SBF in predictinginvivobone bioactivity?[J].Biomaterials,2006,27(15):2907-2915.
[19]GOPI D,BHALAJI P R,RAMYA S,et al.Evaluation of biodegradability of surface treated AZ91 magnesium alloy in SBF solution[J/OL].Journal of Industrial and Engineering Chemistry,2014,http://www.sciencedirect.com/science/article/pii/S1226086X 14004109.
InVitroDegradation Behavior of A Bone Scaffold Composite Based on Unsaturated Polyphosphoester and Beta-Calcium Phosphate
YUAN Quan,XU Juan-juan,LIU Lu,PENG Zhou,XIA Feng,XIAO Jian-zhong
(StateKeyLaboratoryofMaterialProcessingandMouldTechnology,
CollegeofMaterialsScienceandEngineering,
HuazhongUniversityofScienceandTechnology,Wuhan430074,China)
Abstract:A kind of polyphosphoester with unsaturated double bonds in backbone was prepared by solution polymerization method and the composite material was prepared by cross-linking reaction with beta-calcium phosphate(β-TCP) as inorganic filler.The effect of the content of β-TCP on degradation behavior of the composite material in vitro was studied.The phase transformation of the inorganics in the composite was studied by XRD.The surface morphology change of the composite was observed by SEM.The results showed that the degradation rate of the composite was fast at first and slow at last.The addition of β-TCP could slower the degradation rate of the composite material effectively.The appearance of hydroxyapatite on the surface of the composite in the process of degradation demonstrated that this kind of material had good biocompatibility.
Keywords:unsaturated polyphosphoester;beta-calcium phosphate;degradation behavior;biocompatibility
中图分类号:O 631
文献标识码:A
文章编号:1672-5425(2015)05-0014-06
doi:10.3969/j.issn.1672-5425.2015.05.004
作者简介:袁泉(1990-),女,安徽六安人,硕士研究生,研究方向:生物高分子材料及陶瓷材料,E-mail:yuanquan@hust.edu.cn;通讯作者:肖建中,教授,E-mail:jzxiao@126.com。
收稿日期:2015-02-26
基金项目:国家863计划资助项目(2006AA032443)

