珍稀濒危植物异形玉叶金花组织培养初步研究
张文泉,王定江
(1.凯里学院,贵州 凯里 556011;2. 贵州省黔东南州林业科学研究所,贵州 凯里 556000)
珍稀濒危植物异形玉叶金花组织培养初步研究
张文泉1,王定江2
(1.凯里学院,贵州 凯里 556011;2. 贵州省黔东南州林业科学研究所,贵州 凯里 556000)
以异形玉叶金花幼嫩茎段为外植体,研究不同组合的激素组合及外源物对异形玉叶金花愈伤组织诱导及分化的影响。结果表明:诱导愈伤组织的最佳培养基组合为MS +6-BA 0.2 mg/L +2,4-D 1.5 mg/L;愈伤组织分化的最佳培养基组合为MS +6-BA 2.0 mg/L +NAA 0.5 mg/L+5 g/L椰乳,诱导生根的最佳培养基组合为1/4 MS+0.5 mg/L NAA+0.2 mg/L IBA。
异形玉叶金花;组织培养;愈伤组织
异形玉叶金花Mussaenda anomalaLi为茜草科Rubiaceae玉叶金花属珍稀种[1-2],最早于1936年在广西大瑶山发现,国务院1999年8月4日批准的1级重点保护野生植物,何克军对广东省国家一级重点保护植物资源状况分析中异形玉叶金
花野生种群没有发现,2004年到2006年,邓小芳、张奠湘等人多次到广西大瑶山进行考察,均未发现异性玉叶金花,人们在贵州黔南经多次调査及样地资料分析后确认,异形玉叶金花在贵州分布区的植株总数不超过60株。许多原有的分布地点已找不到野生植株,也没有发现新的分布地点,它的种子自然更新能力较差,且易受虫害,因此极为稀少,目前全国总数不超过一百株,为一个非常珍稀的濒危物种[3-4]。
通过组培途径途径实现植株再生不仅可以解决无性繁殖的问题,而且可以作为濒危植物种质资源保存的理想实验体系,对异形玉叶金花进行组织培养研究,可建立异形玉叶金花植株再生较高频率的实验体系,是异形玉叶金花资源保护的最佳手段,同时也为异形玉叶金花的回归种植,种质资源迁地保护等提供材料,并为其抗病、抗虫和抗逆性等基因的转化奠定了基础,开拓了品种改良的新途径。
1 材料与方法
1.1 材 料
五月上旬采集于黔东南州林业科学研究所扦插的异形玉叶金花当年生幼嫩茎段为材料。
1.2 试验方法
1.2.1 消毒方法
将异形玉叶金花当年生幼嫩茎段用试管刷蘸少许洗洁精在流水中冲洗干净,再流水冲洗12 h,截成4 cm左右,无菌滤纸吸干后,70% 酒精表面消毒 30 s,无菌水冲洗3~5 次,再用 0.1%的HgC12消毒10 min,无菌水冲洗3~5次,备用。
1.2.2 愈伤组织诱导
在无菌条件下将幼嫩的茎段切成2~3 mm,分别接种于以MS为基本培养基,附加不同浓度的 2,4-D(0, 0.5,1.0,1.5,2.0 mg/L),6-BA(0,0.3,0.5,1.0 mg/L)的培养基上,(培养基中蔗糖3%,琼脂0.6%,pH 值5.8~6.2,后续试验同上),每处理接种 32个外植体,暗培养,温度25±1℃,观察不同激素组合对愈伤组织形成的影响,20 d 后统计愈伤组织诱导率。
1.2.3 愈伤组织诱导分化
将愈伤组织接种于以MS为基本培养基,附加5 g/L椰乳(以不附加椰乳的为空白对照),添加不同浓度的 6-BA(1.0,1.5,2.0,2.5 mg/L),NAA(0.3,0.5,1.0 mg/L)的培养基上诱导不定芽,接种完毕后放入温度为(25±1)℃,光强为1 500 lx,光照时间为16 h/d的条件下培养,25 d后统计愈伤组织的分化率。
1.2.4 不定根的诱导
当芽伸长生长至1 cm左右时,截下,接种于生根培养基上,对根系进行诱导。生根培养基以1/2MS为基本培养基,附加IBA(0.3,0.5,1.0 mg/L),诱导根系30 d以后,观察诱导情况,统计不定根诱导率。
不定根诱导率=(产生不定根的芽数/接种芽总数)×100 %
1.3 数据处理
数据分析采用SPSS(Statistical Program for Social Sciences)及 Excel统计软件进行分析,统计结果采用如下公式计算。

式(1)中:A为愈伤组织诱导率;B为诱导出愈伤组织外植体数;C为接种的外植体总数。

式(2)中:D为不定芽诱导率;E为产生不定芽的愈伤组织数;F为接种愈伤组织总数。

式(3)中:G为平均不定芽数;H为不定芽总数;F为接种愈伤组织总数。

式(4)中:I为不定根诱导率;J为产生不定根的芽数;K为接种芽总数。
2 结果与分析
2.1 不同浓度植物激素对异形玉叶金花愈伤组织诱导的影响
以异形玉叶金花当年生幼嫩茎段为外植体,接种于不同激素浓度组合的培养基上,培养6 d时,茎段切口处膨大,8 d后愈伤组织产生,但不同激素组合诱导得到的愈伤组织形态各异,I种为乳白色,光滑致密、形如小米粒状(见图1),直径约为5~7 mm;II种为淡黄色、疏松、形如水渍(见图2),直径约为2~3 mm;20 d 后统计愈伤组织诱导率得表1,由表1分析可知,愈伤组织诱导过程中,低浓度的激素促进愈伤组织的诱导,而高浓度的激素却抑制愈伤组织的诱导,单一添加一种激素时,2,4-D的作用效果大于6-BA,两种激素组合时,明显表现出激素组合的优势,不同浓度激素组合对愈伤组织的诱导率存在较大影响,当2,4-D为1.5 mg/L;6-BA为0.2 mg/L时愈伤诱导率最高,为 91.6 %,所获得为乳白色,光滑致密、形如小米粒状的愈伤组织,此类愈伤组织不易褐化。综上所述:异形玉叶金花愈伤组织诱导的最佳培养基为 MS+6-BA0.2 mg/L+2,4-D1.5 mg/L。

图1 I型愈伤组织Fig.1 Callus of I –typs

图2 II型愈伤组织Fig.2 Callus of II –typs
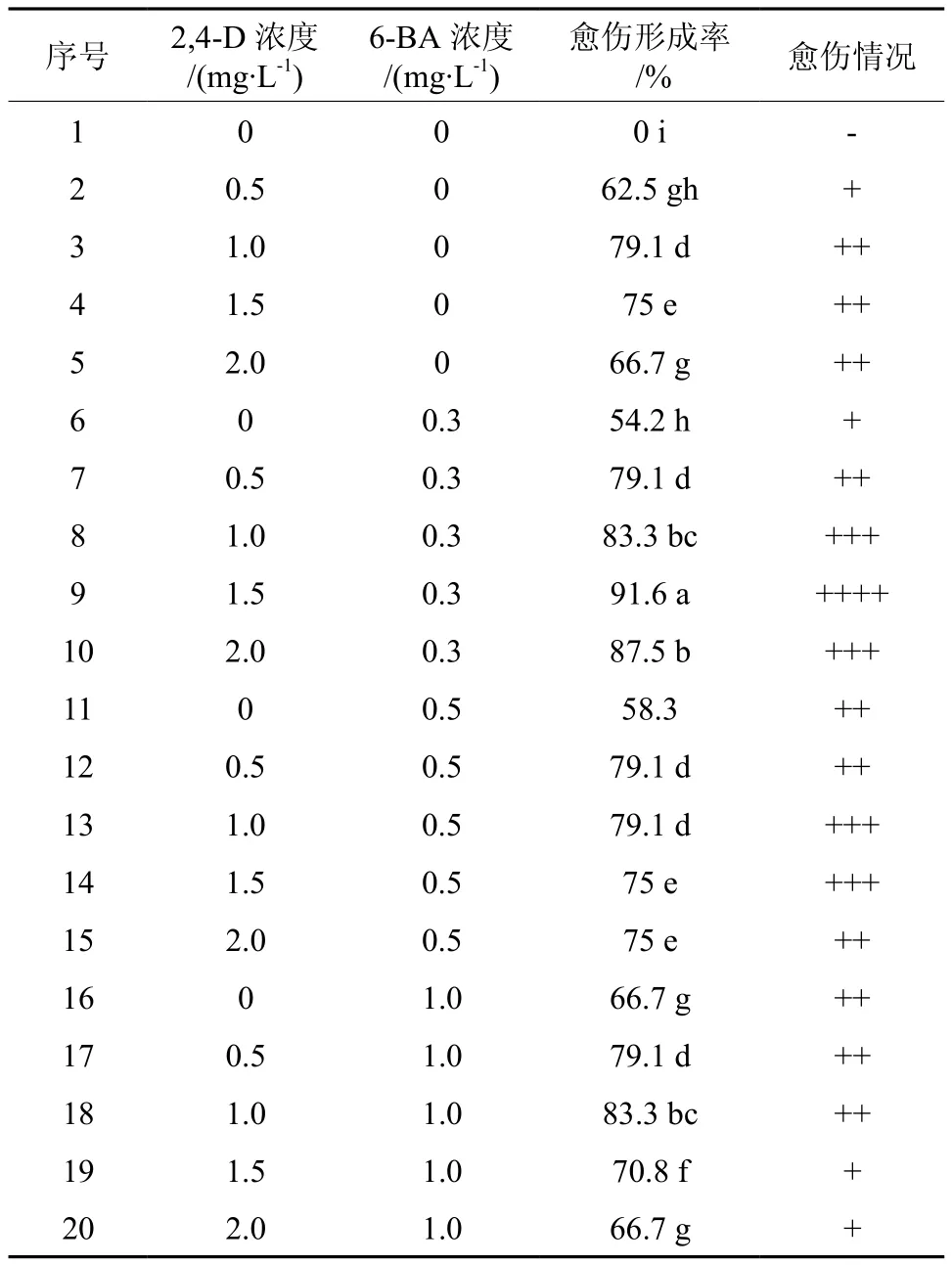
表1 不同激素浓度的 MS 培养基上的愈伤形成率†Table 1 The effects of different hormone and different concentration in MS medium on inductivity of callus
2.2 不同浓度的激素组合对愈伤组织的分化的影响
将诱导得到的乳白色,光滑致密、形如小米粒状的愈伤组织接种于分化培养基上培养,光照培养,不添加椰乳的空白对照,愈伤组织不分化,只生长膨大,逐渐褐化,死亡(见图3),添加椰乳的培养基上接种的愈伤组织10 d后,少部分愈伤组织出现分化迹象,有绿色的芽点形成,继续培养20 d时,形成不定芽(见图4),每块愈伤组织分化得到的不定芽数量较少,一般只有1个不定芽,少数有2个不定芽.由此可知,椰乳在愈伤组织的分化中起到了决定性的作用。但不同的激素组合也影响愈伤组织的分化,统计愈伤组织分化率得表2,由表2分析可知:不同浓度的激素组合对愈伤组织的分化影响存在较大差异,与愈伤诱导相似,低浓度的激素促进愈伤组织的分化,高浓度的激素却抑制愈伤组织的分化,如NAA浓度一致时,6-BA浓度为2.0 mg/L时,愈伤组织分化率高于6-BA浓度为1.5 mg/L与 2.5 mg/L,当6-BA浓度为2.0 mg/L时NAA浓度为0.5 mg/L,时愈伤组织分化率达到最高值为50%,平均不定芽数为2。综上所述:异形玉叶金花愈伤组织分化的最佳最佳培养基为 MS +6-BA 2.0 mg/L +NAA 0.5 mg/L+ 5 g/L椰乳。

图3 未分化的愈伤组织Fig.3 Undifferentiated callus

图4 愈伤组织分化不定芽Fig.4 Adventitious buds differentiated from callus
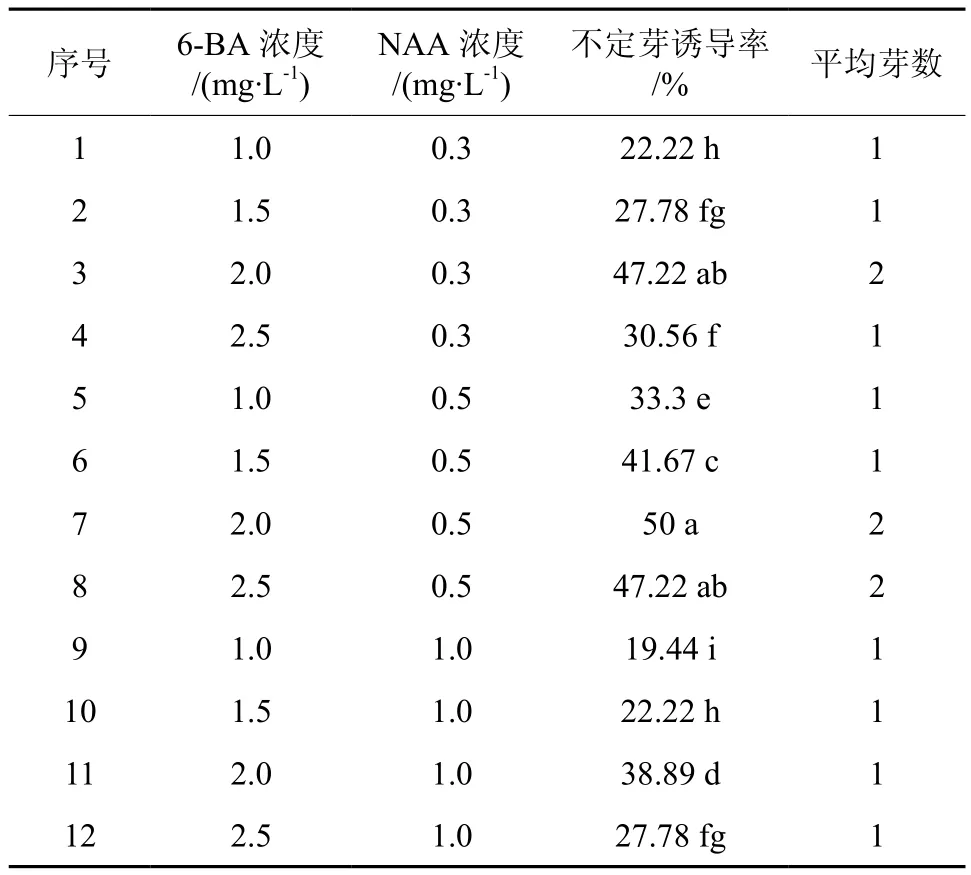
表2 不同浓度的激素组合对愈伤组织的分化的影响Table 2 The effects of different hormone and different concentration on callus differentiation
2.3 不同浓度的激素对根系诱导的影响
当不定芽生长达到1 cm以上,切取不定芽接种于生根培养基上,诱导根系。6 d时,幼苗茎基部形成愈伤组织,10 d时,愈伤组织上长出不定根,30 d后统计不同的激素浓度诱导根系得表3。由表3可知: IBA为0.5 mg/L,生根效果最佳,生根率达80 %,根长可达4.5 cm左右,与愈伤组织诱导过程相似,低浓度的激素促进根系的诱导,高浓度的激素抑制根系诱导,试验结果表明:1/2MS+0.5 mg/L IBA为异形玉叶金花根系诱导的最佳培养基组合。

表3 不同IBA浓度对不定根诱导的影响Table 3 Adventitious root inductions in different IBA
3 结论与讨论
异形玉叶金花为国家一级重点保护濒危植物,是重要的种质资源,通过组培途径建立完整的植株再生体系,能较好的保护异形玉叶金花种质资源。由外植体形成愈伤组织再分化形成完整植株,茜草科的其他植物已见报道[5-6],但异形玉叶金花通过此途径获得完整植株的研究,国内外尚未见报道。
以茎段、叶片为外植体通过组培途径扩繁是对珍稀濒危植物抢救保护的重要措施, 我国特有的珍稀植物膝柄木Bhesa sinica、金花茶Camellia nitidissimaChi.、及我国特有单种属植物青钱柳Cyclocaryapaliurus(Bata1.) Iljinskaja 的叶片组培均获得愈伤组织[7-9]。
由本文的实验结果可知:异形玉叶金花也能通过组培快繁方式实现种群繁殖与保护。植物生长调节剂种类、浓度及组合是影响愈伤组织诱导及分化的重要因素。在植物组织培养过程中,最常用生长素类是2,4-D,细胞分裂素类为6-BA,这两种激素常用于叶片、茎段、子叶、胚等不同类型外植体愈伤组织的诱导,2,4-D、 6-BA 的主要作用是促进愈伤组织诱导及生长,但浓度过高则会抑制愈伤组织的生长,易导致玻璃化。如莫竹承等[7]将2,4-D+ 6-BA 激素组合用于珍稀濒危植物膝柄木Bhesa sinica叶片组织培养, 结果表明在MS 培养基中,6-BA 以0.5 mg/L、2,4-D 以1.0 mg/L 最佳,愈伤组织诱导率高达70% 以上;在“普瑞头”百合Liliusp. 的组织培养和快速繁殖,MS+6-BA0.5 mg/L+2,4-D 2.5mg/L 是最适培养基[10]。在油茶 12 个物种花药愈伤组织诱导过程中,2,4-D与6-BA组合愈伤组织的 的诱导率达100%[11]。紫花苜蓿组织培养体系的建立过程中,以叶片为外植体,在MS 培养基中添加2,4-D 1.0 mg/L +6-BA0.1 mg/L诱导愈伤组织最有效[12-13];这些结果与本文中的最佳植物生长调节剂比例培养基MS+2,4-D 1.5 mg/L +6-BA 0.2 mg/L 一致。一般是2,4-D与6-BA组合,充分表现出激素组合的优势,大量实验研究结果表明:浓度比为(2∶1)~(10∶1)之间则能诱导得到愈伤组织[14-17]。
愈伤组织能否分化是构建植株完整再生体系最关键的一步,李俊强等对早开堇菜的植株再生体系的建立过程中,加入香蕉汁使得愈伤组织的分化率大幅度提高[18]。
史昆等对马尾松胚性细胞悬浮增殖培养体系的建立中,添加水解蛋白,促进了胚性细胞的形成及体细胞胚的分化[19]。愈伤组织分化是构建异形玉叶金花完整的植株再生体系最关键的一步,分化率低严重的制约着许多植物的离体快速繁殖,在本试验研究过程中,不添加椰乳的情况下,异形玉叶金花的愈伤组织分化率为0%,添加椰乳的培养基分化率最高可达到50%,诸多研究报道:在培养基中加入外源物质如:椰乳,香蕉汁,水解蛋白等等,能促进愈伤组织的分化[20-23],与本试验的结果一致,在异形玉叶金花的愈伤组织分化过程中加入椰乳外的其它外源物质能否提高异形玉叶金花愈伤组织的分化率,还有待于进一步研究和试验。
本文的研究结论是异形玉叶金花诱导愈伤最佳培养基为MS+6-BA0.2 mg/L+2,4-D1.5 mg/L,愈伤组织分化的最佳最佳培养基为MS+6-BA2.0 mg/L+NAA0.5 mg/L+5 mg/L椰乳。
[1]包 骏. 贵州民族医药研究与开发[M]. 贵阳: 贵州科技出版社, 199.
[2]汪 毅. 草药彩色图集[M]. 贵阳: 贵州科技出版社, 2006.
[3]冯志舟. 异形玉叶金花[J]. 百科知识, 2011(11): 41.
[4]邓维先, 简永远, 杨再波. 异形玉叶金花果实不同提取部位抗氧化活性研究[J]. 广东化工, 2012, 39(16): 23-24.
[5]彭光天, 黄上志, 李华光. 玉叶金花的组织培养和植株再生[J].植物生理学通讯, 2001, 37(3): 230-231.
[6]张红岩, 莫勇生, 周 兴. 红芽大戟组织培养研究进展[J]. 安徽农业科学, 2014, 42(29): 10136-10138.
[7]莫竹承, 庞万伟, 刘 珏, 等. 膝柄木叶片诱导愈伤组织研究[J]. 中南林业科技大学学报, 2015, 35(10): 13-17.
[8]高宇琼, 赖钟雄. 金花茶体胚和叶片愈伤组织培养[J]. 亚热带农业究, 2010, 6(2): 130-135.
[9]上官新晨, 郭春兰, 蒋 艳, 等. 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究[J]. 江西农业大学学报,2006, 28(5): 678-682.
[10]张彦妮, 李文英. 百合属‘普瑞头’的组织培养和快速繁殖[J]. 草业科学, 2012, 29(7): 1077-1083.
[11]丁植磊, 张日清, 刘友全, 等. 油茶 12 个物种花药愈伤组织诱导及继代培养[J]. 经济林研究, 2007, 25(1): 20-24.
[12]周晓馥, 吕 杰, 苗 璐, 等. 紫花苜蓿组织培养体系的建立及其遗传转化[J]. 生物技术通报, 2013(4): 63-68.
[13]徐 博, 任 伟, 王英哲, 等. 紫花苜蓿子叶的高频离体再生体系的建立与优化[J]. 湖北农业科学, 2015, 54(20): 159-161.
[14]金亚征, 俞凤芳, 车瑞香, 等. 药用百合组织培养快繁技术研究[J]. 经济林研究, 2013, 31(1): 124-128.
[15]Dalila Z D, Jaafar H, Manaf A A. Effects of 2,4-D and kinetin on callus induction of Barringtonia racemosa leaf and endosperm explant in different types of basal media[J]. Asian Journal of Plant Sciences, 2013, 12(1): 21-27.
[16]Chaâbani G, Tabart J, Kevers C, et al. Effects of 2,4-dichlorophenoxyacetic acid combined to 6-Benzylaminopurine on callus induction, total phenolic and ascorbic acid production,and antioxidant activities in leaf tissue cultures ofCrataegus azarolusL. var. aronia[J]. Acta Physiologiae Plantarum, 2015,37(2): 16.
[17]Kumar S, Mangal M, Dhawan A K,et al.Callus induction and plant regeneration from leaf explants of jojoba[J]. India Journal of Biotechnology, 2013, 12: 544-547
[18]李俊强, 林利华, 张 帆, 等. 早开堇菜组织培养及植株再生体系的建立[J]. 草业学报, 2015, 24(11): 163-167.
[19]史 昆, 杨模华, 李志辉, 等. 马尾松胚性细胞悬浮增殖培养体系的建立[J]. 中南林业科技大学学报, 2014, 34(1): 64-68.
[20]王雪芳, 王春梅, 张金林, 等. 小花碱茅组织培养植株再生体系的建立[J]. 草业学报, 2014, 23(6): 355-360.
[21]徐 茜, 乐正碧, 徐 燕, 等. 甘薯叶片和叶柄组织诱导培养及植株再生研究[J]. 中国农学通报, 2011, 27(15): 102-105.
[22]胡 盈, 赵晓妮, 孙凤阳, 等. 刺五加体细胞胚发生过程中几丁质酶和葡聚糖酶活性变化[J]. 经济林研究,2014,32(1):81-86.
[23]唐佳佳, 尚旭岚, 洑香香. 黑荆树愈伤组织诱导、增殖与分化[J]. 中南林业科技大学学报, 2014, 34(9): 39-43.
A preliminary study on tissue culture of the rare and endangered plantMussaenda anomala
ZHANG WEN-quan1, WANG Ding-jiang2
(1. Kaili University, Kaili 556011, Guizhou, China; 2. Guizhou Southeast District Forestry Institute, Kaili 556000, Guizhou, China)
The effect of hormone on the callus induction and differentiation of tender stem segments ofMussaenda anomalawas studied.And an ef ficiency regeneration System of the plant was established. The results showed: the optimum medium for callus induction from leaves was MS+ 1.5 mg/L 2,4-D+0.2 mg/L6-BA. The optimum medium for callus differentiation was MS+0.5 mg/LNAA+0.5 mg/L6-BA+5 g/L cocon-utmilk. The adventitious root was induced on 1/2MS+0.5 mg/L IBA.
Mussaenda anomala; tissue culture; callus
S722.3+7
A
1673-923X(2016)10-0012-04
10.14067/j.cnki.1673-923x.2016.10.003
2015-12-29
贵州省教育厅优秀科技创新人才项目(黔教合KY字[2014]251号);贵州省科技厅联合基金项目(黔科合LH字[2014]7241号);贵州省重点学科建设项目(黔学位合字ZDXK[2015]23号);凯里学院博士专项基金(BS201339);黔东南自然科学项目(黔东南科合J字[2014]4001)
张文泉,副教授,博士;E-mail:zwq840209@yeah.net
张文泉,王定江. 珍稀濒危植物异形玉叶金花组织培养初步研究[J].中南林业科技大学学报,2016, 36(10): 12-15, 47.
[本文编校:吴 彬]

