激活素A高表达对ActA/Smads通路基础活化水平的影响
激活素A高表达对ActA/Smads通路基础活化水平的影响
王姣琦徐仲航1王一鸣1何金婷邵延坤纪秋野2刘永峰3莽靖徐忠信
(吉林大学中日联谊医院神经内科,吉林长春130033)
摘要〔〕目的探讨激活素(Act)A细胞内高表达对ActA/Smads通路基础活化水平的影响。方法以ActβA重组载体(ActA-pIRES2-EGFP)和空载体(pIRES2-EGFP)稳定转染的PC12细胞为阳性和阴性转染组,正常PC12细胞为对照,利用实时荧光定量聚合酶链反应(RT-PCR)、Western印迹法检测3组细胞内ActA、Smad3和磷酸化Smad3在转录及蛋白水平的表达,激光共聚焦观察Smad4的质核分布情况。结果与阴性转染组相比,阳性转染组ActA mRNA及蛋白表达分别提高4.5和1倍,Smad3总蛋白及磷酸化蛋白表达分别提高了36.4%和86.9%,Smad4蛋白在阳性转染组细胞核内分布增加。结论ActA内源性高表达可提高PC12细胞内ActA/Smads通路的基础活化水平。
关键词〔〕ActA;ActA/Smads;Smad3;Smad4
中图分类号〔〕R331.36;R743〔文献标识码〕A〔
基金项目:国家自然科学基金面上资助项目(81371298);吉林省科发展计划国际合作项目(20120723);吉林省产业技术研究与开发项目(2013C030-4);吉林大学大学生国家级创新基金项目(2014A79339)
通讯作者:莽靖(1978-),男,副教授,硕士生导师,主要从事脑缺血研究。
1吉林大学白求恩医学部临床医学院
2吉林大学中日联谊医院科学研究中心
3美国奥尔巴尼医学院心血管研究中心
徐忠信(1965-),男,教授,博士生导师,主要从事脑缺血损伤与保护研究。
第一作者:王姣琦(1987-),女,在读博士,主要从事脑缺血研究。
Effect of increased Activin A expression to the basic activation of ActA/Smads signaling
WANG Jiao-Qi,XU Zhong-Hang,WANG Yi-Ming,etal.
Department of Neurology,China-Japan Union Hospital of Jilin University,Changchun 130033,Jilin,China
Abstract【】ObjectiveTo explore the effect of increased intracellular Activin (Act)A expression on the basic activation of ActA/Smads signaling in PC12 cells.MethodsRecombinant ActβA vector (ActA-pIRES2-EGFP) and black vector (pIRES2-EGFP) stably transfected rattus PC12 pheochromocytoma cells were used as positive and negative groups,with normal PC12 cells as control.The expressions of ActA,Smad3 and phosphorylated Smad3 were detected by real time RT-PCR and Western blot.And the distribution of Smad4 in cells was observed under the confocal laser scanning microscope at 554 nm.ResultsThe expression of ActA mRNA in positive group was dramatically increased by 4.5 times compared to that in negative group,while its protein was doubled,suggesting the increased ActA expression due to recombinant vector transfection.Then the expressions of Smad3 total protein and phosphorylated protein in positive group were respectively increased by 36.4% and 86.9% compared to negative group.Moreover the intranuclear mobility of Smad4 was also ascended in positive group.ConclusionsIncreased intracellular expression of ActA could promote the basic activation of ActA/Smads signaling in PC12 cells.
【Key words】ActA;ActA/Smads;Smad3;Smad4
研究发现,转化生长因子(TGF)-β超家族的成员之一的激活素(Act)A在中枢神经系统表达〔1,2〕。缺血性脑卒中发生后,损伤区神经细胞内ActA表达增加,ActA/Smads信号转导通路激活〔3,4〕,其ActA/Smads信号转导通路活化在缺血性脑卒中的神经保护功能已得到证实〔5~7〕。但ActA内源性高表达对ActA/Smads通路基础活性的影响尚不清楚。本研究利用ActA重组真核表达载体稳定转染的PC12细胞,通过检测ActA、Smad3及磷酸化Smad3表达和Smad4质核分布情况,为寻找提高ActA/Smads通路神经保护功能的有效方法提供依据。
1材料与方法
1.1主要材料大鼠嗜铬细胞瘤PC12细胞,稳定转染大鼠ActβA重组真核表达载体的PC12细胞均由本课题组提供。G418购自美国Gibco公司,Trizol 总RNA提取试剂盒购自生工生物工程技术服务有限公司。小鼠抗大鼠ActA抗体,兔抗大鼠Smad4抗体购自美国Abcam公司,Quantscript cDNA第一链合成试剂盒、Real Master Mix(SYBR Green)试剂盒购自天根生化科技有限公司。小鼠抗大鼠β-actin抗体购自美国Santa公司,兔抗大鼠Smad3及磷酸化Smad3抗体购自美图ThermoFisher公司,辣根过氧化物酶标记的羊抗兔,羊抗鼠二抗购自北京博士德生物技术有限公司,Cy3标记的羊抗兔二抗购自武汉博士德生物技术有限公司。ActA、Smad3及内参GAPDH基因引物委托上海生工合成。
1.2细胞培养及分组PC12细胞常规培养在含10%马血清,10%胎牛血清的高糖DMEM培养液中。稳定转染大鼠ActβA重组载体(ActA-pIRES2-EGFP)及空载体(pIRES2-EGFP)的PC12细胞为阳性组和阴性转染组,正常PC12细胞为对照。
1.3实时荧光定量聚合酶链反应(RT-PCR)检测ActA、Smad3基因mRNA的表达收集细胞,提取总RNA,并按照逆转录试剂盒说明书步骤进行反转录操作,制备cDNA。参照Real Master Mix(SYBR Green)说明书检测,ActA及内参基因引物为,ActA上游引物:5′-GGCAAGGTCAACATCTGCTGTA-3′,下游引物:5′-ACTCCTCCACGATCATGTTCTG-3′,片段大小246 bp;GAPDH上游引物:5′-GGTTACCAGGGCTGCCTTCT-3′,下游引物:5′-ATGGGTTTCCCGTTGATGAC-3′,片段大小171 bp。结果应用Relative Quantification (ddCt) Study进行相对表达量(RQ)分析,计算各基因在各组细胞之间的相对表达水平〔8〕。实验重复3次。
1.4Western印迹检测蛋白表达RIPA裂解液提取阳性转染组、阴性转染组及对照组细胞总蛋白,二喹啉甲酸法(BCA)测定蛋白浓度。各组蛋白经金属浴加热煮沸后上样,SDS-PAGE电泳后转膜、封闭,随即一抗孵育过夜。使用的一抗分别为小鼠抗大鼠ActA(1∶500),兔抗大鼠Smad3(1∶500),磷酸化Smad3(p-Smad3)(1∶500)和小鼠抗大鼠β-actin(1∶1 000)。次日洗膜后使用辣根过氧化物酶耦联的羊抗鼠或羊抗兔二抗(1∶1 000)室温孵育,继而增强型化学发光法(ECL)显影压胶片。利用凝胶图像分析系统扫描胶片,ImageJ灰度分析,以目的条带与其对应内参条带的灰度比值来表示目的蛋白的相对表达水平。
1.5激光共聚焦观察Smad4质核分布情况将3组细胞以2.5×104/孔~5×104/孔接种于预先放有细胞爬片的24孔板内,次日细胞贴壁后取出爬片,经0.3% Triton X-100通透,牛血清白蛋白(BSA)封闭后加入Smad4一抗(1∶500)4℃湿盒中孵育过夜。而后于避光条件下加入Cy3标记的羊抗兔IgG抗体37℃作用60 min,继而再用4,6-联脒-2-苯基吲哚(DAPI)(1 μg/ml)37℃避光孵育15 min,防淬灭封片剂封片后,共聚焦显微镜在554 nm观察Smad4在各组细胞内的质核分布情况。
1.6统计学处理应用SPSS10.0统计软件包进行独立样本t检验、多个样本单因素方差分析及组间Studentst检验。
2结果
2.1各组Smad3表达比较ActA细胞内高表达可上调Smad3表达(图1)。其灰度分析示,与阴性转染组(4.20±0.31)相比,阳性转染组Smad3总蛋白表达(5.73±0.27)升高了36.4%,差异显著(P<0.05)。此外,Smad3磷酸化蛋白表达在阳性转染组(4.13±0.16)也较阴性转染组(2.21±0.15)提高了86.9%,差异显著(P<0.05)。

图1 ActA、Smad3及磷酸化Smad3 蛋白表达检测
2.2各组ActA表达比较与阴性转染组(2.07±0.82)相比,阳性转染组ActA mRNA表达(11.43±1.88)提高了4.5倍(P<0.05)。见图1。其灰度分析示,阳性转染组(10.42±1.9)较阴性转染组(5.02±1.4)提高了1倍(P<0.05)。而ActA mRNA及蛋白在阴性转染组(2.07±0.82;5.02±1.4)及对照组(1.98±1.09;4.76±1.6)的表达水平无显著差异(P>0.05)。说明ActA重组真核载体稳定转染可显著提高PC12细胞内ActA表达。
2.3Smad4质核分布比较Cy3标记的Smad4在激光共聚焦显微镜554 nm的激发光下呈红色荧光,细胞核经DAPI染色后呈蓝色。阳性转染组Smad4在细胞核内分布明显高于阴性转染组及对照组(图2)。
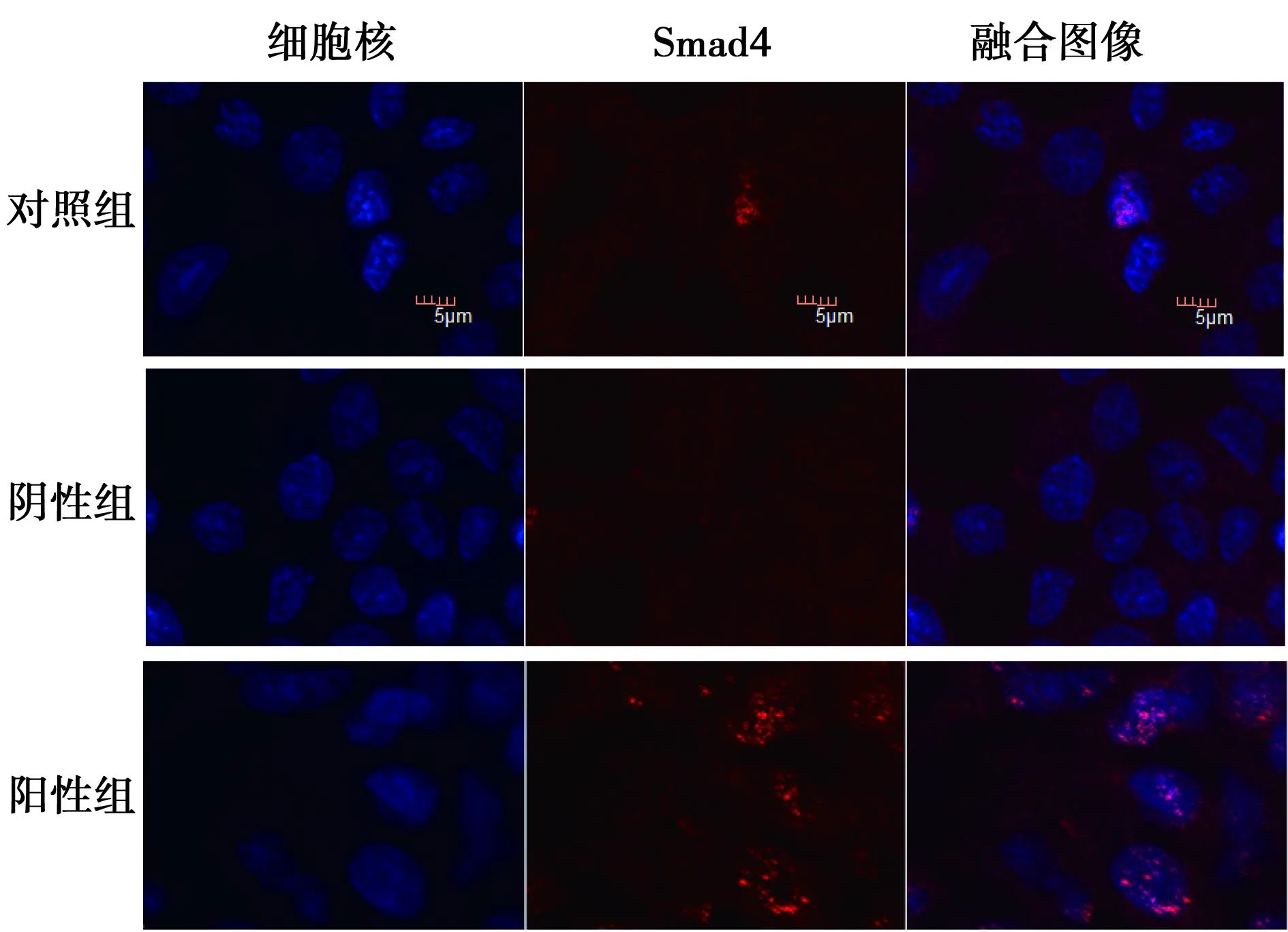
图2 激光共聚焦观察Smad4的质核分布情况(×200)
3讨论
缺血性脑卒中损伤机制与干预策略一直是临床与基础研究的热点。体内外研究发现,脑缺血后ActA表达增加,细胞外的ActA通过与细胞膜上的TGF-βⅡ型受体(TβRⅡ)结合磷酸化激活TGF-βⅠ型受体(TβRⅠ),继而活化细胞内Smads通路,完成跨膜信号的胞内转导〔9〕。Smads蛋白根据功能不同一般分为三类,膜受体激活的Smads(R-Smads),包括Smad1、2、3、5和8,在ActA/Smads通路中主要为Smad2和3发挥作用;通用Smad(Co-Smad)目前仅发现Smad4及抑制性Smads(I-Smads)包括Smad6和7〔10〕。作为ActA/Smads通路的下游位点,磷酸化的Smad2/3与Smads锚着蛋白(SARA)分离并与Smad4形成异二聚体,继而转入细胞核,与靶基因的表达调控区结合,完成对靶基因表达的调控〔11〕。
本研究结果说明重组载体稳定转染提高了PC12细胞内ActA的表达。ActA高表达可提高PC12细胞内ActA/Smads通路的基础活化水平。将ActA重组载体稳定转染PC12细胞,提高细胞内ActA的表达可通过上调Smad3表达,促进Smad3蛋白磷酸化活化的方式促进Smad4核内迁移,提高ActA/Smads通路的基础活化水平。此外,ActA内源性高表达可成为提高ActA/Smads通路神经保护功能的有效方法,其具体的生物学功能还有待进一步研究。
参考文献4
1Schubert D,Kimura H,LaCorbiere M,etal.Activin is a nerve cell survival molecule〔J〕.Nature,1990;344(6269):868-70.
2Florio P,Gazzolo D,Luisi S,etal.Activin A in brain injury〔J〕.Adv Clin Chem,2007;43:117-30.
3Mukerji SS,Katsman EA,Wilber C,etal.Activin is a neuronal survival factor that is rapidly increased after transient cerebral ischemia and hypoxia in mice〔J〕.J Cereb Blood Flow Metab,2007;27(6):1161-72.
4莽靖,何金婷,王娇琦,等.脑缺血损伤ActA与跨膜受体ActRⅡA在Smads转导通路中的表达〔J〕.中风与神经疾病杂志,2013;30(1):15-7.
5Mang J,Mei CL,Wang JQ,etal.Endogenous protection derived from Activin A/Smads transduction loop stimulated via ischemic injury in PC12 cells〔J〕.Molecules,2013;18(10):12977-86.
6He JT,Mang J,Mei CL,etal.Neuroprotective effects of exogenous Activin A on oxygen-glucose deprivation in PC12 cells〔J〕.Molecules,2011;17(1):315-27.
7Wang JQ,He JT,Du ZW,etal.Effects of SARA on oxygen-glucose deprivation in PC12 cell line〔J〕.Neurochem Res,2013;38(5):961-71.
8Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method〔J〕.Methods,2001;25(4):402-8.
9Shi Y,Massague J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus〔J〕.Cell,2003;113(6): 685-700.
10Kretzschmar M,Massagué J.SMADs: mediators and regulators of TGF-beta signaling〔J〕.Curr Opin Genet,1998;8(1):103-11.
11Qin BY,Lam SS,Correia JJ,etal.Smad3 allostery links TGF-beta receptor kinase activation to transcriptional control〔J〕.Genes,2002;16(15):1950-63.
〔2014-03-16修回〕
(编辑张慧)

