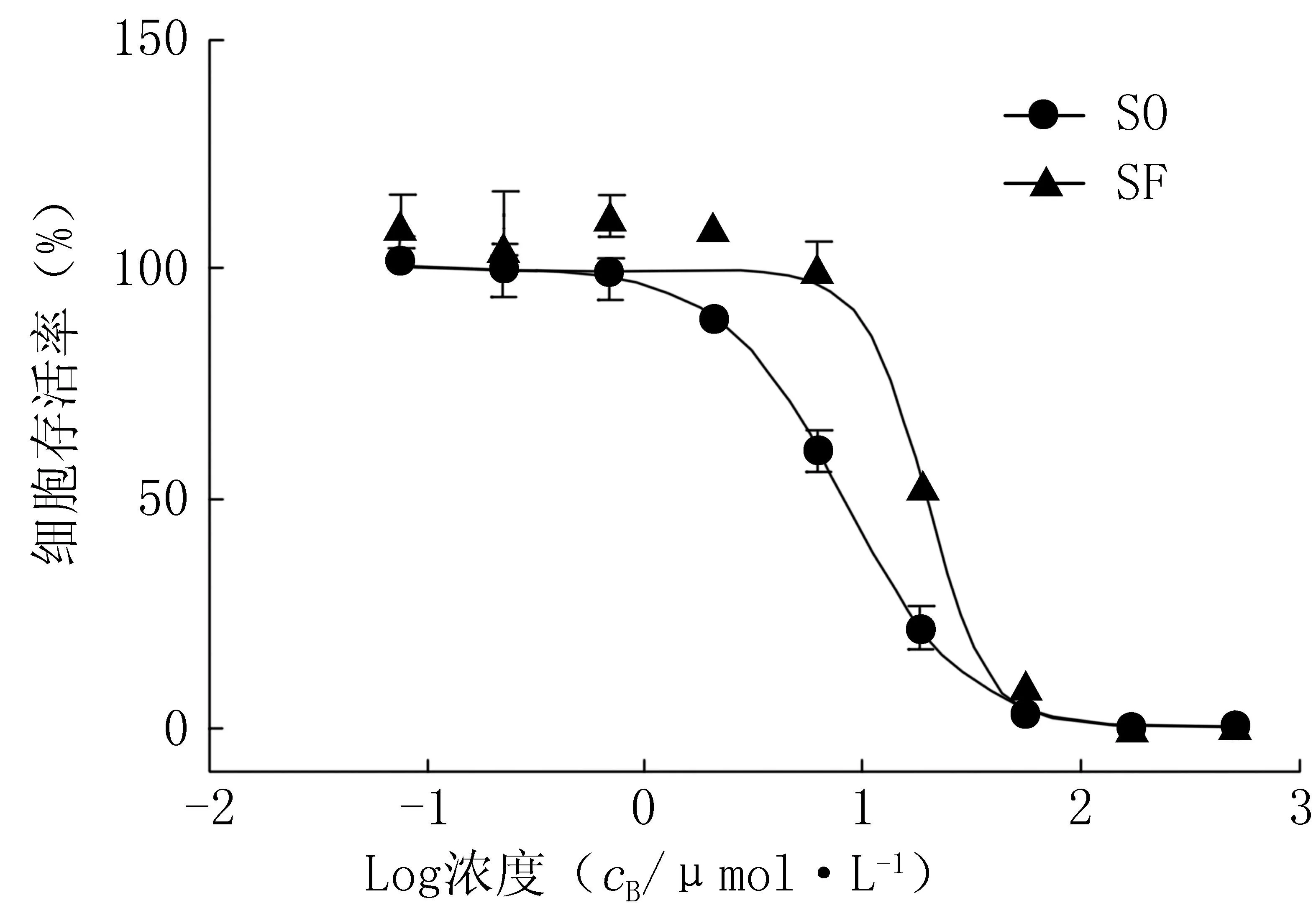
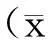索拉菲尼与异硫氰酸4-(甲基亚磺酰)丁酯体外协同杀伤肝癌细胞实验研究
·论著·
索拉菲尼与异硫氰酸4-(甲基亚磺酰)丁酯体外协同杀伤肝癌细胞实验研究
何文婷1,巩志荣2,孙治国2,王美平2,高洁2,钟延强2,鲁莹1,2(1.福建中医药大学药学系,福建 福州 350108;2 .第二军医大学药学院,上海 200433)
[摘要]目的 探讨索拉菲尼(sorafenib,SO)联合异硫氰酸4-(甲基亚磺酰)丁酯(sulforaphane,SF)杀伤肝癌细胞HepG2的协同比例。方法 采用CCK-8法探讨SO和SF对HepG2杀伤效果最强的协同比例,利用协同指数(CI)反映协同杀伤效应:CI>1.1为拮抗;0.9 [关键词]肝癌;索拉菲尼;异硫氰酸4-(甲基亚磺酰)丁酯;协同杀伤 [作者简介]何文婷,硕士研究生.E-mail:simona49@163.com [通讯作者]鲁莹,博士,副教授.研究方向:微粒靶向递药系统.Tel:02-81871290;E-mail:acuace@163.com [中图分类号]R965[文献标志码]A DOI[]10.3969/j.issn.1006-0111.2015.02.012 [收稿日期]2014-09-28[修回日期]2014-12-26 Synergic effects of sorafenib combined with sulforaphane against hepatocellular carcinoma cellsinvitro HE Wenting1,GONG Zhirong2,SUN Zhiguo2,WANG Meiping2, GAO Jie2,ZHONG Yanqiang2,LU Ying1,2(1.Department of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350108, China;2.Department of Pharmaceutics,School of Pharmacy, Second Military Medical University, Shanghai 200433,China) Abstract[]ObjectiveTo investigate the synergic ratio of sorafenib (SO) and sulforaphane (SF) against the hepatocellular carcinoma cell line HepG2 in vitro. MethodsThe synergic effect of SO combined with SF against HepG2 cells was determined by the CCK8 assay (the synergic effect was determined by combination index (CI) value: CI>1.1, antagonistic; 0.9 [Key words]hepatocellular carcinoma; sorafenib(SO); sulforaphane(SF);synergic effect 原发性肝癌(简称:肝癌)在我国癌症死亡率中已排名第二,索拉菲尼(sorafenib,SO)是一种双芳基尿素类口服多激酶抑制剂,可以靶向于肿瘤细胞及肿瘤血管上丝氨酸(苏氨酸)激酶及受体络氨酸激酶,具有同时抑制肿瘤细胞增殖和阻断血管生成的双重作用,是目前世界上第一个被批准应用于临床的多靶点的分子靶向治疗药物[1]。SO是治疗晚期肝癌的一线药物,能显著改善晚期肝癌患者的生存状态。然而,在胰脏神经内分泌瘤、胶质母细胞瘤和乳腺癌肿瘤鼠模型上研究显示[2,3],SO具有与抗血管生成物有关的作用,即增加了肿瘤的生长及肿瘤转移的可能。在许多恶性肿瘤中,SO可以诱导NF-κB的过表达,而NF-κB 被定义为上皮细胞间质转换(EMT)和乳腺癌转移模型的中介物。 异硫氰酸4-(甲基亚磺酰)丁酯(sulforaphane,SF)是一种在绿叶花菜中的异硫氰酸盐,在SO和SF联合治疗胰腺癌的研究中发现[4],尽管SF本身并未增强与启动子区域NF-κB复合物的结合,但它可显著降低SO介导的NF-κB活性。SF下调NF-κB活性在前列腺癌以及结、直肠癌中也有报道[5-7]。此外,也有研究表明,联合使用SO和SF可显著抑制由缺氧导致的细胞转移[4]。 基于以上研究,本实验首次研究观察SO联合SF对肝癌细胞HepG2的体外协同杀伤作用,以期降低由SO引起的肿瘤细胞转移副作用,为肝癌的体内研究及综合治疗提供实验依据。 1材料与方法 1.1药品与试剂SO(大连美仑生物技术有限公司),SF(天津大学合成),DMEM培养基 Hyclone(美国Thermo公司),小牛血清Gibco、0.25%胰蛋白酶溶液(含0.02%EDTA)Gibco(InvitrogenTM美国Life Technologies Corporation公司),CCK-8 (cell counting kit-8,日本Dojindo Laboratories),PBS(美国赛默飞世尔科技公司),二甲基亚砜 (DMSO,Sigma-Aldrich),0.4%台盼蓝染液(trypan blue)[研域(上海)化学试剂有限公司]。AnnexinV-FITC细胞凋亡试剂盒(美国BD公司)。 1.2细胞培养人肝癌细胞株HepG2在添加10%小牛血清的DMEM高糖培养基中于37 ℃、5% CO2的条件下连续培养;每2~3 d传代。所用细胞均为20代以内。 1.3药物配制精密称取SF 18.32 mg,溶解于10 ml水中,配制为10 mmol/L SF水溶液。精密称取SO 318.5 mg,溶解于5 ml DMSO溶剂中,配成100 mmol/L SO溶液,用聚氧乙烯蓖麻油、无水乙醇以1∶1比例稀释4倍。-20 ℃保存备用。 1.4实验方法 1.4.1CCK-8法检测SO与SF对HepG2细胞的杀伤活性取对数生长期的HepG2细胞,以每孔3 000个的密度接种于96孔板中,接种好的细胞于37 ℃、5% CO2的条件下培养12 h,让细胞贴壁。实验分为空白组、未处理组和药物处理组。进一步用添加10%小牛血清的DMEM培养基稀释SO与SF至500 μmol/L,进而以3倍比例稀释,共9个浓度,每组设3个复孔。于37 ℃、5% CO2的条件下药物作用48 h,加入10%CCK-8培养液,孵育2 h后,酶标仪测定在450 nm处的吸光度值(A)。计算细胞存活率(CV)∶CV(%)=(实验组A-空白组A)/(未处理组A-空白组A)×100%,Graphpad6.0计算半数抑制浓度(IC50)。实验重复3次。 1.4.2CCK-8法检测SO联合SF对HepG2细胞的杀伤作用细胞接种方法及分组同“1.4.1”。药物处理组包括单独SO、SF组以及不同比例SO与SF联合组。选取标准为单独SO或SF浓度杀伤范围涵盖5%~95%,选择单独SO和SF最高浓度分别为20、40 μmol/L,2倍比例稀释6个浓度;SO与SF联合组选取摩尔比20∶1、10∶1、5∶1、1∶1、1∶5、1∶10、1∶20 7个比例,且最高浓度比分别为800∶40、400∶40、200∶40、100∶100、40∶200、40∶400、40∶800,3倍比例稀释,分6个浓度,每个浓度设3个复孔,使得混合比例中单独的SO或者SF浓度杀伤范围也能够涵盖5%~95%。药物作用72 h后,使用CCK-8法检测450 nm处A值,并计算其存活率及杀伤效力Fa,Fa=1-CV,使用Compusyn1.0计算协同指数(CI)。实验重复3次。 1.4.3平板克隆形成实验检测协同拮抗及相加比例下的克隆形成数进一步使用平板克隆形成实验对协同、拮抗以及相加比例进行验证。取对数期1×105个/ml HepG2细胞接种于12孔板,同样在37 ℃、5% CO2的条件下培养12 h让细胞贴壁。实验分空白组和药物处理组。药物处理组包括单独SO、SF组,以及不同比例药物处理组。药物作用48 h后,弃去药物,用PBS洗2遍,0.25%胰酶消化后吹打成单个悬浮细胞,细胞计数板计数,逐级稀释,按照200个/ml、每孔2 ml接种于6孔板中,每组3个复孔,继续在37 ℃、5% CO2的条件下培养。每4 d换液,10 d后,当出现肉眼可见克隆时终止培养,弃去培养基,用PBS清洗,1%结晶紫染色20 min,PBS洗2遍,拍照,显微镜下计数。 1.4.4AnnexinV/PI检测协同拮抗及相加比例下的细胞凋亡采用 FITC-Annexin V和碘化丙啶试剂分析各药物处理组细胞的凋亡。对数期2×105个/ml HepG2细胞接种于6孔板, 在37 ℃、5% CO2的条件下培养12 h让细胞贴壁。实验分组同“1.4.3”,每组2个复孔。药物作用48 h后,保留上清液,使用不含EDTA 0.25%胰酶消化细胞,PBS洗2遍,加入500 μl结合液,加入5 μl Annexin V-FITC与5 μl碘化丙啶,轻轻混匀。室温(20~25 ℃)避光孵育10 min。待孵育结束后入流式细胞仪检测。 2实验结果 2.1SO与SF单独杀伤HepG2细胞0.076~500 μmol/L的SO和SF 对HepG2细胞的抑制呈现浓度依赖效应, 即随着药物浓度增加,细胞生长抑制效应也增强(图1)。SO和SF对HepG2细胞作用48 h的半数抑制浓度IC50分别为(8.105±3.098)、(20.93±3.083) μmol/L。 图1 SO与SF单独对肝癌细胞 HepG2的细胞存活率(n=3, ±s,%) 2.2SO与SF协同杀伤HepG2细胞通过比较不同比例下不同浓度的SO和SF对HepG2细胞的抑制率以及协同指数CI值来评价两药的协同效果。当CI>1.1、0.9 图2 SO与SF联合治疗对HepG2 肝癌细胞的杀伤作用(n=3, ±s) 2.3平板克隆形成实验验证SO与SF协同杀伤效果分别选取SO∶SF协同、相加、拮抗比例5∶1、10∶1、1∶1,对不同比例下不同浓度的协同、相加、拮抗作用进行验证。结果显示,当SO∶SF在5∶1协同比例下(图3G组)其克隆形成数(14.66±4.08)与单独使用SO(24.0±3.60)或SF(25.7±1.57)相比具有显著性差异,P<0.01;并且协同比例下克隆形成数(14.66±4.08)也明显低于拮抗比例1∶1(图3H组)克隆形成数(31.33±5.16),P<0.01;10∶1(图3F组)相加比例下克隆形成数(24.67±3.52)与单独使用SO或SF无显著性差异,P>0.05,结果均在预期范围之内(图 3)。 图3 SO与SF单独或联合作用对HepG2 细胞克隆形成数的影响 ( *P<0.05, **P<0.01,与B组比较, △△P<0.01,与G组比较,n=3);A.空白组;B.SO 4 μmol/L;C.SF 4 μmol/L;D.SF 0.8 μmol/L;E.SF 0.4 μmol/L;F.SO (4 μmol/L)+ SF(0.4 μmol/L);G.SO (4μmol/L)+SF(0.8 μmol/L); H.SO(4 μmol/L)+SF(4 μmol/L) 2.4SO与SF协同比例下促进HepG2细胞的凋亡SO与SF主要抑制HepG2细胞早期凋亡。如表1所示,未经任何药物处理的细胞,早期以及晚期凋亡的细胞总量不到 10% (8.44%±1.75%),且在协同比例5∶1时,SO与SF浓度分别是8、1.6 μmol/L时其早期凋亡率(18.9±3.87)%明显高于拮抗比例1∶1,两药浓度分别是8、8 μmol/L时的早期凋亡率(4.76±0.06)%;且协同、拮抗比例组的早期凋亡率分别为(18.9±3.87)%、(4.76±0.06)%,与单独SO组(5.31±1.86)%相比,P<0.01,但相加比例组的早期凋亡率(12.9±2.73)%与单独SO组(5.31±1.86)%相比也有显著性差异(P<0.01)。 **P<0.01,与SO=8 μmol/L组比较 3讨论 SO联合奥沙利铂[9]、5-FU和甲酰四氢叶酸[10]、阿霉素[11]、多烯紫杉醇[12]、紫杉醇和卡铂[13]等药,在一些Ⅰ、Ⅱ期临床试验中显示出良好的抗肿瘤活性。从机制上讲,SO一方面抑制了由内皮细胞表达的VEGF-2和VEGF-3,另一方面抑制了PDGFR-β、FLT3、Ret及c-Kit[14,15],从而具有抑制肿瘤细胞增殖和阻断血管生成的双重作用。 SF的化学预防肿瘤效果通过阻断作用和抑制作用两方面进行评价[16]。阻断作用表现在SF 通过抑制Ⅰ期新陈代谢酶来抑制致癌前物质转变为致癌物,并诱导Ⅱ期新陈代谢酶促进致癌物的排泄。而SF 的抑制作用在于诱导细胞凋亡和与细胞周期停滞相关的分子,包括Bcl-2 蛋白家族、caspases、P21,细胞周期蛋白(cyclins)以及细胞周期蛋白激酶[17]。此外,SF可以通过下调血管内皮生长因子(VEGF)(HIF-1低氧诱导性因子-1)、基质金属蛋白酶2、基质金属蛋白酶9来抑制血管生成和肿瘤转移[17]。 抗肿瘤药物的联合作用是协同还是拮抗取决于两药联合使用的浓度与比例。有研究表明,当喜树碱与阿霉素以5∶1的比例同时作用于胶质瘤细胞时,显示出明显的拮抗作用,而以1.5∶1比例作用时则表现出协同作用[18]。 本实验通过比较SO与SF的7种不同摩尔比,每个比例筛选6种不同浓度,利用协同指数(CI)值,筛选出对肝癌细胞HepG2的协同、拮抗及相加比例,并通过平板克隆形成实验及细胞凋亡结果对不同比例进行验证,结果表明SO与SF在5∶1比例下,其克隆形成数与诱导细胞凋亡的能力均显著强于两药在1∶1拮抗比例下的作用效果(P<0.01)。目前还未见关于两药联合作用于肝癌细胞的相关文献报道。 此外,肿瘤细胞生长、 增殖、 分化和转移相关的信号传导是一个极其复杂、 多因素、多途径的蛋白网络系统,因此针对某个单一靶点进行治疗,往往不足以遏制肿瘤的进展,需要联合不同作用途径和机制的药物多靶点联合阻断信号传导、 抑制肿瘤生长。SO与SF联合作用的机制可能与相关信号转导通路NF-κB相关,两药联合作用的机制以及在体内试验的作用效果还有待进一步研究。药物联合的最佳应用模式及对其他肿瘤的疗效仍需大量体内试验及临床试验进一步研究,争取对特定的、适合的肿瘤患者实施个体化治疗,以最小的经济代价获得最佳的治疗效果。 【参考文献】 [1]Wilhelm SM,Adnane L,Newell P,etal.Preclinical over view of sorafenib,a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling[J].Mol Cancer Ther,2008,7(10):3129 3140. [2]Paez-Ribes M, Allen E, Hudock J,etal. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis[J].Cancer Cell,2009,15(3):220 231. [3]Ebos JM, Lee CR, Cruz-Munoz W,etal. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis[J]. Cancer Cell,2009,15(3):232 239. [4]Rausch V, Lui L, Kallifatidis G,etal. Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics[J]. Cancer Res,2010,70(12):5004-5013. [5]Choi S, Lew KL, Xiao H,etal. D,L-Sulforaphane-induced cell death in human prostate cancer cells is regulated by inhibitor of apoptosis family proteins and Apaf-1[J]. Carcinogenesis,2007,28(1):151 162. [6]Xu C, Shen G, Chen C,etal. Suppression of NF-kappaB and NF-kappaB-regulated gene expression by sulforaphane and PEITC through IkappaBalpha, IKK pathway in human prostate cancer PC-3 cells[J]. Oncogene,2005,24(28):4486-4495. [7]Jeong WS, Kim IW, Hu R,etal. Modulatory properties of various natural chemopreventive agents on the activation of NF-kappaB signaling pathway[J]. Pharm Res,2004,21(4):661 670. [8]Tardi P, Johnstone S, Harasym N,etal.Invivomaintenance of synergistic cytarabine:daunorubicin ratios greatly enhances therapeutic efficacy[J].Leuk Res,2009,33(1):129-139. [9]Kupsch P, Henning B, Passarge K,etal. Results of a phase Ⅰ trial of sorafenib (BAY 43-9006) in combination with oxaliplatin in patients with refractory solid tumors, including colorectal cancer[J]. Clin Colorectal Cancer, 2005,5(3):188-196. [10]Lee J, Kang WK, Kwon JM,etal.Phase Ⅱ trial of irinotecan plus oxaliplatin and 5-fluorouracil/leucovorin in patients with untreated metastatic gastric adenocarcinoma.[J].Ann Oncol,2007,18(1):88-92. [11]Richly H, Henning B, Kupsch P,etal. Results of a phase Ⅰ trial of sorafenib (BAY 43-9006) in combination with doxorubicin in patients with refractory solid tumors[J]. Ann Oncol,2006,17(5):866 873. [12]Jonge MJA, Dumez H,Kitzen JEM,etal. Phase Ⅰ safety and pharmacokinetic study of SU-014813 in combination with docetaxel in patients with advanced solid tumours[J].Eur J Cancer,2011,47(9):1328-1335. [13]Flaherty KT, Lee SJ, Zhao F,etal.Phase Ⅲ trial of carboplatin and paclitacel with or without sorafenib in metastatic melanoma[J].J Clin Oncol,2013,31(3):373-379. [14]Wilhelm SM, Carter C, Tang L,etal. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Res,2004,64(19):7099-7109. [15]Carlomagno F, Anaganti S, Guida T,etal. BAY 43-9006 inhibition of oncogenic RET mutants[J]. J Natl Cancer Inst, 2006,98(5):326-334. [16]Clarke JD, Dashwood RH, Ho E. Multi-targeted prevention of cancer by sulforaphane[J].Cancer Lett, 2008,269(2):291-304. [17]Zhang Y, Tang L. Discovery and development of sulforaphane as a cancer chemopreventive phytochemical[J].Acta Pharmacol Sin, 2007,28(9):1343-1354. [18]Pavillard V, Kherfellah D, Richard S,etal. Effects of the combination of camptothecin and doxorubicin or etoposide on rat glioma cells and camptothecin-resistant variants[J].Br J Cancer, 2001,85(7):1077-1083. SM,Adnane L,Newell P,etal.Preclinical over view of sorafenib,a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling[J].Mol Cancer Ther,2008,7(10):3129 3140. [2]Paez-Ribes M, Allen E, Hudock J,etal. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis[J].Cancer Cell,2009,15(3):220 231. [3]Ebos JM, Lee CR, Cruz-Munoz W,etal. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis[J]. Cancer Cell,2009,15(3):232 239. [4]Rausch V, Lui L, Kallifatidis G,etal. Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics[J]. Cancer Res,2010,70(12):5004-5013. [5]Choi S, Lew KL, Xiao H,etal. D,L-Sulforaphane-induced cell death in human prostate cancer cells is regulated by inhibitor of apoptosis family proteins and Apaf-1[J]. Carcinogenesis,2007,28(1):151 162. [6]Xu C, Shen G, Chen C,etal. Suppression of NF-kappaB and NF-kappaB-regulated gene expression by sulforaphane and PEITC through IkappaBalpha, IKK pathway in human prostate cancer PC-3 cells[J]. Oncogene,2005,24(28):4486-4495. [7]Jeong WS, Kim IW, Hu R,etal. Modulatory properties of various natural chemopreventive agents on the activation of NF-kappaB signaling pathway[J]. Pharm Res,2004,21(4):661 670. [8]Tardi P, Johnstone S, Harasym N,etal.Invivomaintenance of synergistic cytarabine:daunorubicin ratios greatly enhances therapeutic efficacy[J].Leuk Res,2009,33(1):129-139. [9]Kupsch P, Henning B, Passarge K,etal. Results of a phase Ⅰ trial of sorafenib (BAY 43-9006) in combination with oxaliplatin in patients with refractory solid tumors, including colorectal cancer[J]. Clin Colorectal Cancer, 2005,5(3):188-196. [10]Lee J, Kang WK, Kwon JM,etal.Phase Ⅱ trial of irinotecan plus oxaliplatin and 5-fluorouracil/leucovorin in patients with untreated metastatic gastric adenocarcinoma.[J].Ann Oncol,2007,18(1):88-92. [11]Richly H, Henning B, Kupsch P,etal. Results of a phase Ⅰ trial of sorafenib (BAY 43-9006) in combination with doxorubicin in patients with refractory solid tumors[J]. Ann Oncol,2006,17(5):866 873. [12]Jonge MJA, Dumez H,Kitzen JEM,etal. Phase Ⅰ safety and pharmacokinetic study of SU-014813 in combination with docetaxel in patients with advanced solid tumours[J].Eur J Cancer,2011,47(9):1328-1335. [13]Flaherty KT, Lee SJ, Zhao F,etal.Phase Ⅲ trial of carboplatin and paclitacel with or without sorafenib in metastatic melanoma[J].J Clin Oncol,2013,31(3):373-379. [14]Wilhelm SM, Carter C, Tang L,etal. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Res,2004,64(19):7099-7109. [15]Carlomagno F, Anaganti S, Guida T,etal. BAY 43-9006 inhibition of oncogenic RET mutants[J]. J Natl Cancer Inst, 2006,98(5):326-334. [16]Clarke JD, Dashwood RH, Ho E. Multi-targeted prevention of cancer by sulforaphane[J].Cancer Lett, 2008,269(2):291-304. [17]Zhang Y, Tang L. Discovery and development of sulforaphane as a cancer chemopreventive phytochemical[J].Acta Pharmacol Sin, 2007,28(9):1343-1354. [18]Pavillard V, Kherfellah D, Richard S,etal. Effects of the combination of camptothecin and doxorubicin or etoposide on rat glioma cells and camptothecin-resistant variants[J].Br J Cancer, 2001,85(7):1077-1083. [本文编辑]李睿旻