乙酸乙酯皂化反应的热动力学实验*
基金资助:国家基础科学人才培养基金(No.J1210014)
张来英* 陈良坦 李海燕
*通讯联系人,E-mail:wuzhly@xmu.edu.cn
(厦门大学化学化工学院 福建厦门 361005)
乙酸乙酯皂化反应的热动力学实验*
*基金资助:国家基础科学人才培养基金(No.J1210014)
张来英*陈良坦李海燕
*通讯联系人,E-mail:wuzhly@xmu.edu.cn
(厦门大学化学化工学院福建厦门 361005)
摘要介绍基于量热法的热动力学原理。利用该方法测定了乙酸乙酯皂化反应的速率常数,并比较了该方法与电导法的优缺点。
关键词乙酸乙酯皂化量热法热动力学
Studying Thermodynamics of the Saponification of Ethyl Acetate*
Zhang Laiying**Chen LiangtanLi Haiyan
(CollegeofChemistryandChemicalEngineering,XiamenUniversity,Xiamen361005,Fujian,China)
AbstractMicro-calorimetric method for studying thermodynamics of the saponification of ethyl acetate has been introduced. The reaction rate constant can be calculated easily from the related dates measured. Studies have also been carried out to compare the micro-calorimetric method with the electrical conductivity detection.
Key WordsSaponification of ethyl acetate; Micro-calorimetric method; Thermodynamics
热动力学是利用量热手段研究动力学问题的一个物理化学分支,也是量热学在化学领域的一个重要应用。它主要是通过自动量热计连续、准确地检测和记录一个化学反应的热谱曲线,再根据热谱曲线并结合有关的热动力学方程,为化学反应过程提供重要的热力学和动力学数据[1]。由于热动力学使量热学从传统的“静态”研究发展到“动态”研究领域,而且它又有不受反应体系的溶剂性质、光谱学性质和电学性质限制的特点,因此,热动力学方法已在包括物理化学[2-4]、生物化学[5-7](如酶促反应、生物振荡反应、细胞的新陈代谢、细菌的生长及抑制过程)、表面/界面化学[8](如溶解反应、表面吸附、界面作用)等领域展示了日益广阔的应用前景[9]。
1实验目的
①了解量热法原理,掌握微量量热计的使用方法及应用;②了解热动力学方法在一些特殊反应中的应用;③用3114/3236 TAM Air微量等温热量计测定乙酸乙酯皂化反应的速率常数。
2实验原理
目前的量热计一般为热导式量热计,其输入函数Ω(放热速率)与输出函数Δ(温差电信号)之间可用Tian方程描述,如式(1)。
(1)
式中K为热量常数,其单位为1;Λ为热容系数,其单位为s。
Tian方程是热谱曲线的微分方程式,当从0到t的时间范围内进行积分,便有:
(2)
式中Qt为化学反应在时刻t前的热效应,若为恒压体系,则为ΔrHt;a为反应在时刻t前的峰面积;Δ为经校正后的t时热谱峰(谷)的大小。
在反应结束后,Δ= 0,则有:
Q∞=KA
(3)
式中Q∞为反应过程的总热效应,若为恒压,则为ΔrH∞;A为热谱曲线的总面积。
当从0到t的时间范围内积分,可得:
(4)
对反应的全过程进行积分,则有:
(5)
可见:在容积不变的反应体系中,有:
(6)
式中c0为反应物初始浓度;x为t时刻反应物剩余浓度。
将式(2)代入式(6)可得:
(7)
式中Q前为热谱曲线中t时刻的热效应,可由热谱曲线上直接得到。当ΛΔ=0时,Q前=Qt。
下面对式(7)进行讨论。
Q前+ΛΔ 因Λ为常数,ΛdΔ 由于Λ>0,因此。 若不考虑产物的抑制或促进作用对反应速率的影响,则用于求动力学参数的反应时间范围应介于最大峰高时间tm和反应结束时间te之间,即tm 从式(7)并结合几种常见的不可逆反应的动力学方程,可得到以F(t)表示的热动力学方程(表1)。 表1 几种常见的不可逆反应的热动力学方程 在F(t)的表达式中,Q∞、Q前、Δ、t均可从热谱曲线上得到。因此,只要求得热容常数Λ即可求得各种不可逆反应的速率系数。若测定各不同温度下的k值,可进一步求得表观活化能Ea。 求Λ的方法:在恒功率热谱曲线上,当稳态峰高出现后,以恒功率法求。这时热容常数与稳态峰高Δ及断开恒功率源的热效应Qe有如式(8)的关系: (8) 3实验试剂和仪器 氢氧化钠,乙酸乙酯,苯二甲酸氢钾。 实验室所用水均为二次蒸馏水,NaOH(aq)的准确浓度用苯二甲酸氢钾标定。 3114/3236 TAM Air微量等温热量计,电子分析天平,滴定装置,玻璃器皿。 4实验步骤 配制NaOH溶液,用苯二甲酸氢钾标定其浓度;准确配制乙酸乙酯溶液;在20mL参比安瓿瓶中装入10.00mL蒸馏水;移取准确浓度的乙酸乙酯溶液(V1)于20mL样品安剖瓶内,用1mL注射器移取适量标定好的NaOH溶液(10.00-V1),使反应体系为预定的pH;安装好注射器及搅拌装置;将参比安瓿瓶及安装好注射器和搅拌装置的样品安瓿瓶放入已恒温且标定好的TAM Air量热仪中,开动搅拌器搅拌。待热谱基线稳定后,将注射器中NaOH溶液注入样品安瓿瓶中,记录热谱曲线(图1)。 5注意事项 ① 要排尽注射器中吸入的气体:将注射器倒置,轻敲管壁,将气泡赶至针尖处,缓慢推动活塞,将气泡挤出。 ② 用少量真空油脂封住针头。 ③ 参比和样品安瓿瓶放入通道前必须用脱脂棉擦拭外壁,确保无尘且无其他颗粒,防止外壁所挂液体腐蚀通道。 ④ 搅拌器的搅拌头应用聚四氟乙烯密封。 ⑤ 参比和样品安瓿瓶必须缓慢滑入测量筒(不需用外来力),以减少热扰动,缩短达到平衡的时间。 ⑥ 定期检查、维护位于仪器下部风扇上的玻璃纤维空气过滤器。 ⑦ 标定和测量时应尽量减少室内空气的流动。也可在所有通道中放置装有等体积去离子水的安瓿瓶(测量时除样品和对应的参比通道),使仪器更快达到平衡。 6结果与讨论 在热谱曲线中,从反应结束到热谱曲线回到基线的热谱曲线线段内,取不同时间的Q后对Δ作图,得直线斜率即为Λ。求得Λ值后,在介于最大峰高时间tm和反应时间te之间的热谱曲线线段内,取一组{Q后,Δt}值,代入,可得值。最后利用表1的二级反应热动力学方程,求得k2(表2)。 由表2可知,热导式热量计的测定结果为k2=0.2007L·mol-1·s-1(308.15K),文献值[10]为k2=0.2037L·mol-1·s-1(308.15K),相当一致。 表2 308.15K时乙酸乙酯皂化反应的热谱数据和反应速率常数 本实验与常规电导法测定乙酸乙酯皂化反应的速率常数相比较有如下优势: ① 乙酸乙酯皂化反应是放热的,对量热法是适用的。但对电导法,由于无法搅拌,温度波动大,温度对电导率的影响大,造成初期线性差。对动力学实验而言,初期的数据很重要,因为实验中后期产物往往产生抑制作用,特别是对本实验,抑制作用很明显。 ② 量热法带有搅拌器,可适当提高浓度。对于电导法,浓度大时会成非均相,且反应快,但低的初始浓度又会引起作图公式的误差(因该公式只有在初始浓度相同的前提下才成立),所以,如果由于乙酸乙酯的挥发或NaOH吸收CO2而改变浓度,则会造成很大的误差。 ③ 杂质的影响。对电导法而言,凡对电导率有贡献的溶剂(水)或杂质(反应物或产物)均会干扰实验结果。 ④ 量热法同样适用于初始浓度不相等的二级反应。另外,用常规动力学方法较难以处理的反应体系诸如聚合反应、胶束催化等,量热法有实验方便、结果准确度较高等优越性。 7教学效果 本实验已经于2008年开始作为本科生的探索性实验苯胺聚合的热动力学以及胶束催化肉桂油水解制备苯甲醛的内容之一(作为验证性实验)开设并取得良好效果。学生普遍认为热动力学方法揭示了物理化学基本原理的联系,有助于加深学生对博大精深的物理化学基本原理的理解;在拓展学习思路、拓宽实验方法、培养创新意识方面,大家都觉得受益匪浅。 参考文献 [1] 曾宪诚,张元勤.化学反应热动力学理论与方法.北京:化学工业出版社,2003 [2] 曾宪诚,李启麟,秦自明,等.高等学校化学学报,1995,16(6):937 [3] Wilson R J,Reezer A E,Mitchell J C.ThermochimicaActa,1995,264(1/2):27 [4] 胡新根,林瑞森,宗汉兴.化学学报,1996,54(11):1060 [5] Fidaleo M,Lavecchia R.ThermochimicaActa,2003,402(1/2):19 [6] Prado A G S,Airoldi C.ThermochimicaActa,2000,349(1):17 [7] 朱建裕,刘义,胡岳华,等.化学学报,2006,64(6):508 [8] Hills A K,Gaisford S,Beezer A E,etal.ThermochimicaActa,2003,399(1/2):91 [9] 陈家玮,鲍征宇.地质通报,2007,26(12):1564 [10]孙尔康,徐维清,邱金恒.物理化学实验.南京:南京大学出版社,1998 中图分类号O6;G64 doi:10.3866/pku.DXHX20150256

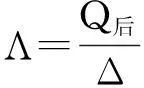
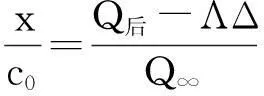
3.1 实验试剂
3.2 实验仪器

6.1 实验结果
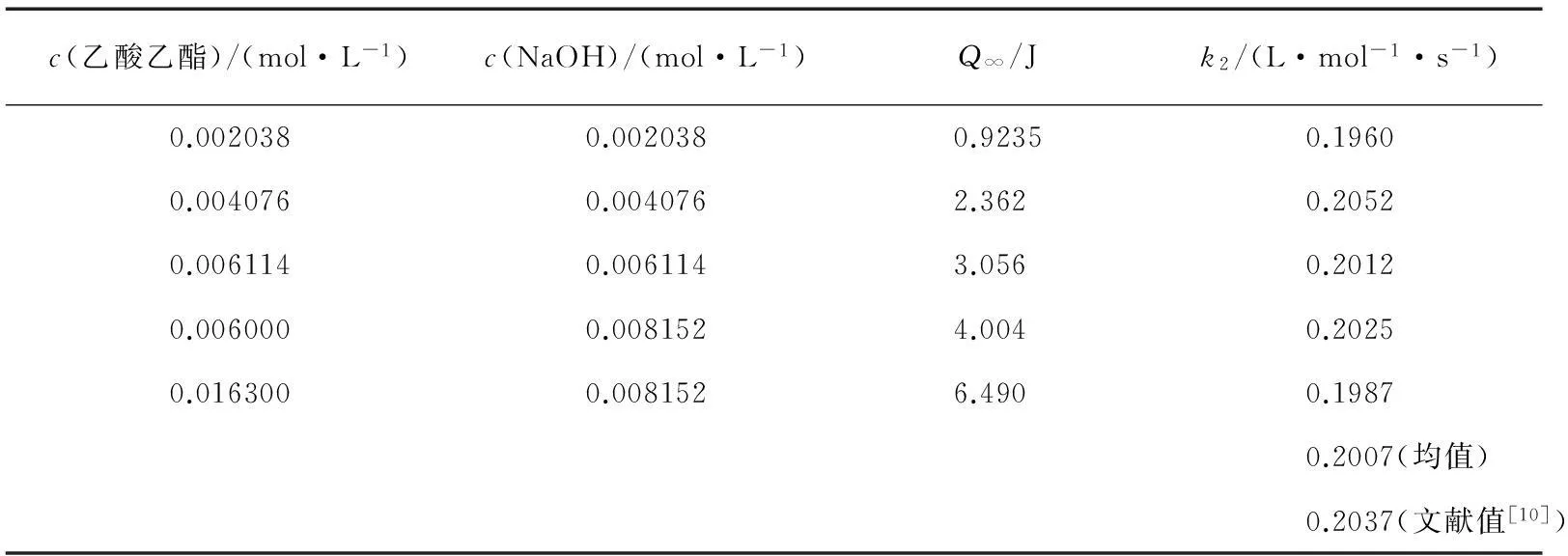
6.2 讨论


